
- •Тема 7. Основные реакции сталеплавильных процессов 1
- •Основные реакции сталеплавильных процессов
- •Поведение основных примесей шихты при производстве стали
- •Химическое сродство элементов
- •Условия окисления кремния
- •Условия окисления марганца
- •Удаление фосфора (дефосфорация)
- •Удаление серы (десульфурация)
- •Роль реакции окисления углерода
- •Роль реакции окисления в сталеплавильных процессах
- •Кинетика окисления углерода
- •Основы дегазации стали
- •Раскисление стали
- •Неметаллические включения в стали
- •Легирование стали
Условия окисления марганца
Марганец элемент легкоокисляющийся, особенно при сравнительно невысоких температурах; при этом могут образовываться следующие оксиды марганца: MnO2, Mn2O3, Mn3O4, MnO. При высоких температурах устойчивой является только закись марганца MnO.
Рассмотрим схемы реакций окисления марганца:
Расходуется кислород газовой фазы
Mn+1/2O2= (MnO).(7.1‑14)
Тепловой эффект Q составляет 362 кДж/моль.
Кислород, растворенный в металле
[Mn] + [O] = (MnO),Q = 162 кДж/моль. (7.1‑15)
3. Кислород шлака
Mn+ (FeO) = (MnO) +Fe,Q = 121 кДж/моль . (7.1‑16)
Также как и в реакциях окисления кремния, реакции окисления марганца характеризуются значительным тепловым эффектом. Продукт реакции шлакообразующий оксид. Основное место протекания реакции – граница раздела металл-шлак, поэтому марганец преимущественно окисляется по схеме (7.1-16). Для этой реакции
![]() , (7.1‑17)
, (7.1‑17)
откуда
![]() . (7.1‑18)
. (7.1‑18)
Таким образом, полнота окисления марганца в сталеплавильных процессах зависит от температуры и состава шлака.
Зависимость от температуры представлена уравнением (7.1-11). Величина теплового эффекта реакций окисления марганцаQ0, следовательно, с понижением температуры (Т) константа реакции возрастает (К), что приводит к понижению содержания марганца в металле (Mn). С ростом температуры константа уменьшается, следовательно, возможен процесс восстановления марганца при определенном составе шлака.
Влияние состава шлака
(MnO) – основной оксид, в кислых шлаках прочно связывается с SiO2:
(MnO) + (SiO2) = MnOSiO2 , (7.1‑19)
2(MnO) + (SiO2) = 2MnOSiO2 . (7.1‑20)
В кислых шлаках а(MnO) 0 . Под кислыми шлакамиMnокисляется наиболее полно и необратимо.
В основных шлаках Mnнаходится в свободном состоянии иа(MnO)(MnO), то есть к фактической концентрации в шлаке. Поэтому в основных процессах [Mn] окисляется менее полно и обратимо. Чем выше окислительная способность шлака (содержание(FeO)), тем полнее окисляетсяMn([Mn]). В общем случае влияние состава шлака на содержание [Mn] можно представить в виде диаграммы (рис. 7.1-3).
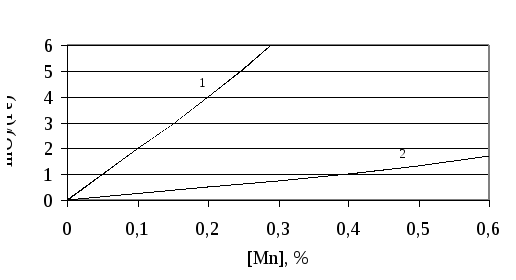
Рис. 7.1-3. Влияние состава шлак на содержание марганца в металле:
1 – кислый шлак; 2 – основной
Удаление фосфора (дефосфорация)
Влияние фосфора на свойства можно определить из диаграммы состояния Fe-P. Растворимость фосфора в -Fe снижается при температуре меньше 1050оС, то есть в условиях низкой диффузионной способности. Это приводит к образованию метастабильных растворов в стали, к напряжению решетки железа и снижению пластичности (особенно в областях низких температур).
При нагревании метастабильные растворы распадаются с выделением Fe3Pпо границам зерен металла, которые обладают повышенной хрупкостью. Пластические свойства металла при этом ухудшаются. Такое явление называетсяотпускная хрупкость или хладноломкость металла.
Фосфор является склонным к перераспределению по объему слитка в процессе кристаллизации. Это явление называется ликвационной способностью.
В стали обычного качества содержание фосфора не должно превышать 0,045 % в любом месте слитка. Следовательно, с учетом ликвационной способности, в жидком металле содержание фосфора должно быть меньше 0,01- 0,015 %.
Дефосфорация металла заключается в переводе фосфора из металла в шлак. Этот перевод в чистых сплавах Fe-P при отсутствии примесей можно осуществить по реакции
2[P] + 5(FeO) = (P2O5) + 5[Fe]. (7.1‑21)
При наличии углерода в металле, углерод будет восстанавливать фосфор из оксида, т.к. обладает большим сродством к кислороду, чем фосфор, то есть углерод окисляется за счет кислорода (Р2О5) по реакции
(P2O5) + 5[С] = 2[P] + 5{CO}. (7.1‑22)
Единственный путь удаления фосфора – связывать его в прочное химическое соединение тетрафосфат кальция (4CaOP2O5)
(P2O5) + 4(CaO) = (4CaOP2O5). (7.1‑23)
Таким образом, дефосфорация протекает в две стадии:
1. Окисление фосфора металла кислородом (FeO) по реакции (7.1-21) и переход (P2O5) в шлак.
2. Перевод (P2O5) в прочное химическое соединение (4CaOP2O5) по реакции (7.1-23).
Суммируя первую и вторую стадии получаем
2P + 5(FeO) + 4(CaO) = (4CaO P2O5) + 5Fe. (7.1‑24)
Тепловой эффект реакции (7.1-24) составляет 1370 кДж/моль. Полнота протекания процесса характеризуется коэффициентом дефосфорации
![]() . (7.1‑25)
. (7.1‑25)
В
нашем случае
![]() . (7.1‑26)
. (7.1‑26)
Чем полнее прошла дефосфорация, тем выше коэффициент дефосфорации. Зависимость LPот состава шлака и температуры можно установить из уравнения суммарной реакции (7.1-24)
![]() .
(7.1‑27)
.
(7.1‑27)
Видно, что в выражение (7.1-27) входит выражение (7.1-26). Следовательно
![]() . (7.1‑28)
. (7.1‑28)
Полнота протекания реакции (коэффициент дефосфорации) зависит от состава шлака и температуры и возрастает с ростом основности шлака (СаО), с ростом окисляющей способности шлака (FeO), с увеличением константы равновесия, следовательно, с понижением температуры (для экзотермических реакций сtоС, К). Таким образом, дефосфорация происходит на начальных стадиях сталеварения.
