лабораторная работа №2.
..docxВыполнила: Васькина Е.М.
Группа: ЕН-110 305(И-103)
Лабораторная работа 2.
Определение теплоты гидратации кристаллогидрата сульфата меди CuSO45H2O.
Цель работы – определение теплоты гидратации кристаллогидрата сульфата меди CuSO45H2O.
1. Краткая теория.
В соответствии с первым законом термодинамики изменение внутренней энергии термодинамической системы запишется:
 .
.
Если реакция протекает при постоянном объеме и при этом не совершается механической, электрической и других видов работы, то при Т = const можно записать:
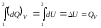 (1.2)
(1.2)
Если реакция протекает при постоянном давлении и совершается только работа расширения, а все другие виды работ отсутствуют, то изменение энтальпии в ходе реакции будет равна теплоте:
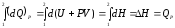 . (1.3)
. (1.3)
Смысл соотношений (1.2) и (1.3) состоит в том, что теплота реакции, поглощаемая (выделяемая) при постоянном объеме или давлении, становится термодинамической функцией состояния, и поэтому не зависит от пути процесса (закон Гесса). Из закона Гесса вытекает очень важное для химии следствие:
 , (1.4)
, (1.4)
i - продукты реакции
j - исходные вещества
Теплота
растворения твердого кристаллического
вещества в жидком растворителе
определяется в основном суммой двух
величин: теплоты разрушения кристаллической
решетки и теплоты сольватации ионов
(атомов или молекул) растворяемого
вещества молекулами растворителя.
Алгебраическая сумма тепловых эффектов
этих двух процессов дает теплоту
(изменение энтальпии) процесса растворения
соли. Значения теплот растворения
зависят от
концентрации соли в растворе и от того
были ли смешиваемые компоненты в начале
взяты в чистом виде. Теплота, сопровождающая
процесс изотермического растворения
одного моля вещества в таком количестве
растворителя, чтобы образовался раствор
с определенной концентрацией, называется
интегральной
теплотой растворения
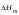
 .
Интегральная теплота растворения
зависит от концентрации полученного
раствора, поэтому для данного вещества
можно получить ряд значений
.
Интегральная теплота растворения
зависит от концентрации полученного
раствора, поэтому для данного вещества
можно получить ряд значений
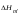 ,
относящихся к определенным концентрациям,
например, долевым
,
относящихся к определенным концентрациям,
например, долевым
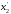 ,
,
 …
…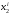 =n2/(n1+n2)
(см. рис.1.1). Значение
=n2/(n1+n2)
(см. рис.1.1). Значение
 называют первой интегральной
теплотой растворения; она равна тепловому
эффекту при растворении одного моля
вещества в бесконечно большом количестве
растворителя.
называют первой интегральной
теплотой растворения; она равна тепловому
эффекту при растворении одного моля
вещества в бесконечно большом количестве
растворителя.
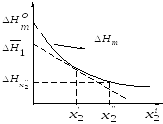
Зависимость интегральной теплоты растворения от концентрации раствора.
Теплота растворения моля вещества
(условно принятого вторым компонентом)
в бесконечно большом количестве раствора
некоторой постоянной концентрации
называется дифференциальной
или парциальной теплотой растворения
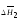 .
Этому определению соответствует
соотношение:
.
Этому определению соответствует
соотношение:
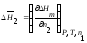 (1.5)
(1.5)
Аналогичная величина для растворителя
(первого компонента) – теплота растворения
моля растворителя в большом количестве
раствора постоянной концентрации
называют дифференциальной
или парциальной теплотой разбавления
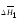 .
.
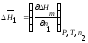 (1.6)
(1.6)
Интегральная теплота растворения может быть получена из дифференциальных (парциальных) теплот:
 (1.7)
(1.7)
Стандартная
энтальпия образования
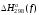
теплота, выделяемая (поглощаемая) при
образовании 1 моля вещества из простых
веществ, его составляющих, находящихся
в стандартных состояниях.
теплота, выделяемая (поглощаемая) при
образовании 1 моля вещества из простых
веществ, его составляющих, находящихся
в стандартных состояниях.
Стандартная
энтальпия сгорания
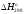 (сг)
теплота, поглощаемая (выделяемая) при
полном сгорании 1 моля вещества в
атмосфере кислорода при 1 атм (продуктами
реакции сгорания обычно являются СО2,
Н2О(ж), N2 и
др.).
(сг)
теплота, поглощаемая (выделяемая) при
полном сгорании 1 моля вещества в
атмосфере кислорода при 1 атм (продуктами
реакции сгорания обычно являются СО2,
Н2О(ж), N2 и
др.).
Стандартная
энтальпия реакции
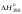 (р)
теплота, поглощаемая (выделяемая) в
стандартных условиях при взаимодействии
определенного числа молей реагентов,
задаваемого уравнением реакции.
(р)
теплота, поглощаемая (выделяемая) в
стандартных условиях при взаимодействии
определенного числа молей реагентов,
задаваемого уравнением реакции.
1.2 Аппаратура.
В нашей работе мы будем использовать калориметр с изотермической оболочкой, позволяющий точно учитывать поправку на теплообмен, так называемый калориметр Нернста. Калориметр состоит из двух основных частей: калориметрической системы и оболочки. Калориметрической системой называется совокупность тех частей калориметра, между которыми должна распределяться вся теплота, подлежащая измерению. В описываемом ниже калориметре калориметрическая система включает: калориметрическую жидкость (например, воду, раствор кислоты или соли); калориметрический стакан, мешалку, термометр и другие приборы, помещенные в калориметрическую жидкость.
Калориметрический стакан (1) помещен в термоизоляционный корпус (2), представляющий адиабатическую оболочку. Для уменьшения потерь теплоты термоизоляционный корпус (2) закрывают крышкой из теплоизолирующего материала (3), в которую через отверстия вставлены мешалка (4), термометр сопротивления (5), пробирка с исследуемым веществом и нагреватель (6). Мешалка необходима для быстрого приведения всех частей калориметра в тепловое равновесие.

Калориметрическая установка
Определение постоянной калориметра.
Постоянную калориметра можно оценить как сумму теплоемкостей составных частей, участвующих в теплообмене:
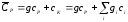 (1.9)
(1.9)
Здесь g масса
калориметрической жидкости (вода плюс
соль) после проведения калориметрического
опыта;
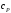 удельная теплоемкость
калориметрической жидкости (воды);
удельная теплоемкость
калориметрической жидкости (воды);
 тепловая постоянная
калориметра;
тепловая постоянная
калориметра;
 и
и
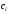 массы
и удельные теплоемкости материала
калориметрического стакана и всех
приборов, погруженных в жидкость.
массы
и удельные теплоемкости материала
калориметрического стакана и всех
приборов, погруженных в жидкость.
По первому способу тепловую постоянную калориметра определяют по известному значению энтальпии KCl растворения хлорида калия KCl.
Второй способ определения тепловой
постоянной калориметра заключается в
том, что в калориметрическую систему
вводят точно известное количество
теплоты путем пропускания электрического
тока через нагреватель (6) (см. рис.1.2). В
цепь нагревателя включен источник
питания, амперметр для измерения силы
тока I, параллельно включен вольтметр
для измерения напряжения U на зажимах
нагревателя. Постоянную калориметра
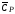 рассчитывают из соотношения:
рассчитывают из соотношения:
 , (1.11)
, (1.11)
где I сила тока,
A; U напряжение,
В;
время, секунды,
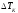 изменение температуры.
изменение температуры.
Приборы и реактивы
-
Калориметрическая система (модули «Термостат» и «Универсальный контроллер» учебно-лабораторного комплекса «Химия»),
-
KCl g3 1,5 г.,
-
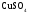 безводный g2
1 г.,
безводный g2
1 г., -
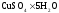 g1
2 г.
g1
2 г. -
H2O 80 г.
Ход работы:
-
Стакан, в который налито 80 мл раствора воды и помещена мешалка, устанавливаю в калориметр и закрываю крышкой с укреплённым в ней датчиком температуры. В отверстие крышки вставляю шприц, в который предварительно насыпано 1,5 г измельчённой соли KCl.
-
Включить контроллер и запустить программу управления – elsms2.exe.
-
В программе проверяю, включена ли мешалка. Устанавливаю интервал измерений -12. Скорость мешалки устанавливаю среднюю – 3. После чего начинаю измерения.
-
Предварительный период опыта сводится к выходу калориметрической системы на стационарный режим. После 20 измерения равномерного хода температуры засыпаю взвешенную соль KCl в калориметр.
-
Главный период. Растворение соли сопровождается скачкообразным изменением температуры: он резко уменьшается.
-
Заключительный период. После полного растворения соли дожидаюсь установления плавного и равномерного хода температуры в течение примерно 50 измерений, и останавливаю измерение.
-
Для проведения дальнейших измерений необходимо взвешиваю в шприце около 1 г
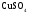 безводного
Укрепляю пробирку с
безводного
Укрепляю пробирку с
 в крышке калориметра.
в крышке калориметра. -
Снова провожу измерения, все параметры оставляю теми же, кроме интервала измерений – 15.
-
После снятия 20ого измерения засыпаю
 в калориметр. Наблюдаю увеличение
температуры, после чего начинается
устанавливаться температурное
равновесие. После снятия 70 измерений,
прекращаю их.
в калориметр. Наблюдаю увеличение
температуры, после чего начинается
устанавливаться температурное
равновесие. После снятия 70 измерений,
прекращаю их. -
Для проведения дальнейших измерений необходимо взвешиваю в шприце около 2 г
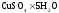 Укрепляю пробирку с
Укрепляю пробирку с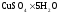 в крышке калориметра.
в крышке калориметра. -
Снова провожу измерения, все параметры оставляю теми же, кроме интервала измерений – 15.
-
После снятия 20ого измерения засыпаю
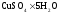 в калориметр. Наблюдаю увеличение
температуры, после чего начинается
устанавливаться температурное
равновесие. После снятия 70 измерений,
прекращаю их.
в калориметр. Наблюдаю увеличение
температуры, после чего начинается
устанавливаться температурное
равновесие. После снятия 70 измерений,
прекращаю их.
-
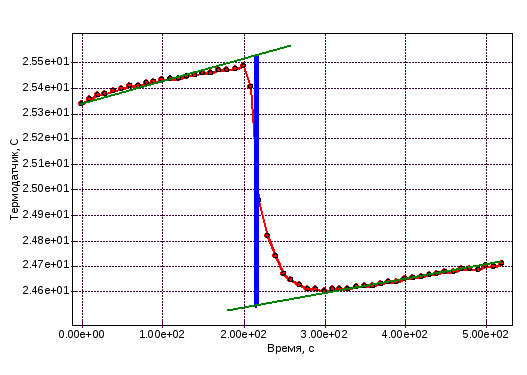
Обрабатываю получившиеся графики. Нажимаю кнопку «Прямая линия», подвожу курсор к соответствующей точке графика и устанавливаю начальную точку прямой, затем провожу прямую по точкам. Фиксирую линию. Для измерения ΔT провожу вертикальную прямую. Записываю ΔT.
Графики и расчеты

Определение постоянной калориметра

 кДж/моль
кДж/моль
Определение теплоты растворения CuSO4
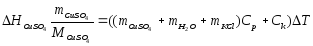
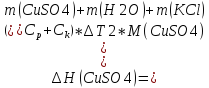
Определение теплоты растворения CuSO4*5H2O
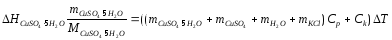
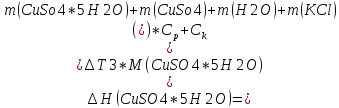
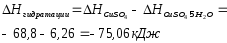
Расчет погрешности
Теплота гидратообразования табличное значение: CuSO4 ∆Н1= -78 кДж/моль.
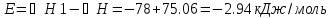
Вывод: в результате лабораторной работы мы получили значение теплоты растворения гидратообразования CuSO4 = -75.06кДж. Она отличается от табличного значения на 2.94кДж/моль. Это можно объяснить случайными погрешностями при проведении эксперимента, неточностью навески материалов и т.д.