
-
Приведите примеры интенсивных и экстенсивных свойств; свойств (функций) состояния и свойств (функционалов) процесса.
-
Покажите математические следствия, применимые к анализу изменений свойств состояния термодинамической системы. На примере 1 моля идеального газа покажите, что объем (температура) является свойством состояния, а теплота – нет.
-
Запишите аналитическое выражение для закона сохранения энергии на примере изолированной и открытой систем.
-
На примере простейшей системы (n молей идеального газа в цилиндре с поршнем) показать, что работа и теплота не являются свойствами состояния.
-
На примере простейшей системы определите работу и теплоту в различных процессах (изотермическом, изохорическом, изобарическом и адиабатическом).
-
Выведите уравнение адиабаты для одного моля идеального газа. Докажите, что при изотермическом и адиабатическом переходе идеального газа кривые изотерма и адиабата пересекаются лишь в одной точке.
-
Имеем два цилиндра с поршнем, снабженные манометром и термометром. Известно, что в одном из них находится одноатомный, а в другом – двух атомный газ. Как экспериментально установить атомарность газов?
-
При температуре 300 K идеальный газ изотермически и обратимо расширяется от 10-2 до 10-1 м3. Теплота этого процесса составляет 17,23 кДж. Поглощается или выделяется теплота газом? Сколько молей газа участвует в процессе?
-
Цикл Майера состоит из последовательности следующих переходов (процессов): изохорический нагрев, изотермическое расширение и изобарическое сжатие. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
-
Цикл Карно состоит из двух адиабатных и двух изотермических переходов. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
-
Цикл Стирлинга состоит из двух изотермических и двух изохорных переходов. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
-
Цикл Отто состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изохорический нагрев, адиабатическое расширение, изохорическое охлаждение. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
-
Цикл Джоуля состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изобарическое расширение, адиабатическое расширение, изобарическое сжатие. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
-
Цикл Дизеля состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изобарическое расширение, адиабатическое расширение, изохорическое охлаждение. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
-
Определите физический смысл калорических коэффициентов
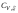 ,
,
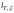 ,
,
 .
. -
Определите физический смысл калорических коэффициентов СР , hT, , hT,P .
-
Докажите, что калорический коэффициент
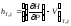
-
Докажите, что калорический коэффициент
-
Докажите, что калорические коэффициенты СР и
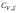 связаны соотношением
связаны соотношением
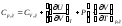
-
Покажите связь между термическими коэффициентами, где
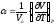 -коэффициент
термического расширения тела;
-коэффициент
термического расширения тела;
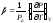 -
изохорный коэффициент изменения
давления;
-
изохорный коэффициент изменения
давления;
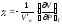 -
коэффициент изотермического сжатия.
-
коэффициент изотермического сжатия. -
Для 1 моля этанола (=0.79 г/см3 при 273 K и 1 атм) в интервале температур 273-323 К и давлений 1-1000 атм коэффициент термического расширения определяется соотношением
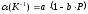 ,
а коэффициент сжатия равен
,
а коэффициент сжатия равен
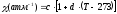 .
Найдите уравнение состояния этанола,
если известно, что a=1.11*10-3
K-1, b=1.3*10-4
атм-1, c=7.22*10-5
атм-1, и d=2*10-3
K-1.
.
Найдите уравнение состояния этанола,
если известно, что a=1.11*10-3
K-1, b=1.3*10-4
атм-1, c=7.22*10-5
атм-1, и d=2*10-3
K-1. -
С помощью уравнения состояния жидкого этанола, полученного в предыдущей задаче, определите, насколько следует повысить температуру 1 моля этанола от начального значения (273 K) при неизменном объеме, V0=V273, чтобы его давление увеличилось от 1 до 100 атм.
-
С помощью уравнения состояния жидкого этанола, полученного в задаче 21, определите изменение объема 1 моля этанола при его нагреве от 273 до 323 K при давлении 1 атм.
-
С помощью уравнения состояния жидкого этанола, полученного в задаче 21, определите изменение объема 1 моля этанола при его сжатии от 1 до 1000 атм при 273 K.
-
Для фреона коэффициент Джоуля –Томпсона KДТ=1,2 К/атм. Какой перепад давления между компрессором и холодильной камерой (куда поступает фреон) нужно достичь, чтобы температура жидкости понизилась на 18 градусов?
-
Дайте строгое термодинамическое обоснование правила Гесса. Могут ли тепловые эффекты одной и той же реакции, проведенной при постоянном давлении и при постоянном объеме отличаться. При утвердительном (или отрицательном) ответах привести конкретные примеры.
-
Сжигание 1 моля угарного газа в кислороде проводят при 298 K в условиях V=Const и P=Const. Рассчитайте разницу между тепловыми эффектами QV и QP. Изменится ли эта разница (если да, то насколько) при повышении температуры до 400 К.
-
Сжигание 1 моля метана в кислороде проводят при 298 в условиях V=Const и P=Const. Рассчитайте разницу между тепловыми эффектами QV и QP. Изменится ли эта разница (если да то насколько) при повышении температуры до 400 К.
-
Для некоторой реакционной системы температурные зависимости суммарных теплоемкостей исходных веществ и продуктов реакции показаны на рис.1. Представьте графически в координатах температурную зависимость теплового эффекта данной реакции.
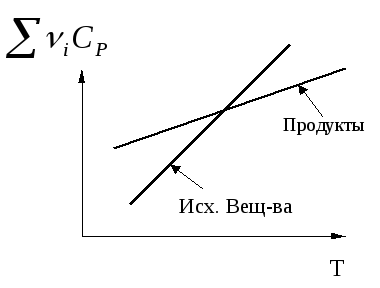
-
Для каких систем, в которых протекают химические реакции, повышение температуры приводит к увеличению теплового эффекта? Покажите в каких случаях тепловой эффект реакции не будет зависеть от температуры.
Коллоквиум 2.
Второй закон термодинамики.
Вопросы к коллоквиуму.
-
Вводные концепции и предпосылки принципа рассеивания энергии. Самопроизвольный и не самопроизвольный процесс. Формулировки второго начала термодинамики. Цикл Карно. Понятие энтропии по Р. Клаузиусу. Аналитическое выражение второго закона термодинамики. Приведенная теплота, некомпенсированная теплота. Изменение энтропии систем, в которых протекают необратимые процессы.
-
Объединенное выражение первого и второго начала термодинамики. Основные соотношения термодинамики в дифференциальном виде для
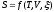 и
и
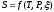 .
Связи энтропии с термическими и
калорическими коэффициентами.
.
Связи энтропии с термическими и
калорическими коэффициентами. -
Изменения энтропии в простейших процессах (примеры для системы содержащей n молей идеального газа): изохорический, изобарический, изотермический, адиабатический. Энтропия изотермического смешения двух газов.
-
Изменение энтропии индивидуальных веществ при нагревании. Энтропия фазовых переходов. Тепловая теорема Нернста. Постулат М. Планка. Абсолютное значение энтропии. Стандартная энтропия вещества. Вычисление абсолютных значений стандартной энтропии для веществ в различных агрегатных состояниях на основе экспериментальных данных. Изменение энтропии в химических реакциях. Зависимость изменения энтропии в химических реакциях от температуры.
-
Статистический характер энтропии. Макроскопические и микроскопические состояния системы. Термодинамическая вероятность. Связь энтропии и термодинамической вероятности по Л. Больцману.
Вопросы для самоконтроля.
