
Марганец
.pdf
Модуль V
Химия металлов
Лекция 2. Основные вопросы, рассматриваемые в лекции
Металлы VIIБ-подгруппы
Общая характеристика металлов VIIБ-подгруппы.
Химия марганца
 Природные соединения Mn
Природные соединения Mn
 Физические и химические свойства металла.
Физические и химические свойства металла.
 Соединения Mn. Окислительно-восстановительные свойства соеди-
Соединения Mn. Окислительно-восстановительные свойства соеди-
нений Мn.
Краткая характеристика Tc и Re.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Металлы VIIБ-подгруппы
Общая характеристика
периоды |
|
группы |
VIIБ -подгруппу образуют d-элементы: Mn, Tc, Re, Bh. |
||||||||
ряды |
|
|
|
|
|
|
|||||
VII |
Валентные электроны описываются общей формулой: |
||||||||||
|
|
||||||||||
|
|
Cl |
|
17 |
(n–1)d 5ns2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
III |
3 |
хлор |
|
|
|
|
(n–1)d |
|
|
ns |
|
|
|
35,453 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
|
25 |
Mn |
|
Простые вещества – металлы, серебристо-серые, |
||||||
|
4 |
марганец |
|
||||||||
|
|
|
|
|
|
|
|||||
IV |
|
54,938 |
|
тяжелые, с высокими температурами плавления, которые |
|||||||
|
|
|
|
||||||||
|
Br |
|
35 |
|
|
|
|
|
|
||
|
|
|
повышаются при переходе от Mn к Re, так что по туго- |
||||||||
|
5 |
бром |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
79,904 |
|
плавкости Re уступает только W. |
|||||||
|
|
43 |
|
Tc |
|
Наибольшее практическое значение имеет Mn. |
|||||
|
6 |
технеций |
|
Элементы Tc, Bh – радиоактивные элементы, искус- |
|||||||
|
|
98,906 |
|
|
|||||||
V |
|
|
|
|
|
|
|
|
|||
|
I |
|
53 |
ственно полученные в результате ядерного синтеза; Re – |
|||||||
|
|
|
|||||||||
|
7 |
йод |
|
|
редкий элемент. |
|
|
||||
|
|
126,905 |
|
|
|||||||
|
|
|
|
|
|
|
|
||||
|
|
75 |
|
Re |
|
Элементы Tc и Re более сходны между собой, чем |
|||||
|
|
|
|
|
|
|
|
|
|||
|
8 |
рений |
|
с марганцем. У Tc и Re более устойчива высшая сте- |
|||||||
VI |
|
186,207 |
пень окисления, поэтому у этих элементов распро- |
||||||||
|
At |
|
85 |
||||||||
|
|
|
|
|
|
|
|
|
|||
|
9 |
астат |
|
|
странены соединения в степени окисления 7. |
||||||
|
|
[210] |
|
|
|
Для Mn характерны степени окисления: 2, 3, 4, |
|||||
|
|
|
|
|
|
||||||
|
|
107 |
|
Bh |
6, 7. |
Более устойчивы – |
2 и 4. Эти степени окисления |
||||
VII |
10 |
борий |
|
||||||||
|
|
|
|
|
|
|
|||||
[262]проявляются в природных соединениях. Самые распро-
страненные минералы Mn: пиролюзит MnO2 и родохрозит MnCO3.
Соединения Mn(+7) и (+6) – сильные окислители.
Наибольшее сходство Mn, Tc, Re проявляют в высшей степени окис-
ления, оно выражается в кислотном характере высших оксидов и гидроксидов.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Высшие гидроксиды всех элементов VIIБ-подгруппы являются сильными
кислотами с общей формулой НЭО4.
В высшей степени окисления элементы Mn, Tc, Re проявляют сходство с элементом главной подгруппы хлором. Кислоты: HMnO4, HTcO4, HReO4 и
HClO4 являются сильными. Для элементов VIIБ-подгруппы характерно замет-
ное сходство со своими соседями по ряду, в частности, Mn проявляет сходство с Fe. В природе соединения Mn всегда соседствуют с соединениями Fe.
Марганец
Характерные степени окисления
|
|
Валентные электроны Mn – 3d54s2. |
|
25 |
Mn |
||
Наиболеее распространенными степенями |
|||
|
|
||
3d54s2 |
марганец |
окисления у Mn являются 2, 3, 4, 6, 7; |
|
54,938 |
|
более устойчивыми – 2 и 4 . В водных растворах |
|
|
|
||
|
|
степень окисления +2 устойчива в кислой, а +4 – в |
|
|
|
нейтральной, слабощелочной и слабокислой среде.
Соединения Mn(+7) и (+6) проявляют сильные окислительные свойства.
Кислотно–основной характер оксидов и гидроксидов Mn закономерно из-
меняется в зависимости от степени окисления: в степени окисления +2 оксид и гидроксид являются основными, а в высшей степени окисления – кислотными,
причем, HMnO4 – это сильная кислота.
В водных растворах Mn(+2) существует в виде аквакатионов
[Mn(H2O)6]2+, которые для простоты обозначают Mn2+. Марганец в высоких степенях окисления находится в растворе в форме тетраоксоанионов: MnO42– и
MnO4–.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Природные соединения и получение металла
Элемент Mn по распространенности в земной коре среди тяжелых метал-
лов следует за железом, но заметно уступает ему, – содержание Fe составляет около 5 %, а Mn – лишь около 0,1%. У марганца более распространены оксид-
ные и карбонатные и руды. Наибольшее значение имеют минералы: пиролю-
зит MnO2 и родохрозит MnCO3.
Рис. |
Пиролюзит |
Рис. Минерал родохро- |
|
MnO2 |
– основной ми- |
||
зит MnCO3 |
|||
нерал, используемый |
|||
|
|||
для получения Mn
Кроме этих минералов для получения Mn используют гаусманит Mn3O4
и гидратированный оксид псиломелан MnO2 . xH2O. В марганцевых рудах все-
гда содержатся минералы железа.
Марганец используют главным образом в производстве особых сортов сталей, обладающих высокой прочностью и стойкостью к удару. Поэтому ос-
новное количество Mn получают не в чистом виде, а в виде ферромарган-
ца – сплава марганца и железа, содержащего от 70 до 88% Mn.
Общий объем ежегодного мирового производства марганца, в том числе в виде ферромарганца, ~ (10 12) млн т/год.
Для получения ферромарганца оксидную марганцевую руду восстанавли-
вают углем.
MnO2 + 2C = Mn + 2CO
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Вместе с оксидами Mn восстанавливаются и оксиды Fe, содержащиеся в ру-
де. Для получения марганца с минимальным содержанием Fe и С, соединения
Fe предварительно отделяют и получают смешанный оксид Mn3O4
(MnO .Mn2O3). Его затем восстанавливают алюминием (пиролюзит реагирует с
Al слишком бурно).
3Mn3O4 + 8Al = 9Mn + 4Al2O3
Чистый марганец получают гидрометаллургическим способом. После предварительного получения соли MnSO4, через раствор сульфата Mn про-
пускают электрический ток, марганец восстанавливается на катоде:
Mn2+ + 2e– = Mn0.
Простое вещество
Марганец – светло-серый металл. Плотность – 7,4 г/см3. Температура плавления – 1245ОС.
|
о |
2+ |
|
Это довольно активный металл, Е (Mn |
/ Mn) = - 1,18 В. |
||
|
Он легко окисляется до катиона Mn2+ в разбавлен- |
||
|
ных кислотах. |
|
|
|
Mn + 2H+ = Mn2+ + H2 |
||
|
Марганец пассивируется в концентрирован- |
||
|
ных азотной и серной кислотах, но при нагревании |
||
Рис. Марганец – се- |
начинает с ними медленно взаимодействовать, но |
||
рый металл, похожий |
даже под действием таких сильных окислителей |
||
на железо |
|||
|
|
||
|
Mn переходит в катион |
||
Mn2+. При нагревании порошкообразный марганец взаимодействует с водой с
выделением Н2.
Из-за окисления на воздухе марганец покрывается бурыми пятнами,
но дальше не окисляется. |
В атмосфере кислорода марганец образует оксид |
|||||||||||||||||
Mn2O3, а при более высокой температуре смешанный оксид MnO .Mn2O3 |
||||||||||||||||||
(Mn3O4). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При нагревании марганец реагирует с галогенами и серой. Сродство Mn
к сере больше, чем у железа, поэтому при добавлении ферромарганца к стали,
растворенная в ней сера связывается в MnS. Сульфид MnS не растворяется в металле и уходит в шлак. Прочность стали после удаления серы, вызывающей хрупкость, повышается.
При очень высоких температурах (>1200 0С) марганец, взаимодействуя с азотом и углеродом, образует нестехиометрические нитриды и карбиды.
Соединения марганца
Соединения марганца (+7)
Все соединения Mn(+7) проявляют сильные окислительные свойства.
Перманганат калия KMnO4 – наиболее распространенное соеди-
нение Mn(+7). В чистом виде это кристаллическое вещество темно-
фиолетового цвета. При нагревании кристаллического перманганата он разла-
гается.
|
|
2KMnO4 = K2MnO4 + MnO2 + O2 |
|
|
По этой реакции в лаборатории можно получать |
|
|
O2. |
|
|
Анион MnO4– окрашивает растворы перман- |
|
|
ганата в малиново-фиолетовый цвет. На по- |
|
|
верхностях, контактирующих с раствором |
Рис. Раствор KMnO4 розо- |
KMnO4, из-за способности перманганата окис- |
|
|
||
во-фиолетого цвета |
|
лять воду, образуются тонкие желто–коричневые |
|
|
|
|
|
пленки оксида MnO2. |
|
4KMnO4 + 2H2O = 4MnO2 + 3O2 + 4KOH |
|
Чтобы замедлить эту реакцию, ускоряющуюся на свету, растворы KMnO4 хра-
нят в темных бутылках.
При добавлении к кристаллам перманганата нескольких капель концен-
трированной серной кислоты образуется ангидрид марганцовой кислоты.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

2KMnO4 + H2SO4 2Mn2O7 + K2 SO4 + H2O
Оксид Mn2O7 – это тяжелая маслообразная жидкость темно–зеленого цвета. Это единственный оксид металла, который при обычных условиях нахо-
дится в жидком состоянии (температура плавления 5,9 0С). Оксид имеет моле-
кулярную структуру, очень неустойчив, при 55 0С разлагается со взрывом. 2Mn2O7 = 4MnO2 + 3O2
Оксид Mn2O7 – очень сильный и энергичный окислитель. Многие ор-
ганические вещества окисляются под его воздействием до СО2 и Н2О. Оксид
Mn2O7 иногда называют химическими спичками. Если стеклянную палочку смочить в Mn2O7 и поднести к спиртовке, она загорится.
При растворении Mn2O7 в воде образуется марганцовая кислота.
Кислота HMnO4 – это сильная кислота, существует только в вод-
ном растворе, в свободном состоянии не выделена. Кислота HMnO4 разлагает-
ся с выделением O2 и MnO2.
При добавлении твердой щелочи к раствору KMnO4 происходит образо-
вание зеленого манганата.
4KMnO4 + 4KOH (к) = 4K2MnO4 + O2 + 2H2O.
При нагревании KMnO4с концентрированной соляной кислотой образу-
ется газ Cl2.
2KMnO4(к) + 16HCl (конц.) = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
В этих реакциях проявляются сильные окислительные свойства перманганата.
Продукты взаимодействия KMnO4 с восстановителями зависят от кислотности раствора, в котором протекает реакция.
В кислых растворах образуется бесцветный катион Mn2+.
MnO4– + 8H+ +5e– Mn2++ 4H2O; (E0= +1,53 В).
Из нейтральных растворов выпадает бурый осадок MnO2.
MnO4– +2H2O +3e– MnO2 + 4OH–.
В щелочных растворах образуется зеленый анион MnO42–.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

MnO4– + e– MnO42– ; (E0 = +0,56В). |
||
|
MnO |
– |
|
4 |
|
|
MnO4– + восстановитель |
|
Кислая среда |
Нейтральная |
Щелочная среда |
Mn2+ |
MnO2 |
MnO42– |
Перманганат калия в промышленности получают либо из марганца
(окисляя его на аноде в щелочном растворе), либо из пиролюзита (MnO2 пред-
варительно окисляют до K2MnO4, который затем на аноде окисляют до KMnO4).
Соединения марганца (+6)
Манганаты – соли с анионом MnO42– , имеют яркий зеленый цвет.
Анион MnO42─ устойчив только в сильнощелочной среде. Под действием воды и, особенно, кислоты манганаты диспропорционируют с образованием соеди-
нений Mn в степени окисления 4 и 7.
3MnO42– + 2H2O = MnO2 + 2MnO4– + 4OH–
По этой причине кислота Н2MnO4 не существует.
Манганаты можно получить, сплавляя MnO2 с щелочами или карбоната-
ми в присутствии окислителя.
2MnO2(к) + 4KOH (ж) + О2 = 2K2MnO4 + 2H2O
Манганаты являются сильными окислителями, но если на них подейство-
вать еще более сильным окислителем, то они переходят в перманганаты.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
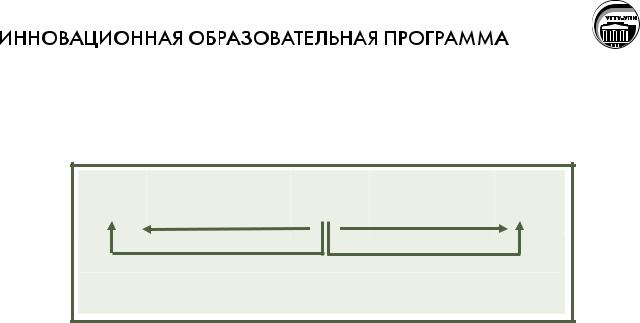
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
Окислительно–восстановительные свойства аниона MnO42– можно пере-
дать схемой:
восстановитель + |
2– |
+ окислитель |
– |
MnO2 |
MnO4 |
|
MnO4 |
Диспропорционирование
Соединения марганца (+4)
– наиболее устойчивое соединение Mn . Этот оксид встречается в природе (минерал пиролюзит).
Оксид MnO2 – черно-коричневое вещество с очень прочной кристалли-
ческой решеткой (такой же, как у рутила TiO2). По этой причине, несмотря на то, что оксид MnO2 является амфотерным, он не реагирует с растворами щелочей и с разбавленными кислотами (так же, как и TiO2). Он растворяется в концентрированных кислотах.
MnO2 + 4HCl (конц.) = MnCl2 + Cl2 + 2H2O
Реакцию используют в лаборатории для получения Cl2.
При растворении MnO2 в концентрированной серной и азотной кислоте образуются Mn2+ и О2.
Таким образом, в очень кислой среде MnO2 стремится перейти в
катион Mn2+.
С щелочами MnO2 реагирует только в расплавах с образованием смешан-
ных оксидов. В присутствии окислителя в щелочных расплавах образуются манганаты.
Оксид MnO2 используют в промышленности в качестве дешевого окислителя. В частности, окислительно-восстановительное взаимодействие
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

MnO2 с цинком, позволяет получать электрический ток в гальванических эле-
ментах (электрических батарейках).
Окислительные свойства диоксида лучше проявляются в кислой среде, в этом случае MnO2 восстанавливается до Mn2+.
E0 (Mn2+/MnO2) = +1,23 В.
При высокой температуре MnO2 разлагается с выделением О2 и образо-
ванием оксидов Mn2O3 и Mn3O4 (MnO . Mn2O3).
Гидроксид Mn(+4) не выделен, при восстановлении перманганата и ман-
ганата в нейтральных или слабощелочных средах, а также при окислении
Mn(OH)2 и MnOOH из растворов выпадает темно-бурый осадок гидратирован-
ного MnO2.
Оксид и гидроксид Mn(+3) имеют основной характер. Это твердые,
бурого цвета, нерастворимые в воде и неустойчивые вещества.
При взаимодействии с разбавленными кислотами они диспропорциони-
руют, образуя соединения Mn в степенях окисления 4 и 2. 2MnOOH + H2SO4 = MnSO4 + MnO2 + 2H2O
С концентрированными кислотами они взаимодействуют также как и
MnO2, т.е. в кислой среде переходят в катион Mn2+. В щелочной среде легко окисляются на воздухе до MnO2.
Соединения марганца (+2)
В водных растворах соединения Mn(+2) устойчивы в кислой среде.
Оксид и гидроксид Mn(+2) имеют основной характер, легко раство-
ряются в кислотах с образованием гидратированного катиона Mn2+.
Оксид MnO – серо-зеленое тугоплавкое кристаллическое соединение
(температура плавления – 18420С). Его можно получить при разложении кар-
боната в отсутствии кислорода.
MnCO3 = MnO + CO2.
В воде MnO не растворяется.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
