
5_Rastvory
.pdf
ЛЕКЦИЯ 5
РАСТВОРЫ
ПЛАН ЛЕКЦИИ
 Классификация дисперсных систем.
Классификация дисперсных систем.
 Основные понятия.
Основные понятия.
 Концентрация растворов.
Концентрация растворов.
 Энергетические эффекты при образовании растворов.
Энергетические эффекты при образовании растворов.
 Растворимость веществ.
Растворимость веществ.
 Закон распределения. Экстракция.
Закон распределения. Экстракция.
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
Смешение веществ в твердом, жидком или газообразном состоянии приводит к их химическому взаимодействию или к образованию смеси веществ. В отдельных случаях эти процессы налагаются (к примеру, в водном растворе углекислого газа наряду с молекулами воды и CO2 существует продукт их взаимодействия – угольная кислота).
Смесь веществ может быть гетерогенной или гомогенной. Гетерогенные смеси называют дисперсными системами. Все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой, и дискретной
(прерывистой) фазы, называемой дисперсной фазой.
В зависимости от размера частиц дисперсной фазы дисперсные системы можно разделить на две группы:
грубодисперсные системы – с размером частиц 100 нм (10-6 м) и
более (до 10-5 – 10-3 м);
коллоидные системы (коллоидные растворы) – с размером частиц
от 1 до 100 нм.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Дисперсные системы также классифицируют по агрегатным состояниям
дисперсной фазы и дисперсионной среды:
Агрегатное состояние |
Название дисперсной |
|
||
|
|
Пример |
||
|
|
|||
дисперсная |
дисперсионная |
системы |
||
|
||||
фаза |
среда |
|
|
|
|
|
|
|
|
газ |
жидкая |
пена |
мыльная пена |
|
газ |
твердая |
твердая пена |
пенопласт |
|
жидкая |
газ |
аэрозоль |
туман |
|
жидкая |
жидкая |
эмульсия |
майонез |
|
жидкая |
твердая |
твердая эмульсия |
твердое масло |
|
твердая |
газ |
аэрозоль |
дым, пыль |
|
твердая |
жидкая |
суспензия |
краски, лаки |
|
твердая |
твердая |
твердое включение |
сплавы, бетоны |
|
|
|
в твердом теле |
|
|
|
|
|
|
|
Аэрозоль – взвесь жидких и твердых частиц в газообразной среде. К
аэрозолям относятся туман, дым и пыль. Наиболее мелкие частицы (< 100 нм)
содержатся в дыме. Частицы твердых веществ в аэрозолях часто несут определенный заряд: Fe2O3, MgO и др. образуют отрицательно заряженную пыль, C, SiO2 и др. – положительно заряженную.
Эмульсия – взвесь одной или нескольких жидких фаз в среде другой по составу жидкой фазы. Все эмульсии со временем разрушаются, капли сливаются, и система расслаивается на несмешивающиеся жидкости.
Суспензия – взвесь частиц одного или нескольких твердых веществ в жидкой среде. Обычно твердые частицы велики (>1000 нм) и постепенно оседают под действием силы тяжести.
Коллоидные растворы (золи) – микрогетерогенные системы с жидкой средой, содержащей очень мелкие частицы, находящиеся в интенсивном
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

броуновском движении. Они равномерно распределены по объему и очень медленно осаждаются. Коллоидные растворы кажутся однородными и прозрачными.
ОСНОВНЫЕ ПОНЯТИЯ
Раствор – многокомпонентная гомогенная система переменного состава. Растворы иногда относят к одной из разновидностей дисперсных систем, в которых дисперсная фаза представлена молекулами и ионами, т.е.
размеры частиц от 0,1 до 1 нм.
Раствор содержит – растворитель и одно или несколько растворенных веществ. Обычно растворителем считают компонент, находящийся в том же агрегатном состоянии, что и образующийся раствор. Если компоненты,
образующие раствор, находятся в одном агрегатном состоянии, понятие растворитель становится весьма условным, растворителем в этом случае чаще считают количественно преобладающий компонент. Если вода является одним из веществ раствора, ее, как правило, считают растворителем.
По агрегатному состоянию растворы можно разделить на газообразные,
жидкие и твердые. Наибольшее практическое значение имеют жидкие растворы.
В свою очередь, в зависимости от агрегатного состояния растворенного вещества выделяют три группы жидких растворов:
растворенное вещество – газ (водные растворы СO2, HCl, NH3);
растворенное вещество – жидкость (водные растворы H2SO4, C2H5OH);
растворенное вещество – твердое (водные растворы солей,
щелочей).
Состояние раствора определяется тремя основными параметрами – температурой, давлением и концентрацией растворенного вещества.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

КОНЦЕНТРАЦИЯ РАСТВОРОВ
Концентрация – величина, определяющая количественный состав раствора. В химии основными являются следующие способы выражения концентрации растворов.
 Массовая доля вещества B ( B) – отношение массы растворенного вещества к массе раствора
Массовая доля вещества B ( B) – отношение массы растворенного вещества к массе раствора
ω |
mB |
; |
ω |
mB |
, |
|
|||||
|
|
||||
B |
mр |
B |
ρр Vр |
||
|
|
||||
где mB – масса растворенного вещества, г; mр – масса раствора, г;
р – плотность раствора, г/мл;
Vp – объем раствора, мл.
Массовая доля – величина безразмерная.
 Процентная концентрация – отношение массы растворенного вещества к массе раствора, выраженное в процентах
Процентная концентрация – отношение массы растворенного вещества к массе раствора, выраженное в процентах
CB |
mB |
100 ; |
CB |
mB |
100 . |
|
|||||
|
|
||||
|
mр |
|
ρр Vр |
||
Размерность процентной концентрации – %.
 Молярная доля вещества B – отношение количества вещества B к общему количеству веществ, образующих раствор
Молярная доля вещества B – отношение количества вещества B к общему количеству веществ, образующих раствор
B
В
i
i
где – количество вещества, моль;
i – число веществ в растворе.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Молярная доля – величина безразмерная.
 Молярная концентрация вещества B – отношение количества растворенного вещества к объему раствора, выраженному в литрах
Молярная концентрация вещества B – отношение количества растворенного вещества к объему раствора, выраженному в литрах
CM |
B |
, |
|
||
|
Vр |
|
где В – количество растворенного вещества, г;
Vp – объем раствора, л.
Молярную концентрацию в химической практике называют молярностью. Размерность молярной концентрации (молярности) – моль/л,
сокращенное обозначение М. Например, растворы, содержащие доли моля растворенного вещества в литре раствора, обозначают и называют соответственно:
0,1 М – децимолярный раствор,
0,01 М – сантимолярный раствор,
0,001 М – миллимолярный раствор,
растворы, содержащие 2, 3, … моль растворенного вещества в литре раствора, -
двумолярными (2М), трехмолярными (3М) и т.д.
С учетом того, что |
B |
mB |
, для молярной концентрации можно |
|
MB |
||||
|
|
|||
|
|
|
записать выражение:
CM |
mB |
, |
|
M BVр |
|||
|
|
где m B – масса растворенного вещества, г;
МВ – молярная масса растворенного вещества, г/моль;
Vp – объем раствора, л.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При растворении данного вещества (p, T = const) концентрация раствора увеличивается не беспредельно, а до достижения определенной концентрации раствора, которая не изменяется с течением времени. Это признак наступления фазового равновесия
растворяемое вещество  раствор,
раствор,
схемы которого при твердом (а), жидком (б) и газообразном (в) растворяемом веществе приведены на рисунке:
а б в
Черными точками обозначены частицы растворяемого вещества,
кружочками – частицы жидкого растворителя.
Раствор, находящийся в фазовом равновесии с растворяемым веществом, называют насыщенным, а концентрацию такого раствора – растворимостью вещества при данных температуре и давлении.
Фазовое равновесие растворяемое вещество-раствор является динамическим – непрерывно какая-то часть вещества переходит в раствор,
растворяется, и одновременно такое же количество этого вещества выделяется из раствора.
Ненасыщенными называют растворы, в которых содержание растворенного вещества меньше, чем в насыщенном растворе этого же
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

вещества при данных температуре и давлении. В таких растворах возможно дальнейшее растворение уже содержащихся в них веществ.
В определенных условиях могут образоваться пересыщенные растворы, в
которых содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества при данных температуре и давлении.
Пересыщенные растворы неустойчивы и при любом внешнем воздействии
(контакте с растворенным веществом, встряхивании) переходят в насыщенные растворы, выделяя избыток растворенного вещества.
Качественно растворы можно разделить на разбавленные и концентрированные, отличающиеся соотношением количества растворенного вещества и растворителя. К разбавленным относят растворы с низким содержанием растворенного вещества по сравнению с содержанием растворителя, к концентрированным – с высоким. Понятия разбавленные и концентрированные растворы условны.
Насыщенные растворы могут быть как концентрированными, так и разбавленными. Например, насыщенный раствор AgNO3 при 200С содержит
216 г растворенного вещества в 100 г воды, масса растворенного вещества и растворителя одного порядка, раствор концентрированный. Насыщенный раствор AgBr при этих же условиях содержит 1,2.10 5 г растворенного вещества в 100 г воды, масса растворенного вещества много меньше массы растворителя,
раствор разбавленный.
ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ПРИ ОБРАЗОВАНИИ РАСТВОРОВ
Образование ненасыщенных растворов – самопроизвольный процесс,
сопровождающийся уменьшением энергии Гиббса: G 0. Состояние раствора,
при котором G = 0, отвечает насыщению, вероятность растворения и выделения (кристаллизации) вещества из раствора одинакова. Для
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

пересыщенных растворов G > 0, возможно только выделение
(кристаллизация) избыточного количества вещества.
Растворение рассматривают как совокупность физико-химических процессов, среди которых можно выделить три основных, протекающих
одновременно:
 разрыв внутри- и межмолекулярных связей в растворяемом веществе (в
разрыв внутри- и межмолекулярных связей в растворяемом веществе (в
том числе, разрушение кристаллической решетки в твердых веществах);
 частичный или полный разрыв связей между молекулами растворителя;
частичный или полный разрыв связей между молекулами растворителя;
 образование связей между ионами (или молекулами) растворяемого вещества и молекулами растворителя. Этот процесс называют
образование связей между ионами (или молекулами) растворяемого вещества и молекулами растворителя. Этот процесс называют
сольватацией или гидратацией (если растворителем служит вода), а
образующиеся соединения – сольватами (гидратами).
Процесс сольватации сопровождается выделением энергии. Иногда
гидраты бывают настолько прочными, что при выделении растворенного вещества из раствора в его состав входит химически связанная вода. Такие соединения называют кристаллогидратами, а входящую в их состав воду – кристаллизационной. Примеры кристаллогидратов: CuSO4.5H20, Na2SO4.10H2O.
Суммарное значение энтальпии растворения (уравнение Фаянса):
H ( HК |
HP ) |
HC , |
где НK – энтальпия разрушения кристаллической решетки |
||
растворяемого вещества ( |
НK>0); |
|
HP – энтальпия разрыва межмолекулярных связей |
||
растворителя ( НP>0); |
|
|
НС – энтальпия сольватации ( |
НС<0). |
|
Растворение может быть эндотермическим |
и экзотермическим процессом. |
||||||||||||||||||||||
Если в воде растворяются газы или жидкости, |
то энергия, затрачиваемая на |
||||||||||||||||||||||
разрыв связей невелика, |
|
HK |
|
HP |
|
|
|
HC |
|
, и процесс растворения, |
как |
||||||||||||
|
|
|
|
|
|
||||||||||||||||||
Исполнитель: |
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
|
1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

правило, сопровождается выделением теплоты ( H<0). Если растворяются твердые вещества, разрушение кристаллической решетки требует значительной затраты энергии. Для большинства твердых веществ HK 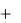 HP
HP 
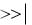 HC , и
HC , и
растворение происходит с поглощением теплоты ( H>0).
Пример: растворение нитрата аммония:
NH4NO3(к) = NH4NO3(раствор) , |
H0 = 25,8 кДж. |
|||
Растворение некоторых твердых веществ является экзотермическим |
||||
|
|
|
|
|
процессом ( H<0, так как |
HK HP |
|
HC |
). |
Пример: растворение гидроксида кальция: |
||||
Ca(OH)2(к) = Ca(OH)2(раствор) , |
H0 = -79,5 кДж. |
|||
Значение энтальпии растворения зависит от количества растворителя, для
большинства веществ с увеличением количества растворителя увеличивается абсолютная величина энтальпии растворения. В справочниках значения энтальпии растворения приводят с указанием количества вещества растворителя.
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА РАСТВОРИМОСТЬ ВЕЩЕСТВ
 Растворимость газов в жидкостях.
Растворимость газов в жидкостях.
Растворимость газа в жидкости зависит от природы газа, растворителя,
температуры, парциального давления газа над поверхностью раствора и ряда других факторов.
Растворение газов за редкими исключениями – экзотермический процесс.
Энтропия в процессе растворения газов в жидкостях уменьшается ( S<0).
Вследствие этого величина энергии Гиббса процесса растворения
G 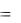 H T S увеличивается при нагревании, и растворимость газов, как правило, понижается с повышением температуры, что согласуется с принципом Ле Шателье. При нагревании равновесие
H T S увеличивается при нагревании, и растворимость газов, как правило, понижается с повышением температуры, что согласуется с принципом Ле Шателье. При нагревании равновесие
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

газ + жидкость (растворитель)  раствор, H<0,
раствор, H<0,
смещается влево, в сторону эндотермического процесса. Увеличение температуры вызывает повышение растворимости только тех газов,
растворение которых является эндотермическим процессом.
На растворимость газов существенно влияет давление.
Закон Генри: растворимость газа в жидкости при постоянной температуре пропорциональна его давлению в газовой фазе.
Закон Генри справедлив только для невысоких давлений (не более 0,1 МПа) и
для газов, химически не взаимодействующих с растворителем. К примеру, для водных растворов аммиака и углекислого газа закон Генри неприменим.
 Взаимная растворимость жидкостей.
Взаимная растворимость жидкостей.
При смешении жидкостей возможны три варианта растворимости:
неограниченная (H2O - C2H5OH), ограниченная (H2O - анилин), практически полная нерастворимость (H2O - ртуть).
Если жидкости растворяются друг в друге ограниченно, то происходит их расслаивание с образованием двух жидких фаз, причем фаза с большей плотностью составляет нижний слой, с меньшей плотностью – верхний. Так в системе вода-анилин верхний слой – раствор анилина в воде, нижний слой – раствор воды в анилине.
Растворение жидкостей в жидкостях чаще происходит с выделением теплоты ( H<0) и увеличением энтропии ( S>0). Величина G уменьшается при увеличении температуры, и нагревание в большинстве случаев приводит к повышению растворимости жидкостей. В системах с ограниченной взаимной растворимостью жидкостей существует такая температура, выше которой граница раздела двух жидких фаз (расслаивание) исчезает, система становится однофазной. Эту температуру называют верхней критической температурой растворения, к примеру, для системы вода-анилин ее значение равно 440 К
(1670С).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
