
- •1. Строение и свойства материалов
- •2. Основы теории сплавов. Диаграммы состояния
- •2.1. Физическая природа кристаллизации.
- •2.2. Строение фаз и структур в металлических сплавах
- •2.3. Диаграммы состояния сплавов
- •2.4. Зависимость свойств сплавов от их состава
- •3.1. Общая характеристика и классификация металлов и сплавов
- •3.2. Основные виды термической обработки стали
- •3.7.Сплавы на основе магния, алюминия
- •Химический состав и механические свойства магниевых сплавов
- •Состав и механическикие свойства сплавов системы AlAl2o3
- •3.8.Медь и ее сплавы
- •Состав и механические свойства латуней
- •Состав и гарантируемые свойства бронз
- •3.9.Сплавы на основе титана, никеля
- •Титановые сплавы
- •4. Неметаллические материалы
- •4.5.Композиционные материалы
2.3. Диаграммы состояния сплавов
Диаграмма состояния – это графическое изображение фазового состояния сплавов в зависимости от температуры нагрева и концентрации компонентов. По существу это наглядное изображение процесса кристаллизации и превращений в твердом состоянии в группе сплавов.
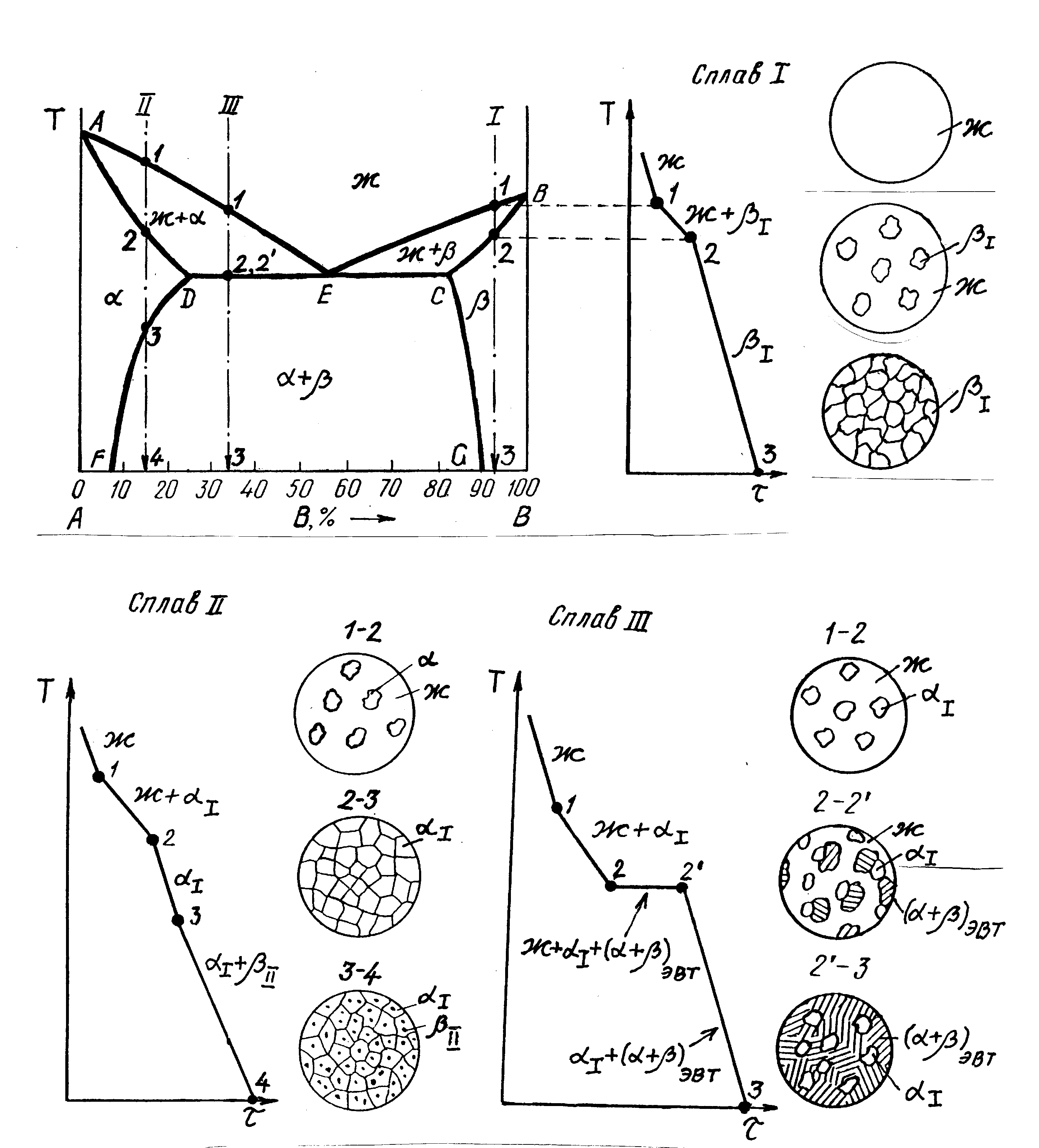
Рис. 2.3. Диаграмма состояния эвтектического типа (а), кривые охлаждения и последовательность затвердевания для однофазного сплава (б), сплава
с вторичной фазой (в), и сплава с эвтектикой (г)
Эту группу в металловедении называют система, например, «система Cu-Ni». На рис. 2.3 приведен пример двухкомпонентной системы с эвтектикой и ограниченной растворимостью компонентов.
При построении диаграммы состояния системы «А–В» по оси абсцисс изменяется содержание компонента В от 0 до 100 %, а по оси ординат – температура (рис. 2.3, а). В системе образуются твердые растворы и : – раствор компонента В в А, – раствор компонента А в В. Линии на диаграмме состояния соответствуют началу и концу фазовых превращений. Эти линии делят диаграмму на области, которые могут быть однофазными (ж, , ) или двухфазными (ж+, +). Линии АЕ и ЕВ – две ветви линии ликвидуса. Они соответствуют началу кристаллизации сплавов. Линии AD и CB – две ветви линии солидуса. Они соответствуют окончанию кристаллизации сплавов. Линия DEC – эвтектическая горизонталь, она соответствует области кристаллизации эвтектики в сплавах: ж.фаза (+)ЭВТ. Эвтектика – это особая структура. Она представляет собой смесь кристаллов твердых фаз, которые кристаллизуются совместно из расплава при постоянной температуре (эвтектика от греч. «легкоплавящийся»). Ниже солидуса и эвтектической горизонтали все сплавы системы находятся только в твердом состоянии.
Линии DF и CG – линии предельной растворимости. Кривая DF отражает изменение растворимости компонента В в ‑твердом растворе, кривая CG – растворимость компонента А в -твердом растворе. С повышением температуры растворимость компонентов друг в друге возрастает и достигает максимума при эвтектической температуре в точках D и C.
По диаграмме состояния можно анализировать процесс превращений в сплаве и указать какой вид будет иметь структура сплава после кристаллизации. Вертикаль на диаграмме соответствует концентрации компонентов рассматриваемого сплава. Анализ кристаллизации проводят по кривой охлаждения в координатах «температура–время». Перегибы на кривой охлаждения отмечают изменение фазового состава сплава. Чистые компоненты и эвтектики кристаллизуются при постоянной температуре, поэтому на кривой охлаждения образуется площадка. Точка Е разделяет сплавы на доэвтектическиеизаэвтектические, сплав концентрации в точке Е называютэвтектическим.
Сплав I после затвердевания состоит из однородного -твердого раствора (рис. 2.3, б). Сплав II непосредственно после затвердевания состоит из твердого раствора . Затем, при медленном охлаждении сплава до комнатной температуры, из-за уменьшения растворимости компонента В из -фазы выделяются частицы -фазы. Фазу I называют первичной фазой, фазу II – вторичной фазой. Вторичная фаза выделяется в виде дисперсных, т. е. очень мелких частиц и равномерно распределенных частиц (рис. 2.3, в). Структура сплава III состоит из первичных зерен -твердого раствора и эвтектики (+)ЭВТ (рис. 2.3, г). Эвтектический сплав IV состоит только из эвтектических колоний.
В большинстве промышленных сплавов, одна из фаз эвтектики является твердым раствором на базе металла, а вторая фаза – химическим соединением. По характеру микроструктуры на шлифе (на срезе), эвтектику называют пластинчатой, зернистой, игольчатой, т. к. фазы выглядят как отдельные структурные составляющие. Но специальные исследования позволили выяснить, что в пределах эвтектической колонии каждая из фаз является непрерывной: колония растет из одного центра и представляет собой сросток двух разветвленных кристаллов. Поэтому, по объемному строению эвтектики подразделяют только на два типа: матричные и каркасно-матричные.
Если химическое соединение не растворяет в своей кристаллической решетке исходные компоненты сплава, то его принято считать самостоятельным компонентом. Это явление можно рассмотреть на примере диаграммы «железо-углерод» (рис. 2.4, а). Концентрация углерода изменяется от 0 до 6,67 %, при этом, количество карбида железа Fe3C изменяется от 0 до 100%, следовательно, для изучения сплавов системы «Fe–C» целесообразно использовать диаграмму системы «Fe–Fe3C».
Превращения в твердом состоянии отражаются на диаграммах аналогично кристаллизации (рис. 2.4, а). Например, в системе «Fe–Fe3C» из расплава кристаллизуется высокотемпературная фаза (АС – ликвидус; АЕ – солидус; АСЕ – двухфазная область жидкость+). После затвердевания сплава -фаза некоторое время остается стабильной, но затем при охлаждении ниже линии GS образуется низкотемпературная фаза , а при охлаждении ниже линии SЕ – образуется карбид железа. Эти процессы идут до температуры 727 С. В сплаве, содержащем 0,8 % С – -фаза остается стабильной до 727 С. При 1147 С из расплава кристаллизуется эвтектика (Fe3C), ECF – эвтектическая горизонталь; эвтектика охлаждается до 727С без каких либо изменений. Затем, во всех сплавах системы «Fe-Fe3C» в твердом состоянии при 727 С из γ-фазы одновременно образуются две новые фазы (αFe3C), такую структуру называют эвтектоид. Процесс идет при постоянной температуре, его называют эвтектоидным превращением или распадом, PSK – эвтектоидная горизонталь (рис. 2.4, а). На рис. 2.4, б представлена последовательность образования эвтектоида (+Fe3C) из -фазы при 727 С.

а) б)
Рис. 2.4. Фазовая диаграмма Fe–C (а), схема эвтектоидного превращения при 727 С (б)
