
- •1. Скорость химической реакции
- •1.1. Кинетическая классификация реакций
- •1.2. Понятие о скорости химической реакции
- •1.3. Факторы, влияющие на скорость реакции
- •1.3.1. Зависимость скорости реакции от природы реагирующих веществ
- •1.3.2. Зависимость скорости реакции
- •1.3.3. Влияние температуры на скорость реакции
- •1.3.4. Уравнение Аррениуса
- •1.3.5. Влияние среды на скорость реакции
- •1.3.6. Другие факторы, влияющие на скорость химической реакции
- •1.4. Катализ
- •1.4.1. Особенности катализаторов
- •1.4.2. Механизм действия катализаторов согласно теории активации. Гомогенный и гетерогенный катализ
- •1.4.3. Ферментативный катализ
- •1.5. Цепные реакции
- •1.6. Фотохимические реакции
- •1.7. Последовательность расчета кинетических данных
- •1.8. Примеры решения задач
- •2. Химическое равновесие
- •2.1. Обратимые и необратимые реакции
- •2.2. Состояние химического равновесия
- •2.3. Способы выражения константы равновесия
- •2.4. Смещение химического равновесия
- •2.4.1. Влияние изменения концентрации на состояние равновесия
- •2.4.2. Влияние изменения температуры на состояние равновесия
- •2.4.3. Влияние изменения давления на состояние равновесия
- •2.5. Влияние температуры на константу равновесия
- •2.6. Состояние равновесия и катализаторы
- •2.7. Использование кинетических знаний в управлении химическим процессом
- •2.8. Примеры решения задач
- •3. Контрольные вопросы
- •4. Экспериментальная часть
- •Задачи и упраждения для самостоятельной работы
- •2. Влияние температуры и природы веществ на скорость реакции
- •4. Вычисление молярности растворов и равновесных концентраций
1.3. Факторы, влияющие на скорость реакции
Скорость реакции зависит от многих факторов. На неё влияют: природа и концентрация реагентов, температура, давление (в случае реакций с участием газов), катализаторы, степень измельчения веществ (в реакциях с участием твёрдых веществ), среда (если реакции протекают в растворах), форма реакционного сосуда (в цепных реакциях), интенсивность света (в фотохимических реакциях), мощность излучения (в радиационно-химических процессах).
Основными параметрами, которые следует учитывать при изучении кинетики конкретного процесса, являются температура, давление, концентрация вещества.
1.3.1. Зависимость скорости реакции от природы реагирующих веществ
Очевидно, что необходимым условием протекания реакции является столкновение молекул.
Число соударений молекул очень велико (порядка 1028 в секунду в 1 см3 при обычных условиях), поэтому если бы все столкновения приводили к химическому взаимодействию, то все реакции проходили бы со скоростью взрыва. Большая же часть реакций имеет наблюдаемую скорость. Причина в том, что к реакции могут приводить не все, а только так называемые эффективные столкновения, число которых составляет лишь малую долю от их общего числа. Столкновение может быть эффективным, если оно происходит между молекулами, обладающими некоторым избытком энергии по сравнению со средней энергией молекул системы (Еср) при данной температуре (рис.4).
Молекулы, обладающие такой избыточной энергией, называются активными, а сам избыток энергии энергией активации (Еа). Понятно, что, чем больше доля активных молекул, тем выше скорость реакции.
Энергия активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Очевидно поэтому, что она различна для разных реакций.
Если энергия активации очень мала (меньше 40 кДж/моль), то это означает, что значительная часть столкновений частиц реагирующих веществ приводит к химическим превращениям. Скорости таких реакций велики, они могут протекать практически мгновенно (например, ионные реакции в растворах).
Если энергия активации очень велика (больше 120 кДж/моль), то это означает, что лишь малая часть столкновений взаимодействующих частиц приво-
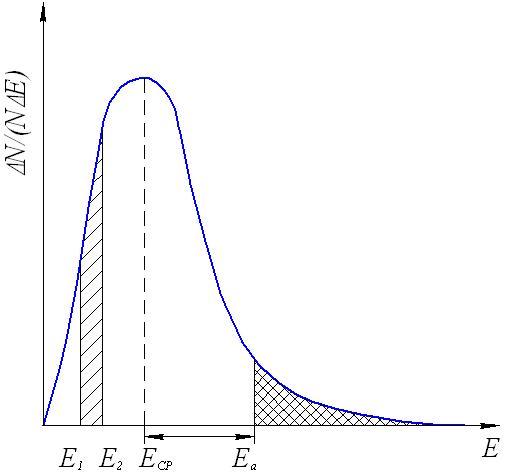
Рис.4. Распределение молекул по кинетической энергии:
Еср-средняя энергия молекул; Еа-энергия активации реакции;
N/(NЕ)- доля молекул с определенной энергией.
дит к химическим превращениям. Такие реакции идут очень медленно (например, процессы коррозии).
Если же значение энергии активации находится в пределах 40-120 кДж/моль, то такая реакция будет протекать не очень быстро и не очень медленно, в удобном для наблюдения и управления режиме; её скорость можно из-
мерить (например, взаимодействие цинка с водным раствором сульфата меди, тиосульфата натрия с серной кислотой и множество других).
Для того, чтобы произошла реакция, необходимо сначала преодолеть отталкивание электронных оболочек молекул, ослабить связи между атомами исходных веществ. На это надо затратить определенную энергию. При этом вещества переходят в неустойчивое промежуточное состояние. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации (рис.5). Измерение энергии активации показывает, что она всегда меньше энергии связей, т.е. для создания возможности протекания реакции нет необходимости полностью разрывать связи атомов в молекулах, их нужно только несколько ослабить. Это более энергетически выгодный процесс, поэтому образование активированного комплекса характерно для подавляющего большинства реакций.
Неустойчивый активированный комплекс существует очень короткое время. Он может распасться с образованием либо исходных веществ, либо продуктов реакции; при этом энергия выделяется. Очевидно, что переходное состояние возникает как в ходе прямой, так и в ходе обратной реакции.
Приведем энергетическую диаграмму условной реакции:
АВ + СД АС + ВД

Координата (ход) реакции
Рис.5. Изменение потенциальной энергии в ходе реакции.
На рисунке 5 уровень EK отвечает энергии системы в состоянии активированного комплекса и определяет тот наименьший энергетический запас, которым должны обладать молекулы, чтобы их столкновения могли приводить к химическому взаимодействию. Разность между уровнем энергии активированного комплекса EK и средним уровнем энергий исходных веществ Eисх. представляет собой энергию активации прямой реакции Еа1, а разность между уровнем ЕК и средним уровнем энергий продуктов реакции Епр – энергию активации обратной реакции Еа2.
Разность уровней энергии продуктов реакции и исходных веществ равна изменению энтальпии прямой реакции. Общий запас энергии продуктов реакции в приведенном примере больше, чем исходных веществ, поэтому ΔНпрям = Епр–Еисх > 0, т.е., прямая реакция эндотермическая, идёт с поглощением тепла. Обратная реакция, соответственно, экзотермическая, тепло в результате её протекания выделяется.
Избыточная энергия в молекуле может проявляться в разных формах:
1) повышенная кинетическая энергия поступательного и вращательного движения;
2) повышенная энергия взаимного колебания атомов или атомных групп, составляющих молекулу;
3) повышенная энергия движения электронов.
Неактивные молекулы можно перевести в активное состояние. Для этого неактивной молекуле необходимо сообщить достаточную дополнительную энергию в той или иной форме с тем, чтобы она стала реакционноспособной. Это – процесс активации. Важнейшие пути активации:
1) увеличение кинетической энергии молекулы (например, путем повышения температуры системы);
2) повышение внутримолекулярной энергии, в частности, возбуждение молекулы в результате поглощения квантов света, лучистой энергии соответствующей длины волны;
3) образование свободных атомов или радикалов в результате диссоциации при высоких температурах или ультрафиолетовом облучении. Эти частицы обладают очень высокой реакционной способностью (см. п.1.5 Цепные реакции);
4) образование ионов (при диссоциации, в результате воздействия радиации и т.д.). Ионное состояние можно рассматривать как состояние активированное. Именно этим объясняется обычно высокая скорость ионных реакций;
5) активация при адсорбции, которая заключается в ослаблении внутримолекулярных сил реагирующих веществ. Активация при адсорбции играет большую роль в гетерогенном катализе (см. п.1.4.2).
Причиной, определяющей влияние природы реагирующих веществ на скорость их химического взаимодействия является характер внутримолекулярных и межмолекулярных связей.
Скорости реакций между неполярными молекулами, как правило, невысоки. Это является результатом прочности внутримолекулярных связей и относительной слабости межмолекулярных сил. С другой стороны, полярные вещества, находясь в водных растворах и в среде других полярных растворителей в виде ионов, очень быстро взаимодействуют между собой. При значительных силах взаимодействия между молекулами реагирующих веществ скорость реакции возрастает. Полярность молекул является важным фактором именно в этом отношении.
В кинетике химических реакций важнейшую роль играет их внутренний механизм. Именно знание механизма реакции позволяет управлять процессом, проводить его в оптимальном режиме.
В процессе реакции нарушаются внутренние связи между атомами в молекулах исходных веществ и образуются новые межатомные связи в молекулах продуктов реакции. Способ этой перестройки у различных реакций не одинаков. Проявляющиеся здесь особенности оказывают большое влияние на скорость химического процесса.
Различают два следующих типичных случая перестройки химических связей:
а) перестройка химических связей в молекулах исходных веществ идет без разрыва связывающих электронных пар; новая связь в молекулах продуктов реакции обеспечивается за счет электронов, которые были уже спаренными в молекулах исходных веществ. Этот случай характерен для сильно полярных веществ, ковалентная связь в которых близка по характеру к ионной. В водных растворах такие соединения реагируют между собой быстро, подобно ионным веществам;
б) во многих случаях при химической перестройке молекул исходных веществ А и В происходит разрыв электронных пар связи, и новая электронная пара в молекулах продуктов реакции образуется за счет неспаренного электрона одного из атомов молекулы вещества А и неспаренного электрона одного из атомов молекулы вещества В. Такой тип перестройки часто встречается при химическом взаимодействии органических соединений. Реакция этого типа, в целом, протекает медленнее.
