
- •1. Скорость химической реакции
- •1.1. Кинетическая классификация реакций
- •1.2. Понятие о скорости химической реакции
- •1.3. Факторы, влияющие на скорость реакции
- •1.3.1. Зависимость скорости реакции от природы реагирующих веществ
- •1.3.2. Зависимость скорости реакции
- •1.3.3. Влияние температуры на скорость реакции
- •1.3.4. Уравнение Аррениуса
- •1.3.5. Влияние среды на скорость реакции
- •1.3.6. Другие факторы, влияющие на скорость химической реакции
- •1.4. Катализ
- •1.4.1. Особенности катализаторов
- •1.4.2. Механизм действия катализаторов согласно теории активации. Гомогенный и гетерогенный катализ
- •1.4.3. Ферментативный катализ
- •1.5. Цепные реакции
- •1.6. Фотохимические реакции
- •1.7. Последовательность расчета кинетических данных
- •1.8. Примеры решения задач
- •2. Химическое равновесие
- •2.1. Обратимые и необратимые реакции
- •2.2. Состояние химического равновесия
- •2.3. Способы выражения константы равновесия
- •2.4. Смещение химического равновесия
- •2.4.1. Влияние изменения концентрации на состояние равновесия
- •2.4.2. Влияние изменения температуры на состояние равновесия
- •2.4.3. Влияние изменения давления на состояние равновесия
- •2.5. Влияние температуры на константу равновесия
- •2.6. Состояние равновесия и катализаторы
- •2.7. Использование кинетических знаний в управлении химическим процессом
- •2.8. Примеры решения задач
- •3. Контрольные вопросы
- •4. Экспериментальная часть
- •Задачи и упраждения для самостоятельной работы
- •2. Влияние температуры и природы веществ на скорость реакции
- •4. Вычисление молярности растворов и равновесных концентраций
1.3.2. Зависимость скорости реакции
от концентраций реагирующих веществ
Концентрации реагирующих веществ является одним из важнейших факторов, влияющих на скорость химических реакций. Чем выше концентрация, т.е. чем больше частиц вещества находится в единице объема, тем больше вероятность соударений молекул реагирующих веществ и, следовательно, тем выше скорость реакции.
На основании обширного экспериментального материала норвежские ученые Гульдберг и Вааге в 1867г. сформулировали важное для химической кинетики положение, известное под названием закона действующих масс или основного постулата химической кинетики. Для одностадийных реакций и любой отдельной стадии многостадийных процессов этот закон формулируется следующим образом:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции аА + Вв +…+ сС закон действующих масс выражается соотношением
![]()
где СА и СВ – концентрации веществ А и В;
а и в – стехиометрические коэффициенты в уравнении реакции;
k – коэффициент пропорциональности, называемой константой
скорости химической реакции.
При
СА =
СВ =
1
![]() ,
то есть, константа k выражает собой
скорость данной химической реакции при
условии, если концентрации исходных
веществ равны единице (или их произведение
равно единице). Эту величину иногда
называют удельной скоростью химической
реакции. Чем выше k, тем быстрее протекает
данная реакция. Константа скорости
зависит от природы реагирующих веществ
и не зависит от их концентраций.
Температура и катализатор оказывают
большое влияние на величину k.
,
то есть, константа k выражает собой
скорость данной химической реакции при
условии, если концентрации исходных
веществ равны единице (или их произведение
равно единице). Эту величину иногда
называют удельной скоростью химической
реакции. Чем выше k, тем быстрее протекает
данная реакция. Константа скорости
зависит от природы реагирующих веществ
и не зависит от их концентраций.
Температура и катализатор оказывают
большое влияние на величину k.
В случае гетерогенных реакций в уравнения скорости входят только концентрации веществ, находящихся в газовой фазе или в растворе величины переменные. Концентрация твердого вещества величина постоянная и поэтому входит в константу скорости. Сравним:
а) 2NO(г) + O2(г) = 2NO2(г) гомогенная реакция v = k[NО]2[О2],
б) С(тв) + O2(г) 2СО2(г) гетерогенная реакция v = k[О2].
Порядок химической реакции по данному веществу (или частный порядок реакции) – это число, равное степени (например, в вышеприведенной реакции а и в), в которой концентрация этого вещества входит в кинетическое уравнение реакции, т.е. в выражение скорости реакции по закону действующих масс. Сумма показателей степеней (а + в +…), в которых концентрации всех исходных веществ входят в кинетическое уравнение закона действующих масс, определяет общий порядок реакции.
Для одностадийных реакций численные значения их порядка и молекулярности совпадают. Несовпадение экспериментально определенного порядка реакции с молекулярностью свидетельствует о её более сложном характере.
Почти все реакции представляют собой сложные многостадийные процессы, т.е. осуществляются в результате одновременного (или последовательного) протекания нескольких простых реакций; при этом продукты промежуточных стадий обычно быстро расходуются, и поэтому присутствуют в небольших количествах.
Для вычисления истинной скорости химического процесса необходимо знать численное значение константы скорости реакции, порядок реакции и экспериментально определить значения концентраций реагирующих веществ в тот момент времени, для которого вычисляется скорость.
Найдем количественные соотношения между скоростью реакции и концентрациями реагентов (или так называемое кинетическое уравнение) для простейших случаев – для необратимых реакций первого и второго порядков.
Реакции первого порядка. В реакциях первого порядка скорость пропорциональна концентрации одного реагирующего вещества. Примерами реакций первого порядка могут служить, например, разложение оксида азота (+5) уже при комнатной температуре:
N2O5 NO2 + NO + O2,
изомеризация бутана при температуре 1000С в присутствии хлорида алюминия:
CH3CH2CH2CH2CH3 CH3CH(CH3)CH3,
крекинг бутана при температуре примерно 6000С:
CH3CH2CH2CH3 CH3CH3 + CH2=CH2 и др.
В общем виде уравнение реакции первого порядка можно записать:
А продукты (1.6)
Выражение скорости, как функции концентрации, имеет вид:
![]() (1.7)
(1.7)
Пусть концентрация исходного вещества в начальный момент реакции, т.е. при τ = 0, равно «а» моль/л; в какой-то момент времени (τ) x моль/л вещества А превращаются в продукты. Следовательно, остается (а–x) моль/л вещества А (при условии, что объем реакционной системы остается постоянным).
Таблица 1
Изменение концентрации веществ во времени для реакции первого порядка
|
Время |
Концентрация реагирующего вещества, моль/л |
Концентрация продукта реакции, моль/л |
|
τ = 0 τ = τ |
СА =а СА =а–x
|
0 x |
Тогда уравнение скорости реакции первого порядка (1.7) будет иметь вид:
![]() (1.8)
(1.8)
Решение этого уравнения относительно константы скорости реакции (с переходом к десятичным логарифмам) дает следующее выражение:
![]() (1.9)
(1.9)
Из этого выражения видно, что размерность константы скорости реакции первого порядка есть «время –1».
Преобразуя уравнение (1.9), можно получить:
![]() (1.10)
(1.10)
Если построить график зависимости lg(a–x) от времени, то получим прямую, имеющую отрицательный наклон, равный –k/2,303, и отсекающую на оси ординат отрезок, равный lga (рис.6). То есть, если при экспериментальном исследовании реакции неизвестного порядка график lg(a–x) = f (τ) получается в виде прямой, это значит, что реакция имеет первый порядок.
Другая характеристика реакций первого порядка – время превращения исходного продукта наполовину (время полупревращения, τ1/2). Согласно уравнению (1.9)
 (1.11)
(1.11)
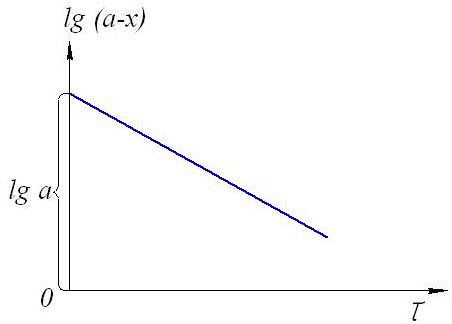
Рис.6. График зависимости lg(ax) от времени
для реакции первого порядка
На рисунке 7 видно, что время полупревращения постоянно и не зависит от начальной концентрации вещества. Например, если в момент времени имеется 1 моль реагента, то потребуется одинаковое время, чтобы его концентрация понизилась до ½ моль, от ½ до ¼ моль, от ¼ до ⅛ моль и т.д.
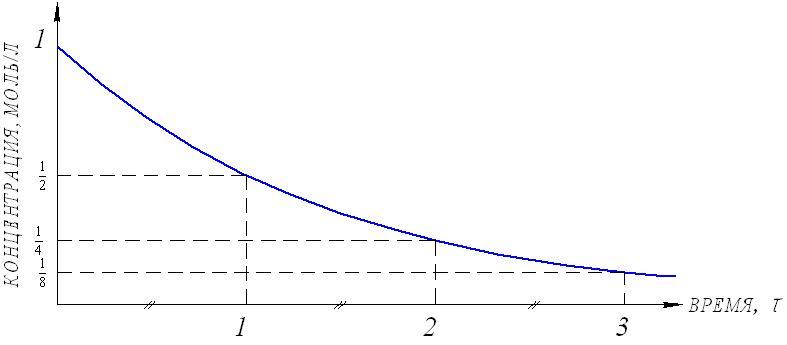
Рис.7. Изменение концентрации реагирующего вещества
как функция времени для реакции первого порядка
Реакции второго порядка.В общем виде уравнение реакции второго порядка можно записать следующим образом:
А + В продукты (1.12)
Выражение скорости имеет вид:
v = k·CA·CB (1.13)
Если концентрации реагентов в начальный момент времени соответственно равны «а» и «в», и если в какой-то момент времени τ x моль/л реагента А взаимодействуют с x моль/л реагента В, то останется (а–x) моль/л реагента А и (b–x) моль/л реагента В.
Скорость реакции пропорциональна концентрациям реагентов в каждый момент времени, и выражение
![]() (1.14)
(1.14)
превратится в выражение
![]()
При решении этого уравнения возможны два случая:
а) начальные концентрации «а» и «в» равны, тогда выражение скорости будет выглядеть следующим образом:
![]() (1.15)
(1.15)
Решение этого уравнения имеет вид:
![]() или
или
![]() (1.16)
(1.16)
Видно, что константа скорости реакции второго порядка имеет размерность «л моль1 с1»).
Уравнение (1.16) можно представить в виде:
![]() или
или
![]() (1.17)
(1.17)
Если
построить график зависимости от времени
величины
![]() ,
то получим прямую линию, отсекающую на
оси ординат отрезок, равный 1/а
и имеющую
положительный наклон, равный константе
k (рис.8):
,
то получим прямую линию, отсекающую на
оси ординат отрезок, равный 1/а
и имеющую
положительный наклон, равный константе
k (рис.8):

Рис.8. Величина 1/(ах) как функция
времени для реакции первого порядка
Время полупревращения для реакции второго порядка вычисляем из уравнения (1.16):
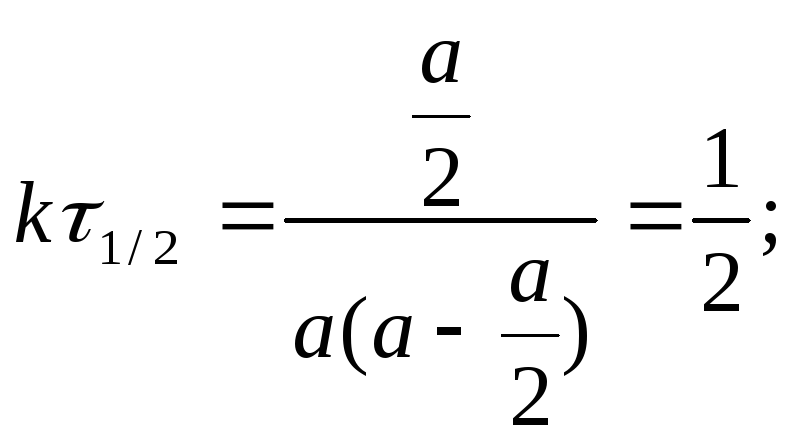
![]() (1.18)
(1.18)
Видно, что время полупревращения для реакции второго порядка обратно пропорционально начальной концентрации.
б) начальные концентрации «а» и «в» не равны между собой, тогда выражение скорости будет иметь вид:
![]()
и решение этого уравнения:
![]() (1.19)
(1.19)
График
зависимости
![]() от времени дает прямую, проходящую через
начало координат, наклон которой равен
от времени дает прямую, проходящую через
начало координат, наклон которой равен![]() (рис.9)
(рис.9)

Рис.9. Значение lg(b(ax)/a(bx)) как функция времени
для общего случая реакции второго порядка
Для обратимых, сложных реакций кинетические уравнения имеют более сложный вид и рассматриваются в курсе физической химии.
