
- •Введение
- •1. Растворы электролитов
- •1.1. Основные положения теории электролитической диссоциации с.Аррениуса
- •1.2. Механизмы образования растворов электролитов
- •1.3. Электропроводность растворов электролита
- •1.4. Электродный потенциал и его возникновение
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •2. Гальванический элемент
- •2.1. Общие понятия о работе гальванического элемента
- •2.2. Стандартный электродный потенциал
- •2.3. Ряд стандартных электродных потенциалов металлов
- •2.4. Поляризация и перенапряжение
- •2.5. Термодинамика обратимых электрохимических систем
- •2.6. Классификация электродов
- •2.7. Электрохимические цепи
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •3. Электролиз
- •3.1. Сущность электролиза
- •3.2. Электрохимическая система (ячейка)
- •3.3. Электролиз водных растворов
- •3.4. Поляризация электродов в процессе электролиза
- •3.5. Напряжение разложения. Явление перенапряжения
- •3.6. Электролиз органических соединений
- •3.7. Законы электролиза. Выход по току
- •3.8. Применение электролиза
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •4. Коррозия металлов
- •4.1. Классификации коррозионных процессов
- •4.2. Химическая коррозия
- •4.2.1. Взаимодействие с кислородом
- •4.2.2. Факторы, влияющие на скорость химической коррозии
- •4.2.3. Коррозия металлов в жидкостях – неэлектролитах
- •4.2.4. Сероводородная коррозия
- •Водородное охрупчивание металла
- •4.3. Электрохимическая коррозия (микрогальванокоррозия)
- •4.3.1. Условия протекания электрохимической коррозии
- •4.3.2. Диаграмма Пурбэ
- •4.3.3. Атмосферная коррозия металлов
- •4.3.4. Коррозия в морской воде
- •4.3.5. Подземная коррозия трубопроводов
- •4.4. Биохимическая коррозия
- •4.5. Коррозия блуждающими токами
- •4.6. Поляризация электродных процессов при коррозии
- •4.7. Защита металлов от коррозии
- •4.7.1. Легирование
- •4.7.2. Защитные покрытия
- •Методы борьбы с подземной коррозией
- •4.7.3. Металлические защитные покрытия
- •4.7.4. Электрохимическая защита
- •Методы борьбы с блуждающими токами
- •4.7.5. Ингибиторы коррозии металлов
- •4.7.6. Способы защиты от коррозии в морской воде
- •Контрольные вопросы
- •Примеры решения задач
- •Задачи для самостоятельной работы:
- •Тесты для самостоятельного решения
- •Перенапряжение катодного восстановления водорода и некоторых металлов из водных растворов при 25 0с
- •Значения фактора Пиллинга-Бэдвордса для некоторых металлов
1.1. Основные положения теории электролитической диссоциации с.Аррениуса
1. При растворении молекулы неорганических и некоторых органических соединений диссоциируют на ионы.
|
HCl
|
(1.4) |
|
NaOH
|
(1.5) |
|
K2SO4
|
(1.6) |
|
CH3COOH
|
(1.7) |
Ионы представляют собой заряженные частицы, которые состоят или из отдельных атомов, или из группы атомов. Предполагалось, что ионы в растворе ведут себя подобно молекулам идеального газа, т.е. не взаимодействуют друг с другом.
2. Диссоциация молекул на ионы не является полной, поэтому вводилась степень диссоциации .
0 < < 1.
Соответственно доля неразложившихся
частиц была 1 – .
Если ввести ν – стехиометрический
коэффициент, т.е. коэффициент, показывающий
количество частиц, на которое диссоциирует
данная молекула, то для реакции 1.4, 1.5,
1.7
![]() ,а для реакции 1.6
,а для реакции 1.6![]() .Тогда
можно записать:
.Тогда
можно записать:
|
|
(1.8) |
Последнее слагаемое показывает, во сколько раз увеличивается общая молярная концентрация частиц в растворе за счет диссоциации электролита, т.е. эквивалентно изотоническому коэффициенту:
|
|
(1.9) |
Поскольку
![]()
![]() i> 1. Таким образом,
удалось количественно рассчитать
величину изотонического коэффициента.
Коэффициентполучил
название кажущейся степени диссоциации.
i> 1. Таким образом,
удалось количественно рассчитать
величину изотонического коэффициента.
Коэффициентполучил
название кажущейся степени диссоциации.
3. К процессу электролитической диссоциации как к любой химической реакции применим закон действующих масс. Предположим, протекает химическая реакция
|
А + В = С. |
(1.10) |
В состоянии равновесия не может быть произвольных соотношений между концентрациями веществ А,ВиС, они определяются следующим выражением:
|
|
(1.11) |
где квадратные скобки означают концентрацию соответствующего компонента, а К– константа равновесия.
В общем случае для реакции
|
|
(1.12) |
константа будет равна
|
|
(1.13) |
Запишем реакцию диссоциации какого-либо вещества:
|
МА
|
(1.14) |
|
|
(1.15) |
Выразим концентрацию [МА] с учетом степени диссоциации: концентрацию недиссоциировавших частиц можно записать как
|
|
(1.16) |
тогда концентрация распавшихся будет
|
|
(1.17) |
Подставив (1.8) и (1.9) в (1.7), получим
|
|
(1.18) |
В частном случае для малодиссоциирующих
электролитов (![]() ),
получаем, что
),
получаем, что
|
|
(1.19) |
|
|
(1.20) |
Теория Аррениуса позволила легко трактовать любые явления, связанные с ионными равновесиями, и легла, таким образом, в основу качественного и количественного анализа. Между тем, у теории С. Аррениуса были свои недостатки. Первый недостаток был связан с тем, что данная теория игнорировала взаимодействие ионов с диполями воды или другого растворителя, т.е. ион-дипольное взаимодействие. А именно это взаимодействие, как показано далее, является физической основой образования ионов в растворе при растворении электролита. Таким образом, без учета ион – дипольного взаимодействия нельзя было объяснить процесс образования ионов и устойчивость систем. Второй недостаток теории Аррениуса был связан с игнорированием ион-ионного взаимодействия. Ионы рассматривались как частицы идеального газа, а следовательно, не учитывалось обусловленное кулоновскими силами притяжение катионов и анионов и отталкивание одноименно заряженных ионов.

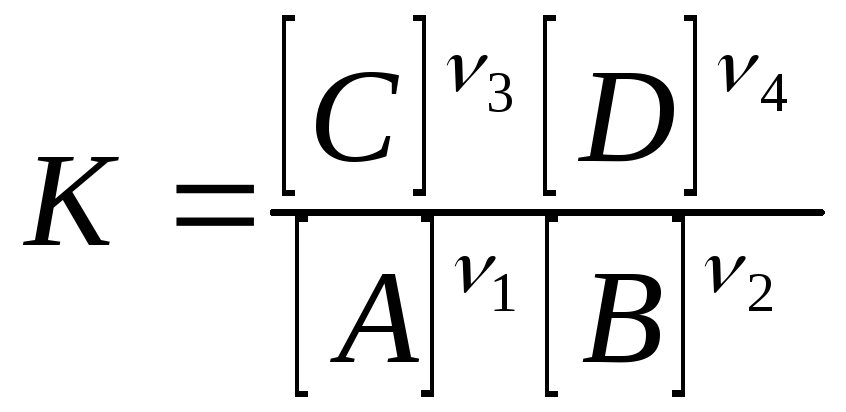 .
.