
- •Кафедра «Общая и аналитическая химия»
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •2.Простые вещества:
- •Календарный план
- •Рекомендуемая литература:
- •Дополнительная литература
- •Учебные пособия кафедры*
- •Балльно-рейтинговая система оценки успеваемости студентов потоков бтп и бтс по дисциплине «Общая и неорганическая химия» во 2 семестре
- •На тему: «Гальванический элемент. Электрохимическая коррозия»
- •На тему: «Электролиз водных растворов солей»
- •На тему: «Общие свойства металлов»
На тему: «Гальванический элемент. Электрохимическая коррозия»
Выполнил
студент группы__________ ______________ Фамилия И.О.
(Подпись, дата)
Принял
профессор (доцент) кафедры ОАХ ______________
(Подпись, дата)
Цель работы:
- изучить принципы работы гальванического элемента;
- научиться сравнивать химическую активность металлов;
- изучить основные закономерности протекания электрохимической коррозии металлов
Краткая теория.
Электрохимический процесс – это………..
Особенности электрохимического процесса:
Внешняя цепь состоит из ………………..проводника; внутренняя цепь …………………
Электрод - это ……………………..
Анод —………………….,на котором идет процесс………………….
Катод — ………………..,на котором идет процесс………………….
Гальванический элемент — это………..
В гальваническом элементе протекает …………………………….ОВР.
Анодом в гальваническом элементе является более…………………..металл с …………………………....значением ОВП
Катодом в гальваническом элементе является …………………..металл с …………………………....значением ОВП
ЭДС гальванического элемента рассчитывают по формуле:
Гальванический элемент работает, если……………
Гальванический элемент прекращает работу при условии:
Области применения гальванических элементов:
Коррозия металла – это его самопроизвольное разрушение под воздействием внешней среды.
Металл проявляет………………………свойства, окислителями в окружающей среде могут быть:
По механизму протекания коррозию подразделяют на:
химическую;
электрохимическую
электрокоррозию
Электрохимическая коррозия протекает с участием ………………………………в среде……………………..
Анодными называют участки металлической конструкции с …………………………значениями ОВП, на анодном участке протекает процесс ………………….
Катодными называют участки металлической конструкции с …………………………значениями ОВП, на катодном участке протекает процесс …………………. окислителя из среды
Между катодными и анодными участками металлической конструкции возникает разность потенциалов. В среде электролита также возникает разность потенциалов между прикатодным и прианодным пространством. Это приводит к направленному перемещению заряженных частиц: электронов по металлической конструкции и ионов в среде электролита, т.е. в системе возникает электрический ток. Система «работает» как коррозионный гальванический элемент.
Опыт 1. Гальванический элемент Даниэля-Якоби
Собрать гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинкового и медного - и вольтметра, встроенного во внешнюю цепь (рис.). Опустить цинковую пластинку в 1 М раствор соли сульфата цинка, медную пластинку в 1 М раствор соли сульфата меди (II). Отметить показания вольтметра. Соединить растворы электролитов – сульфата цинка и сульфата меди (II) - "солевым мостиком" ("электролитическим ключом"). Записать показания вольтметра.
- Выписать из таблицы значения стандартных окислительно-восстановительных потенциалов (ОВП) цинкового и медного электрода:
 …
…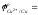 …;
…;
-более отрицательным значением окислительно-восстановительного потенциала характеризуется …………………….. электрод; более – положительным значением окислительно-восстановительного потенциала…………………………..электрод;
- при замыкании цепи «источником» электронов является………………………электрод;
- электроны во внешней цепи перемещаются от ………………………электрода к ………………….электроду;
- составить уравнение электродной реакции, протекающей на более отрицательно заряженном электроде:
(………………..реакция)
- ответить, какой процесс – окисления или восстановления – протекает на Zn – электроде;
- электрод, на котором протекает процесс окисления, называют ………………………
- составить уравнение электродной реакции, протекающей на более положительно заряженном электроде:
(………………..реакция)
- ответить, какой процесс – восстановления или окисления – протекает на Cu – электроде:
- электрод, на котором протекает процесс восстановления, называют …………………
- объяснить возникновение разности потенциалов между растворами электролитов (солей):
- в растворе сульфата цинка становится больше концентрация ионов…………………
- в растворе сульфата меди (II) становится больше концентрация ионов…………………
- ответить, в каком направлении перемещаются катионы и анионы по внутренней цепи:
- составить суммарное уравнение реакции, протекающей в гальваническом элементе, в ионной и молекулярной форме:
Zn + Cu2+ …;
Zn + CuSO4 …;
- краткая схема записи гальванического элемента Даниэля-Якоби:
- рассчитать ЭДС гальванического элемента Даниэля-Якоби в стандартных условиях:
ЭДС = φкат . – φан.; ЭДС =
- сравнить рассчитанное значение ЭДС с показанием вольтметра:
- назвать причины, по которым возможно уменьшение разности потенциалов между электродами по сравнению с рассчитанным значением ЭДС:
- объяснить, как изменяется ЭДС по мере работы гальванического элемента:
Опыт 2. Электрохимическая коррозия цинка в контактной паре с медью
В пробирку внести одну гранулу цинка, прилить ~3 мл дистиллированной воды и 5 капель 2 н серной кислоты, наблюдать в течение 2-3 минут. Коснуться медной проволокой гранулы цинка в пробирке.
- Отметить, как изменяется интенсивность выделения газа после касания гранулы цинка медной проволокой;
- газ выделяется на ……………………………металле
- сравнить значения стандартных окислительно-восстановительных потенциалов (таблица)
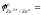
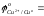 ;
;
- более активным восстановителем является металл……………………;
- при контакте цинка с медью направление перетока электронов…
- анодным участком является металл………………….., катодным участком – металл ……;
- составить уравнение анодной реакции
(1)
- ответить, образующиеся ионы цинка остаются на металле или переходят в среду электролита:
- ответить, может ли «принимать электроны» металлическая медь:
- основными окислителями в окружающей среде являются:
- на каком металле (участке) протекает процесс восстановления:
- составить уравнение катодной реакции с водородной деполяризацией:
H+ + … → H2 (pH≤7) (2)
- составить суммарное уравнение коррозии цинка водой, объединив уравнения анодной (1) и катодной (2) реакций с учетом коэффициентов электронного баланса:
Zn + 2H+ →
- рассчитать ЭДС реакции коррозии цинка водой в кислой среде, возможна ли она:
ЭДС =
- составить суммарное уравнение коррозии цинка кислородом в водной среде, объединив уравнения анодной (1) и катодной (3) реакций с учетом коэффициентов электронного баланса
Zn + O2 + H+ →
- ответить, в каком направлении перемещаются в среде электролита положительно и отрицательно заряженные ионы:
- составить краткую схему записи образующегося коррозионного гальванического элемента:
- составить рисунок и объяснить принцип «работы» коррозионного гальванического элемента
ө
Zn|O2,
H2O,
H2SO4|Cu
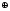 ;
;
- ответить, какие вторичные процессы коррозии могут протекать в данной системе:
- отметить, изменилась ли поверхность медной проволоки в результате процесса:
- сделать вывод, какой из металлов в контактной паре подвергается первичной коррозии:
Опыт 3. Коррозия оцинкованного и омедненного железа.
В две пробирки налить до половины дистиллированной воды и добавить 3 капли 2Н раствора серной кислоты и красной кровяной соли K3[Fe(CN)6] (индикатор – чувствительный реактив на ион Fe2+, который в его присутствии даёт интенсивное синее окрашивание). Приготовленные растворы перемешать. В одной из железных скрепок закрепить кусочек цинка, в другой – кусочек меди. Опустить каждую из контактных пар в отдельную приготовленную пробирку;
- отметить, в какой пробирке появляется и усиливается синяя окраска, свидетельствующая о накоплении ионов железа (II):
- сравнить, в какой пробирке происходит более интенсивное выделение газа, на каком металле:
- ответить, в какой пробирке происходит помутнение раствора:
а) Электрохимическая коррозия цинка в контактной паре с железом
- сравнить значения стандартных окислительно-восстановительных потенциалов (таблица)
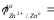
 …;
…;
- ответить, какой из металлов - Zn или Fe - является более активным восстановителем:
- какой из металлов является анодным и какой – катодным участком:
- составить уравнения анодной реакции:
(процесс……..……….); (1)
- составить суммарное уравнение коррозии цинка водой, объединив уравнения анодной (1) и катодной (2) реакций с учетом коэффициентов электронного баланса:
Zn + H2O → …;
- составить уравнение катодной реакции с кислородной деполяризацией:
O2 + H2O → (pH≥7, процесс………..….…);
- составить суммарное уравнение коррозии цинка кислородом в водной среде, объединив уравнение анодной (1) и катодной (3) реакций с учетом коэффициентов электронного баланса:
Zn + O2 + H2O →
- составить рисунок и объяснить механизм электрохимической коррозии цинка в контактной паре с железом:
- ответить, какие вторичные процессы коррозии могут протекать в данной системе:
- ответить, как «наводораживание железа» влияет на механические свойства железа:
б) Электрохимическая коррозия железа в контактной паре с медью
- Cравнить значения стандартных окислительно-восстановительных потенциалов (таблица):
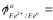
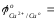
- ответить, какой из металлов - Fe или Cu - является более активным восстановителем:
- какой из металлов является анодным и какой – катодным участком:
- составить уравнение анодной реакции:
(процесс…………..…);
- составить уравнение катодной реакции с водородной деполяризацией:
H2O + … → H2 + … (pH≥7, процесс……….…);
- составить суммарное уравнение коррозии железа водой, объединив уравнения анодной (1) и катодной (2) реакции с учетом коэффициентов электронного баланса:
Fe + H2O →
- составить суммарное уравнение коррозии железа кислородом в водной среде, объединив уравнения анодной (1) и катодной (3) реакций с учетом коэффициентов электронного баланса:
Fe + O2 + H2O → ….;
- составить рисунок, объяснить механизм электрохимической коррозии железа в контактной паре с медью:
- составить краткую схему образующегося коррозионного гальванического элемента:
- составить уравнение окисления гидроксида железа (II):
Fe(OH)2 + O2 + H2O →
- ответить, какие соединения могут входить в состав ржавчины:
- ответить, какое из покрытий - Cu или Zn - называют анодным; какое – катодным;
- какое из покрытий – анодное или катодное – защищает железо от коррозии даже после разрушения покрытия:
Вывод:
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе №2
