
- •1.Предмет химии. Моль. Атомная единица массы Закон Авогадро. Закон химических эквивалентов. Эквиваленты кислот, оснований, солей, оксидов.
- •2. Классификация неорганических соединений.
- •3.Строение многоэлектронных атомов. Квантовые числа. Форма атомных орбиталей (ао). Принцип Паули. Правило Клечковского. Правило Хунда
- •4.Периодический закон д.И. Менделеева. Периодическая система элементов. Электроотрицательность. Закономерности изменения ее по периодам и группам элементов периодической системы.
- •5. Химическая связь. Ковалентная связь (кс). Свойства кс – направленность, насыщаемость и полярность.
- •6.Кс. Гибридизация атомных орбиталей. Водородная и донорно-акцепторная связь.
- •7. Энергетические эффекты химических реакций. Энтальпия. Закон Гесса. Следствия из закона Гесса. Расчет теплового эффекта химической реакции.
- •8. Энтропия. Энергия Гиббса. Термохимические расчеты.
- •9. Химическая кинетика и равновесие. Скорость химических реакций. Закон действия масс. Влияние температуры (закон Вант-Гоффа).
- •10. Химическое равновесие. Константа равновесия. Сдвиг равновесия. Принцип Ле-Шателье.
- •11. Растворы. Способы выражения концентрации растворов.
- •12. Свойства растворов неэлектролитов. Давление пара. Криоскопия и Эбуллиоскопия. Осмотическое давление..
- •13. Теория электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты.
- •14. Константа диссоциации. Закон разведения Оствальда Константа диссоциации.
- •15. Ионообменные реакции. Направление протекания реакции. Произведение растворимости.
- •16. Ионное произведение воды. Водородный показатель. Индикаторы.
- •17. Гидролиз солей. Степень и константа гидролиза
- •18.Характеристики кислот, оснований и солей с точки зрения теории электролитической диссоциации. Амфотерность гидроксидов.
- •19. Окислительно-восстановительные реакции (овр). Степень окисления атомов Основные окислители и восстановители. Составление уравнений овр методами электронного и электронно-ионного баланса.
- •20. Электрохимические процессы. Стандартный электродный потенциал. Ряд напряжений металлов. Гальванические элементы.
- •21. Электролиз расплавов и растворов солей.
- •22. Коррозия металлов. Электрохимическая коррозия. Протекторная и электрохимическая защита металлов от коррозии.
- •23. Дисперсные системы. Классификация по различным признакам. Поверхностные явления. Строительные материалы.
1.Предмет химии. Моль. Атомная единица массы Закон Авогадро. Закон химических эквивалентов. Эквиваленты кислот, оснований, солей, оксидов.
Химия-наука о вещ-вах, их строении, составе, св-вах, превращениях вещ-в. Неорганические вещ-ва делятся на: оксиды, гидрооксиды, соли, кислоты, основания.
Моль-кол-во вещ-ва, которое содержит столько же молекул этого вещ-ва, сколько атомов содержится в 12 г. углерода. 1 а.е.м. определяется как 1/12 часть атома углерода.
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях содержится одинаковое кол-во молекул. Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём. 1 моль любого газа при н.у. (р=105 Па, t=298 К ) занимают V=22,4 л/моль.
Эквивалентом элемента наз-ют такое его кол-во, которое соединяется с 1 молем атомов водорода или замещает то же кол-во атомов водорода в хим. реакции. Эквивалентом сложного вещ-ва наз-ся такое его кол-во, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещ-ва.
. Закон эквивалентов: вещ-ва взаимодействуют друг с другом в кол-ве, пропорциональных их эквивалентов; массы (объёмы) реагирующих друг с другом вещ-в пропорциональны их эквивалентным массам (объемам).
Эоксида
=Моксида/число
ат. эл-та валент.
эл-та.;
валент.
эл-та.;
Экисл=Мкисл/основность к-ты (кол-во Н).;
Эоснов=Моснов/кислотность осн.(кол-во ОН).;
Эсоли=Мсоли/кол-во ат. метала× вал. мет.
2. Классификация неорганических соединений.
простые вещества металлы и неметаллы
оксиды(несолеобразующие (CO, NO, N2O), солеобразующие(основные(оксиды щелочо-зем. мет), кислотные (Cl2O, B2O3, CO2, N2O5, SO3, Cl2O7), амфотерные (BeO, ZnO, Al2O3, Cr2O3, SnO2, PbO2, MnO2))- сложные вещества, молекулы которых состоят из атомов кислорода и какого-нибудь другого элемента. Получение: Взаимодействием простых веществ с кислородом:2 Mg + O2 = 2 MgO;
Разложением сложных веществ:Cu(OH)2 = CuO + H2O; CaCO3 = CaO + CO2; 2 Zn(NO3)2 = 2 ZnO + 4 NO2 + O2.
Гидроксиды((основания- электролиты, которые при диссоциации в качестве анионов образуют только гидроксид-ионы:NaOH = Na+ + OH), (кислоты- электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н+; Кислоты можно разделить на бескислородные (HCl, HBr, HCN, H2S) и кислородсодержащие (HNO3, H2SO4, H3PO4), амфотерные- это гидроксиды, которые проявляют как основные, так и кислотные свойства; Cr(OH)3, Zn(OH)2, Be(OH)2, Al(OH)3)- продукты соединения оксидов с водой
Соли – электролиты, при диссоциации которых образуются катионы металлов (или ионы аммония NH4+), анионы кислотных остатков. Соли делятся на средние(Na2CO3, K2SO4, Ca3(PO4)2), кислые(NaHCO3, Ca(H2PO4)2, KHSO3), основные((CuOH)2CO3, AlOH(NO3)2, FeOHCl).
3.Строение многоэлектронных атомов. Квантовые числа. Форма атомных орбиталей (ао). Принцип Паули. Правило Клечковского. Правило Хунда
В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Энергетическое состояние электронов зависит не только от квантового числа n, но и от орбитального квантового числа L. Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным электроном и ядром.
Принцип
Паули: в атоме не может быть 2-х
 ,
у которых все 4 квантовых числа были бы
одинаковыми. Хотя бы одно число должно
отличаться.
,
у которых все 4 квантовых числа были бы
одинаковыми. Хотя бы одно число должно
отличаться.
Правило
Клечевского: в атоме каждый
 распологается так, чтобы его энергия
была минимальной.
распологается так, чтобы его энергия
была минимальной.
Правило
Хунда: при данном значении L (то есть в
пределах определ. подуровня)
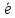 располагаются таким образом, чтобы
суммарный спин был максимален.
располагаются таким образом, чтобы
суммарный спин был максимален.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1.Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
2.Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
3.Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, в ключая 0. Например, при l = 1 числоm принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
4.Спиновое
квантовое число s может
принимать лишь два возможных значения
+1/2 и -1/2. Они
соответствуют двум возможным и
противоположным друг другу направлениям
собственного магнитного момента
электрона, называемого спином (от
англ. веретено).
Для обозначения электронов с различными
спинами используются символы: ![]() и
и ![]() .
.
s-ат орбитали d-ат орбиталь p-ат орбиталь
