
- •1.Классификация и номенклатура ферментов
- •4) Структура белковой молекулы
- •8)Биосинтез холерестерина и его биологическая роль.
- •9)Классификация витаминов.
- •10) .Роль желчных кислот, переваривание липидов
- •11) Характеристика гормонов поджелудочной железы
- •15) Характеристика витаминов(в2 и в5)
- •19)Ферменты биологического окисления
- •20)Взаимосвязь аминоуглеводов с обменом липидов
- •23) Факторы, влияющие на скорость ферментативных реакций
- •24.Синтез жиров из продуктов углеводного обмена
- •35)Цикл Кребса
- •45) Взаимосвязь обмена углеводов,липидов и белков
24.Синтез жиров из продуктов углеводного обмена
Углеводный обмен или метаболизм углеводов в организмах животных и человека. Метаболизм углеводов в организме человека состоит из следующих процессов:
Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.
Синтез и распад гликогена в тканях (гликогенез и гликогенолиз), прежде всего в печени.
Гликолиз — распад глюкозы. Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозодифосфата и пирувата как в отсутствии, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
Аэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл).
Взаимопревращение гексоз
Аэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза — пирувата.
Глюконеогенез — образование углеводов из неуглеводных продуктов (пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).
26)основные свойства ферментов. К ферментамприменимы три основных критерия, характерных и для неорганическихкатализаторов. В частности, они остаются неизмененными послереакции, т.е. освобождаясь, могут вновь реагировать с новымимолекуламисубстрата(хотя нельзя исключить побочных влияний условий среды наактивность фермента).Ферментыспособны оказывать действие в ничтожно малыхконцентрациях(например, однамолекулаферментареннина, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекулказеиногенамолоказа 10 мин притемпературе37°С). Наличие либо отсутствиеферментаили любого другогокатализаторане оказывает влияния на величинуконстанты равновесияи свободной энергии (ΔG).Катализаторылишь повышают скорость, с которой система приближается ктермодинамическому равновесию, не сдвигая точкиравновесия.Химические реакциис высокойконстантой равновесияи отрицательной величиной ΔG принято называть экзергоническими.Реакциис низкойконстантой равновесияи соответственно положительной величиной ΔG (они обычно не протекают спонтанно) называются эндерго-ническими. Для начала и завершения этихреакцийнеобходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническимиреакциями, обеспечивая последние необходимым количеством энергии.

Рис. 4.16. Зависимость скорости катализируемой ферментомреакцииоттемпературы.
а - повышение скорости реакциикак функциятемпературы; б - снижениескорости реакциикак функцияденатурациибелка-фермента; стрелка указывает оптимумтемпературы.
Ферменты, являясьбелками, обладают рядом характерных для этого классаорганических соединений свойств, отличающихся от свойств неорганическихкатализаторов.
Термолабильность ферментов.Скорость химических реакцийзависит оттемпературы, поэтому катализируемыеферментамиреакциитакже чувствительны к изменениямтемпературы. Установлено, что скорость большинства биохимическихреакцийповышается в 2 раза при повышениитемпературына 10°С и, наоборот, снижается в 2 раза при понижениитемпературына 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковойприроды ферментатепловаяденатурацияпри повышениитемпературыбудет снижать эффективнуюконцентрациюферментас соответствующим снижениемскорости реакции. Так, притемпературе, не превышающей 45–50°С,скорость реакцииувеличивается согласно теориихимической кинетики. Притемпературевыше 50°С наскорость реакциибольшое влияние начинает оказывать тепловаяденатурациябелка-фермента, приводящая к полному прекращению ферментативного процесса (рис. 4.16).
Таким образом, термолабильность, или чувствительность к повышению температуры, является одним из характерных свойствферментов, резко отличающих их от неорганическихкатализаторов. В присутствии последнихскорость реакциивозрастает экспоненциально при повышениитемпературы(см. кривую «а» на рис. 4.16). Притемпературе100°С почти всеферментыутрачивают своюактивность(исключение составляет, очевидно, только одинферментмышечной ткани– миокиназа, которая выдерживает нагревание до 100°С). Оптимальной для действия большинстваферментовтеплокровных животных являетсятемпература40°С; в этих условияхскорость реакцииоказывается максимальной вследствие увеличения кинетической энергии реагирующихмолекул. При низкихтемпературах(0°С и ниже)ферменты, как правило, не разрушаются, хотяактивностьих падает почти до нуля. Во всех случаях имеет значение время воздействия соответствующейтемпературы. В настоящее время дляпепсина,трипсинаи ряда другихферментовдоказано существование прямой зависимости

Рис. 4.17. Зависимость скорости катализируемой ферментомреакцииот рН (стрелка указывает оптимум рН).
между скоростью инактивации ферментаи степеньюденатурации белка. Следует отметить, что на термолабильностьферментовопределенное влияние оказываетконцентрациясубстрата, рН среды и другие факторы.Зависимость активности ферментовот рН среды.Ферментыобычно наиболее активны в пределах узкой зоныконцентрацииводородныхионов, соответствующей для животныхтканейв основном выработанным в процессеэволюциифизиологическим значениям рН среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы имеется определенная точка, в которойферментпроявляет максимальнуюактивность; эту точку называют оптимумом рН среды для действия данногофермента(рис. 4.17). При определении зависимостиактивности ферментаотконцентрацииводородныхионовреакциюпроводят при разных значениях рН среды, обычно при оптимальнойтемпературеи наличии достаточно высоких (насыщающих)концентрацийсубстрата. В табл. 4.3 приводятся оптимальные значения рН среды для рядаферментов.
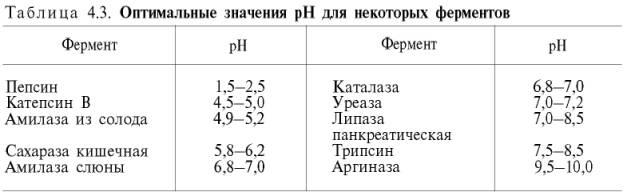
Из данных табл. 4.3 видно, что рН-оптимум действия ферментовлежит в пределах физиологических значений. Исключение составляютпепсин, рН-оптимум которого 2,0 (при рН 6,0 он не активен и не стабилен). Объясняется это, во-первых, структурной организациеймолекулыферментаи, во-вторых, тем, чтопепсинявляется компонентом желудочного сока, содержащего свободнуюсоляную кислоту, которая создает оптимальную кислую среду для действия этогофермента. С другой стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой среды нет вклеткахпечени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды.
Согласно современным представлениям, влияние изменений рН среды на молекулуферментазаключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикар-боновыхаминокислот, SH-группыцистеина, имидазольногоазотагисти-дина, NH2-группы лизинаи др.). При резких сдвигах от оптимума рН средыферментымогут подвергаться конформационным изменениям, приводящим к потереактивностивследствиеденатурацииили изменения зарядамолекулыфермента. При разных значениях рН средыактивный центрможет находиться в частично ионизированной или неионизированной форме, что сказывается натретичной структуре белкаи соответственно на формировании активного фермент-субстратного комплекса. Имеет значение, кроме того, состояние ионизациисубстратови кофакторов.
Специфичностьферментов.Ферментыобладают высокойспецифичностьюдействия. Это свойство часто существенно отличает их от неорганическихкатализаторов. Так, мелкоизмельченныеплатинаипалладиймогут катализироватьвосстановление(с участием молекулярноговодорода) десятков тысячхимических соединенийразличной структуры. Высокаяспецифичностьферментовобусловлена, как было отмечено, конфор-мационной и электростатическойкомплементарностьюмеждумолекуламисубстратаиферментаи уникальной структурной организациейактивного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либореакциииз тысячи другиххимических реакций, осуществляющихся одновременно в живыхклетках.
В зависимости от механизма действия различают ферментыс относительной (или групповой) и абсолютнойспецифичностью. Так, для действия некоторых гидролитическихферментовнаибольшее значение имееттип химической связивмолекулесубстрата. Например,пепсинв одинаковой степени расщепляетбелкиживотного и растительного происхождения, несмотря на то что этибелкисущественно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однакопепсинне расщепляет ниуглеводы, нижиры. Объясняется это тем, что точкой приложения, местом действияпепсинаявляется пептидная —СО—NH-связь. Для действиялипазы, катализирующейгидролизжировнаглицеринижирные кислоты, подобным местом является сложноэфирная связь. Аналогичной групповойспецифичностьюобладаюттрипсин,химотрипсин,пептидазы,ферменты, гидроли-зующие α-гликозидные связи (но не β-гликозидные связи, имеющиеся вцеллюлозе) вполисахаридах, и др. Обычно этиферментыучаствуют впроцессе пищеварения, и их групповаяспецифичность, вероятнее всего, имеет определенный биологический смысл. Относительнойспецифичностьюнаделены также некоторые внутриклеточныеферменты, напримергексокиназа, катализирующая в присутствииАТФфосфорилиро-вание почти всехгексоз, хотя одновременно вклеткахимеются и специфические для каждойгексозыферменты, выполняющие такое же фос-форилирование (см. главу 10).
Абсолютной специфичностьюдействия называют способностьферментакатализировать превращение только единственногосубстрата. Любые изменения (модификации) в структуресубстратаделают его недоступным для действияфермента. Примерами такихферментовмогут служить аргиназа, расщепляющая в естественных условиях (ворганизме)аргинин,уреаза, катализирующая распадмочевины, и др.
Имеются экспериментальные доказательства существования так называемой стереохимическойспецифичности, обусловленной существованием оптически изомерных L- и D-форм или геометрических (цис-и транс-)изомеровхимическихвеществ. Так, известны оксидазы L- и D-аминокислот, хотя в природныхбелкахобнаружены только L-ами-нокислоты. Каждый из видов оксидаз действует только на свой специфическийстереоизомер.
![]()
![]()
Наглядным примером стереохимической специфичностиявляется бактериальная аспартатдекарбоксилаза, катализирующая отщепление СО2 только от L-аспарагиновой кислотыс превращением ее в L-аланин. Сте-реоспецифичность проявляютферменты, катализирующие и синтетическиереакции. Так, изаммиакаи α-кетоглутарата во всех живыхорганизмахсинтезируется L-изомерглутаминовой кислоты, входящей в состав природныхбелков. Если какое-либо соединение существует в форме цис-и транс-изомеров с различным расположением группатомоввокругдвойной связи, то, как правило, только один из этихгеометрических изомеровможет служить в качествесубстратадля действияфермента. Например,фумаразакатализирует превращение только фумаровойкислоты(трансизомер), но не действует намалеиновую кислоту(цис-изомер):

Таким образом, благодаря высокой специфичностидействияферментыобеспечивают протекание с большой скоростью лишь определенныххимических реакцийиз огромного разнообразия возможных превращений в микропространствеклетоки целостноморганизме, регулируя тем самым интенсивностьобмена веществ.
29)биосинтез триглицеридов. Известно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов ифосфолипидов, так как свободные жирные кислоты присутствуют втканях и плазме крови в небольших количествах и в норме не накапливаются.
Синтез триглицеридов происходит из глицерина и жирных кислот(главным образом стеариновой, пальмитиновой и олеиновой). Путьбиосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения.
В почках, а также в стенке кишечника, где активность ферментаглицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:

В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гли-колитического распада глюкозы образуется дигидроксиацетонфосфат (см. главу 10). Последний в присутствии цитоплазматической глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:

Отмечено, что если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидаютжировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата.
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекуламиКоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):

Как отмечалось, ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3-фосфата) .
Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):

Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:

Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. На рис. 11.6 представлены глицерофосфатный, дигидроксиацетон-фосфатный и β-моноглицеридный (моноацилглицероловый) пути синтеза триглицеридов.

Рис. 11.6. Биосинтез триглицеридов (триацилглицеролов).
Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– вмитохондриях.
30)гормоны надпочечников. Щитовидная железа играет исключительно важную роль в обмене веществ. Об этом свидетельствуют резкое изменение основного обмена, наблюдаемое при нарушениях деятельности щитовидной железы, а также ряд косвенных данных, в частности обильное ее кровоснабжение несмотря на небольшую массу (20–30 г). Щитовидная железа состоит из множества особых полостей – фолликулов, заполненных вязким секретом – коллоидом. В составколлоида входит особый йодсодержащий гликопротеин с высокой мол. массой – порядка 650000 (5000 аминокислотных остатков). Этот глико-протеин получил название йодтиреоглобулина. Он представляет собой запасную форму тироксина и трийодтиронина – основных гормонов фолликулярной части щитовидной железы.
Помимо этих гормонов (биосинтез и функции которых будут рассмотрены ниже), в особых клетках – так называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы, обеспечивающий постоянную концентрацию кальция в крови. Он получил название «кальцитонин». Впервые на существование кальцито-нина, обладающего способностью поддерживать постоянный уровенькальция в крови, указал в 1962 г. Д. Копп, который ошибочно считал, что этот гормон синтезируется паращитовидными железами. В настоящее время кальцитонин не только выделен в чистом виде изткани щитовидной железы животных и человека, но и полностью раскрыта 32-членная аминокислотная последовательность, подтвержденная химическим синтезом. Ниже приведена первичная структура кальцитонина, полученного из щитовидной железы человека:

Кальцитонин человека содержит дисульфидный мостик (между 1-м и 7-м аминокислотными остатками) и характеризуется N-концевым цистеином и С-концевым пролинамидом. Кальцитонины быка, овцы, свиньи и лососевых рыб мало отличаются друг от друга как по структуре и концевым аминокислотам, так и по гипокальциемической активности. Биологическое действие кальцитонина прямо противоположно эффектупаратгормона: он вызывает подавление в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Таким образом, постоянство уровня кальция в крови человека и животных обеспечивается главным образом паратгормоном, кальцитриолом и кальцитонином, т.е. гормонамикак щитовидной и паращитовидных желез, так и гормоном – производным витамина D3. Это следует учитывать при хирургических лечебных манипуляциях на данных железах.
Химическая природа гормонов фолликулярной части щитовидной железы выяснена в деталях сравнительно давно. Считается установленным, что все йодсодержащие гормоны, отличающиеся друг от друга содержанием йода, являются производными L-тиронина, который синтезируется в организме изаминокислоты L-тирозина.

Из L-тиронина легко синтезируется гормон щитовидной железы тироксин, содержащий в 4 положениях кольцевой структуры йод. Следует отметить, что гормональной активностью наделены 3,5,3'-трийодтиронин и 3,3'-дийодтиронин, также открытые в щитовидной железе. Биосинтез гормонов щитовидной железы регулируется тиротропином – гормоном гипоталамуса (см. ранее).
В настоящее время еще полностью не изучены ферментные системы, катализирующие промежуточные стадии синтеза этих гормонов, и природа фермента, участвующего в превращении йодидов в свободный йод(2IДI2), необходимый для йодирования 115 остатков тирозина в молекуле тиреоглобулина. Последовательность реакций, связанных с синтезом гормонов щитовидной железы, была расшифрована при помощи радиоактивного йода [131I]. Было показано, что введенный меченый йод прежде всего обнаруживается в молекуле монойодтирозина, затем - дийодтирозина и только потом – тироксина. Эти данные позволяли предположить, что монойод- и дийодтирозины являются предшественниками тироксина. Однако известно также, что включение йода осуществляется не на уровне свободного тироксина, а на уровне полипептидной цепи тиреоглобулина в процессе его постсинтетической модификации в фолликулярных клетках. Дальнейшийгидролиз тиреоглобулина под действием протеиназ и пептидаз приводит к образованию как свободныхаминокислот, так и к освобождению йодтиронинов, в частности тироксина, последующее депонирование которого способствует образованию трийодтиронина. Эта точка зрения кажется более правдоподобной с учетом универсальности постсинтетической химической модификации при биосинтезе биологически активныхвеществ в организме.
Катаболизм гормонов щитовидной железы протекает по двум направлениям: распад гормонов с освобождением йода (в виде йодидов) и дезами-нирование (отщепление аминогруппы) боковой цепигормонов. Продукты обмена или неизмененные гормоны экскретируются почками или кишечником. Возможно, что некоторая часть неизмененного тироксина, поступая через печень и желчь в кишечник, вновь всасывается, пополняя резервы гормонов в организме.
Биологическое действие гормонов щитовидной железы распространяется на множество физиологических функций организма. В частности, гормоны регулируют скорость основного обмена, рост и дифференцировкутканей, обмен белков, углеводов и липидов, водно-электролитный обмен, деятельность ЦНС, пищеварительного тракта, гемопоэз, функцию сердечнососудистой системы, потребность в витаминах, сопротивляемость организма инфекциям и др. Точкой приложения действия тиреоидных гормонов, как и всехстероидов (см. далее), считается генетический аппарат. Специфические рецепторы – белки – обеспечивают транспорт тиреоидных гормонов в ядро и взаимодействие со структурными генами, в результате чего увеличивается синтез ферментов, регулирующих скорость окислительно-восстановительных процессов. Естественно поэтому, что недостаточная функция щитовидной железы (гипофункция) или, наоборот, повышенная секреция гормонов (гиперфункция) вызывает глубокие расстройства физиологического статусаорганизма.
Гипофункция щитовидной железы в раннем детском возрасте приводит к развитию болезни, известной в литературе как кретинизм. Помимо остановки роста, специфических изменений кожи, волос, мышц, резкого снижения скорости процессов обмена, при кретинизме отмечаются глубокие нарушения психики; специфическое гормональное лечение в этом случае не дает положительных результатов.
Недостаточная функция щитовидной железы в зрелом возрасте сопровождается развитием гипотиреоидного отека, или микседемы (от греч. myxa – слизь, oedemo – отек). Это заболевание чаще встречается у женщин и характеризуется нарушением водно-солевого, основного и жирового обмена. У больных отмечаются слизистый отек, патологическое ожирение, резкое снижение основного обмена, выпадение волос и зубов, общие мозговые нарушения и психические расстройства. Кожа становится сухой, температура тела снижается; в крови повышено содержание глюкозы. Гипотиреоидизм сравнительно легко поддается лечению препаратами щитовидной железы.
Следует отметить еще одно поражение щитовидной железы – эндемический зоб. Болезнь обычно развивается у лиц, проживающих в горных местностях, где содержание йода в воде и растениях недостаточно. Недостатокйода приводит к компенсаторному увеличению массы ткани щитовидной железы за счет преимущественного разрастания соединительной ткани, однако этот процесс не сопровождается увеличением секрециитиреоидных гормонов. Болезнь не приводит к серьезным нарушениям функций организма, хотя увеличенная в размерах щитовидная железа создает определенные неудобства. Лечение сводится к обогащению продуктов питания, в частности поваренной соли, неорганическим йодом.
Повышенная функция щитовидной железы (гиперфункция) вызывает развитие гипертиреоза, известного в литературе под названием «зоб диффузный токсический» (болезнь Грейвса, или базедова болезнь). Резкое повышение обмена веществ сопровождается усиленным распадом тканевых белков, что приводит к развитию отрицательного азотистого баланса. Наиболее характерным проявлением болезни считается триада симптомов: резкое увеличение числа сердечных сокращений (тахикардия), пучеглазие (экзофтальм) и зоб, т.е. увеличенная в размерах щитовидная железа; у больных отмечаются общее истощение организма, а также психические расстройства.
При гиперфункции щитовидной железы и, в частности, токсическом зобе показано оперативное удаление всей железы или введение 131I (β- и γ-излу-чение частично разрушает ткань железы) и антагонистов тироксина, тормозящих синтез тиреоидных гормонов. К подобным веществам относятся, например, тиомочевина, тиоурацил (или метилтиоурацил).

Снижают функцию щитовидной железы тиоцианат и вещества, содержащие аминобензольную группу, а также микродозы йода. Механизм действия антитиреоидных веществ окончательно не выяснен. Возможно, они оказывают ингибирующее действие на ферментные системы, участвующие в биосинтезе тиреоидныхгормонов.
