
Лысак Микробиология
.pdf
Как видно из таблицы щавелевоуксусная кислота представляет собой отправную точку для синтеза шести аминокислот, α- кетоглутаровая кислота является предшественником четырех, а пировиноградная – трех аминокислот.
Источником азота для аминокислот у разных групп бактерий являются нитраты, нитриты, молекулярный азот, аммиак. Но перевод неорганического азота в органические соединения происходит всегда через аммиак, и поэтому нитраты, нитриты, молекулярный азот предварительно восстанавливается до аммиака и только после этого включаются в состав органических соединений.
Биосинтез аминокислот происходит различными путями. Наибо-
лее простой способ – восстановительное аминирование кетокислот аммиаком. Например, α-кетоглутаровая кислота, взаимодействуя с аммиаком при участии фермента глутаматдегидрогеназы образует глутаминовую кислоту:
|
глутаматдегидрогеназа |
НООС (СН2)2 С |
СООН + NH3 + НАДФ . Н2 |
О |
|
HOOC (CH2)2 |
CH COOH + НАДФ+ + Н2О. |
|
NH2 |
При участии фермента аланиндегидрогеназы пировиноградная кислота взаимодействует с аммиаком с образованием аланина:
|
аланиндегидрогеназа |
CH3 CO |
COOH + NH3 + НАД . Н2 |
СН3 СН |
СООН + Н2О + НАД+. |
NH2
Некоторые аминокислоты образуются путем амидирования. Так, например, из глутаминовой кислоты с участием фермента глутаминсинтетазы образуется глутамин:
159

|
|
|
глутаминсинтетаза |
HOOC |
(CH2)2 |
CHNH2 |
COOH + АТФ + NH3 |
О |
|
|
|
С |
(СН2)2 |
CHNH2 |
COOH АДФ + Фн Н2О. |
NH2
Большинство же аминокислот получает свою аминогруппу от одной из первичных аминокислот в результате трансаминирования или переаминирования. Из свободных аминокислот в цитоплазме бактерий количественно преобладает глутаминовая кислота. Она служит донором аминогрупп при биосинтезе многих аминокислот. Так, например, глутаминовая кислота взаимодействует со щавелевоуксусной кислотой при участии фермента аминотрансферазы с образованием аспарагиновой кислоты. Отдав аминогруппу глутаминовая кислота превращается в α-кетоглутаровую кислоту, которая является стартовым веществом для синтеза глутаминовой кислоты:
HOOC (CH2)2 CHNH2 COOH + HOOC CH2 CO COOH
аминотрансфераза
HOOC CH2 CHNH2 COOH +
+ HOOC (CH2)2 CO COOH.
Пути биосинтеза некоторых аминокислот очень сложны. В качестве примера рассмотрим путь биосинтеза ароматических аминокислот (триптофана, фенилаланина, тирозина). Как мы отметили, стартовыми веществами для их синтеза являются эритрозо-4-фосфат и фосфоенолпируват. Молекулы этих веществ конденсируются с образованием С7-соединения, которое подвергается циклизации с образованием 5- дегидрохината. 5-дегидрохинат через ряд этапов превращается в хоризмовую кислоту. Хоризмовая кислота является общим промежуточным продуктом биосинтеза ароматических аминокислот. В этой точке биосинтетический путь разветвляется на два, один из которых ведет к триптофану через антраниловую кислоту, а другой дает префеновую кислоту, которая является предшественником как тирозина, так и фенилаланина (рис. 54).
160
фосфоенолпируват |
эритрозо-4 фосфат |
С7-соединение
Ф
5-дегидрохинат
 Ф
Ф
Ф
Ф
шикимат
 Ф
Ф
Ф
Ф
хоризмат
глутамин |
Ф |
Ф |
|
антранилат |
префенат |
||
|
Ф |
Ф |
Ф |
|
|
|
|
|
Ф |
Ф |
Ф |
|
Ф |
тирозин |
фенилаланин |
серин |
Ф |
|
|
триптофан
Рис. 54. Путь биосинтеза ароматических аминокислот у микроорганизмов.
Синтезируемые внутриклеточно или поступившие из среды аминокислоты полимеризуются в жизненноважные молекулы белков.
Некоторые гетеротрофные прокариоты, такие как, например, молочнокислые бактерии, не способны синтезировать все аминокислоты, поэтому их рост возможен только на сложных обогащенных питательных средах.
6.2.2. Биосинтез нуклеотидов
Нуклеотиды являются исходным материалом для биосинтеза нуклеиновых кислот. Кроме того, нуклеотиды входят в состав многих коферментов и участвуют в активации и переносе аминокислот, углеводов, компонентов клеточной стенки и липидов. Нуклеотиды по химической природе являются сложными соединениями и состоят из азотистых оснований (ими являются производные пурина – аденин, гуа-
161
нин и пиримидина – цитозин, тимин ), углеводов типа пентоз (рибоза и дезоксирибоза) и остатка фосфорной кислоты.
Большинство микроорганизмов способны синтезировать нуклеотиды из низкомолекулярных соединений. Если же нуклеотиды есть в питательной среде или они образуются при распаде нуклеиновых кислот, то клетка их не синтезирует, а использует в готовом виде.
Синтез пиримидиновых нуклеотидов. Предшественниками пи-
римидиновых оснований служат карбамоилфосфат и аспартат. Карбамоилфосфат синтезируется из аммиака и углекислоты:
NH3 + CO2 + 2АТФ  H2N CO O PO3H2 + АДФ + Фн.
H2N CO O PO3H2 + АДФ + Фн.
Фермент аспартат-транскарбамоилаза конденсирует эти соединения с образованием карбамоиласпартата. Карбамоиласпартат подвергается циклизации, в результате образуется 4,5-дигидрооротат. Затем в результате дегидрирования этого соединения происходит образование оротата – первого промежуточного продукта, содержащего пиримидиновое кольцо.
Карбамоилфосфат
|
аспартат-транскарбамоилаза |
+ |
карбамоиласпартат |
аспартат |
|
2Н
циклизация
4,5-дигидрооротат  оротат.
оротат.
Прежде чем превратиться в одно из пиримидиновых оснований оротат связывается с рибозо-5-фосфатом, который является исходным соединением для образования пентозного компонента нуклеотидов. Как известно, рибозо-5-фосфат может синтезироваться двумя путями:
-окислительным – из глюкозо-6-фосфата через окислительный пентозофосфатный путь;
-неокислительным – из фруктозо-6-фосфата и 3-фосфоглицерино- вого альдегида в результате реакций, катализируемых трансальдолазой и транскетолазой.
Для синтеза нуклеотидов рибозо-5-фосфат используется в высокоэнергетической форме – в виде фосфорибозилпирофосфата (ФРПФ).
162

Фосфорибозилпирофосфат взаимодействует с оротатом, в результате образуется оротидинмонофосфат, который декарбоксилируется в уридинмонофосфат или уридиловую кислоту:
СО2
Оротат
+ оротидинмонофосфат
оротидинмонофосфат  уридинмонофосфат
уридинмонофосфат
ФРПФ |
(уридиловая кислота). |
Из уридиловой кислоты путем аминирования образуется цитидиловая кислота (нуклеотид, содержащий азотистое основание цитозин), путем метилирования – тимидиловая кислота (нуклеотид, содержащий азотистое основание тимин).
Синтез пуриновых нуклеотидов. Начальной стадией синтеза пу-
риновых нуклеотидов является взаимодействие фосфорибозилпирофосфата (ФРПФ) с глутамином с образованием фосфорибозиламина, который через ряд последовательных ферментативных реакций превращается в инозиновую кислоту (пуриновый нуклеотид гипоксантин). Инозиновая кислота служит исходным продуктом для синтеза других нуклеотидов – адениловой и гуаниловой кислот.
ФРПФ +  фосфорибозиламин
фосфорибозиламин 
глутамин
адениловая кислота
 инозиновая кислота (гипоксантин)
инозиновая кислота (гипоксантин)
гуаниловая кислота.
Мы рассмотрели синтез рибонуклеотидов, так как в качестве пентозы использовалась рибоза или точнее рибозо-5-фосфат.
При синтезе дезоксирибонуклеотидов происходит восстановление рибозы до дезоксирибозы. Это происходит на стадии рибонуклеотидов, т.е. синтезируются рибонуклеотиды, а затем происходит восстановление их до дезоксирибонуклеотидов.
Синтезированные клеткой или усвоенные из среды нуклеотиды при участии РНК- и ДНК-полимераз полимеризуются в полинуклеотиды – молекулы РНК и ДНК.
163

6.2.3. Биосинтез липидов
Липиды в клетке бактерий представлены химическими соединениями различной природы. Это: триглицериды, жирные кислоты, фосфолипиды, гликолипиды, воска. К липидам бактерий относятся также соединения, молекула которых содержит изопреновые фрагменты:
СН2 С СН СН2
СН3
Из изопреновых фрагментов (путем их полимеризации) построены молекулы каротиноидов, хлорофиллов, хинонов. К липидам относятся и некоторые витамины и их производные.
Общими свойствами липидов является их нерастворимость в воде
ирастворимость в органических растворителях.
Упрокариот липиды входят в состав клеточных мембран и клеточной стенки, служат запасными веществами, являются компонентами пигментных систем и цепей электронного транспорта.
Наиболее универсальными липидными компонентами бактерий являются жирные кислоты и фосфолипиды. Рассмотрим как они синтезируются.
Синтез жирных кислот. Жирные кислоты бывают с четным и нечетным числом атомов углерода. Исходным субстратом для синтеза жирных кислот с четным числом углеродных атомов служит ацетилКоА.
На первом этапе происходит перенос ацетильной группы от аце- тил-КоА на молекулу особого белка, называемого ацилпереносящим белком (АПБ):
ацетил-КоА + АПБ  ацетил-АПБ + КоА.
ацетил-АПБ + КоА.
Ацетил-АПБ выполняет функцию затравки, к которой присоединяется С2-фрагмент. Донором С2-фрагмента служит молекула мало- нил-АПБ, синтезирующаяся также из ацетил-КоА. В результате присоединения С2-фрагмента к ацетил-АПБ образуется ацетоацетил-АПБ:
ацетил-АПБ + малонил-АПБ  ацетоацетил-АПБ + СО2 + АПБ.
ацетоацетил-АПБ + СО2 + АПБ.
164

Затем с помощью серии ферментативных реакций происходит восстановление окисленных углеродных атомов ацетоацетил-АПБ, приводящее к образованию бутирил-АПБ:
- 2Н - Н2О |
+ 2Н |
Ацетоацетил – АПБ |
бутирил-АПБ. |
Врезультате конденсации бутирил-АПБ с новой молекулой мало- нил-АПБ и последующего восстановления продукта реакции образу-
ется молекула С6-жирной кислоты (капроил-АПБ). Последовательное наращивание С2-остатков приводит и синтезу жирных кислот, содержащих обычно 16 – 18 углеродных атомов.
Жирные кислоты с нечетным числом углеродных атомов образуются в результате начальной конденсации пропионил-АПБ с малонилАПБ.
Вклетках бактерий компонентами липидов являются в основном насыщенные жирные кислоты или содержащие одну двойную связь (мононенасыщенные). Полиненасыщенные жирные кислоты, содержащие две и более двойных связей, найдены до сих пор только у цианобактерий.
Синтез фосфолипидов. Исходным субстратом служит фосфодиоксиацетон (промежуточное соединение гликолитического пути). Фосфодиоксиацетон восстанавливается и образуется 3- фосфоглицерин:
фосфодиоксиацетон + НАДФ . Н2  3 фосфоглицерин + НАДФ+.
3 фосфоглицерин + НАДФ+.
3-фосфоглицерин взаимодействует с двумя остатками жирных кислот в виде комплекса с белком АПБ. Образуются фосфатидная кислота:
3-фосфоглицерин + 2Ацил-АПБ  фосфатидная кислота + 2 АПБ.
фосфатидная кислота + 2 АПБ.
Присоединение к фосфатной группе фосфатидной кислоты серина, инозита, глицерина или другого соединения приводят к синтезу фосфатидилсерина, фосфатидилинозита и фосфатидилглицерина соответственно.
6.2.4. Биосинтез углеводов
Если микроорганизмы являются автотрофами, то исходным веществом для синтеза углеводов является СО2. Синтез углеводов происходит у большинства автотрофов в цикле Кальвина (восстановитель-
165

ный пентозофосфатный цикл), который функционирует так же как и у растений. Для цикла Кальвина характерны два специфических фермента, не участвующие в других метаболических путях. Это:
-фосфорибулокиназа, превращающая рибулозо-5-фосфат, при участии АТФ в рибулозо-1,5-дифосфат, который затем выступает в качестве акцептора СО2;
-рибулозо-1,5-дифосфаткарбоксилаза, катализующая реакцию
фиксации СО2 рибулозо-1,5-дифосфатом с образованием двух молекул 3-фосфоглицериновой кислоты. Последняя подвергается серии последовательных ферментативных превращений, ведущих к образованию молекулы глюкозы.
У бактерий-гетеротрофов на среде с неуглеводными предшественниками, например, аминокислотами, глицерином, молочной кислотой синтез углеводов осуществляется с использованием реакций гликолитического пути, идущих в обратном направлении. Этот процесс называется глюконеогенезом. Но некоторые ферментативные реакции гликолитического пути необратимы (реакции, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой). Поэтому в клетках гетеротрофных прокариот, способных использовать двух- и трехуглеродные соединения, сформировались специальные ферментативные реакции, позволяющие обходить необратимые реакции гликолитического пути. Одной из таких обходных реакций у бактерий E.coli и других бактерий является превращение пирувата в фосфоенолпируват (ФЕП) под действием фосфоенолпируватсинтетазы:
фосфоенолпируватсинтетаза
Пируват + АТФ + Н2О |
ФЕП + АМФ. |
Образовавшиеся таким образом углеводы используются на синтез олиго- и полисахаридов. Биосинтез полисахаридов осуществляется путем трансгликозилирования, т.е. путем переноса остатков моносахаридов на конец растущей цепи полисахарида. Этот процесс всегда сопровождается затратой энергии.
166
Глава 7. ГЕНЕТИКА БАКТЕРИЙ
Генетика – это наука о наследственности и изменчивости живых организмов. В отличие от классической генетики генетика бактерий – относительно молодая отрасль науки, первые работы появились вначале 40 годов прошлого столетия. Генетика бактерий использует все термины и определения характерные для классической генетики. С момента возникновения и до сих пор генетика бактерий завоевала необычайную популярность. Такой успех обусловлен двумя главными причинами:
-во-первых, основные принципы генетики бактерий в равной степени применимы ко всем животным и растительным организмам независимо от того многоклеточные они или одноклеточные. Это выражается в том, что все живые организмы обладают сходными по ряду свойств детерминантами наследственных признаков. Это сходство распространяется на природу самих детерминантов (гены), их месторасположение (ДНК), передачу потомству, стабильность, а также и на способ контроля процессов, приводящих к развитию определенных признаков;
-во-вторых, в исследованиях наследственности бактерии в значительной степени заменили такие излюбленные объекты, как плодовая мушка, мышь, кукуруза, поскольку они очень быстро размножаются и образуют огромные популяции; кроме того, культивирование их относительно просто. Иными словами, генетический анализ можно проводить в короткие сроки на огромном числе особей и они не требуют много места. Кроме того, бактерии позволяют изучать биологические явления на клеточном уровне и избежать тем самым сложных взаимодействий и взаимозависимостей, типичных для высших организмов.
7.1. Мутации у бактерий. Доказательства существования
мутаций у бактерий
Термин «мутация» введен Г. Де Фризом (1901), изучавшим изменчивость и наследственность у растений и определившим мутацию как «скачкообразное изменение наследственного признака». Это понятие М.Бейеринк (1912) позднее распространил и на бактерии.
Мутация – событие редкое и обычно происходит с частотой 1. 10-4 – 1. 10-10. Это означает, что мутантной является одна клетка из 10 000 или 10 млрд. клеток. Мутантная клетка несет измененную ин-
167
формацию и, следовательно, формирует на питательной среде мутантные клоны.
Врезультате ряда экспериментов были получены доказательства относительно того, что у бактерий мутации носят спонтанный и ненаправленный характер. К ним относятся эксперименты С.Лурия, М.Дельбрюка, Г.Ньюкомба и супругов Е. и Дж. Ледерберг. Рассмотрим эти эксперименты.
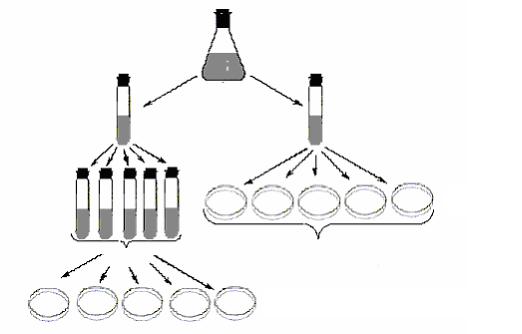
В1943 году С.Луриа и М.Дельбрюк экспериментально доказали спонтанное возникновение бактериальных мутантов с помощью флуктуационного теста. В эксперименте использовали бактериофаг Т1, который обладал высокой степенью вирулентности в отношении бактерий E.coli. Изучалось возникновение резистентности у бактерий E.coli к данному фагу.
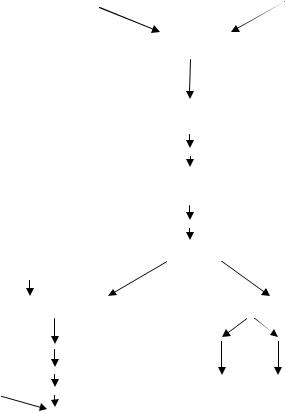
Культуру бактерий E.coli, выделенную из одной колонии (т.е. чистую культуру, без примесей), чувствительную к бактериофагу Т1, выращивали до определенной концентрации и делили на 2 части. Далее одну порцию распределяли по 1 мл на 100 пробирок. Вторую порцию оставляли целой. Все пробирки помещали в одинаковые условия. После равного срока выращивания на чашки с фагом Т1 производили высев культур из каждой пробирки (одинаковое количество – по 1 мл) (рис. 54).
|
|
1 мл |
1 мл |
|
|
|
|
|
|
|
|
100 шт.
|
|
Чашки с фагом Т1 |
100 шт. |
|
|
|
|
|
Чашки с фагом Т1
Рис. 54. Флуктуационный тест С.Луриа и М.Дельбрюка
168
