
Лысак Микробиология
.pdf-образование эффективных конъюгационных пар;
-перенос генетического материала из донорных клеток в реципиентные клетки;
-постконъюгационный синтез донорной ДНК в реципиентной клетке;
-гомологичная рекомбинация перенесенного фрагмента донорной ДНК с ДНК реципиентной клетки.
Применение конъюгации:
1. В процессе конъюгации можно передавать из одних клеток в другие клетки многие генетические маркеры. Показано, что при конъюгации вся хромосома бактерий E.coli передается за 100 минут. В «мягких» условиях можно добиться переноса всей хромосомы и даже повторной передачи хромосомы по механизму «котящегося кольца» или «разматывающегося рулона», если в хромосоме нет профага.
2.Метод конъюгационного скрещивания удобен для картирования хромосомы. Карта хромосомы у бактерий строится в минутах. У бактерий E.coli началом карты (0 мин) являются точки локализации генов, ответственных за синтез треонина и лейцина.
3.Конъюгация используется для изучения генетического аппарата
убактерий.
4.Конъюгация имеет место в природе и поэтому она является важным фактором изменчивости бактерий.
7.5.3. Трансдукция
Трансдукция была открыта в 1952 году, после того как была уже описана трансформация у пневмококков и конъюгация у бактерий
E.coli.
Циндер Н., будучи ещё студентом, работал в лаборатории Е.Ледерберга. Он пытался обнаружить конъюгацию у бактерий Salmonella typhimurium. В его распоряжении было 20 моноауксотрофных штаммов S. typhimurium. Циндер Н. смешивал эти штаммы попарно в различных комбинациях и пытался выявить прототрофное потомство. В результате в 9 случаях из 79 исследованных комбинаций с частотой 10-5 – 10-6 он выявил прототрофные клоны. Поскольку исходные штаммы на минимальной среде не давали ревертантов, то Н.Циндер сделал вывод, сто между штаммами S.typhimurium осуществляется конъюгация, при которой происходит передача наследственной информации. Для подтверждения этого Н.Циндер и Е.Ледерберг повторили опыт Б.Дэвиса с U-образной пробиркой, разделенной стеклян-
229
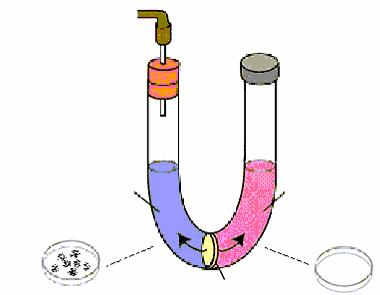
ным фильтром, не пропускающим бактериальные клетки. В опыте использовались 2 штамма бактерий S. typhimurium:
S. typhimurium 2A his - и S. typhimurium 22 A trp- .
Водну ветвь U-образной пробирки вносили культуру штамма 22А
вконцентрации 1.108 клеток/мл, в другую ветвь такое же количество клеток штамма 2А. После определенного периода инкубации в ветви
пробирки, в которую были внесены клетки штамма 22А, Н.Циндер и Е.Ледерберг обнаружили прототрофные клетки с частотой 1.10-5. В той ветви пробирки, в которую были внесены клетки штамма 2А, прототрофы отсутствовали (рис. 68).
штамм 22 А |
|
штамм 2 А |
|
|
|
минимальная |
|
бактериальный фильтр |
|
|
|
|
минимальная |
||
глюкозо-солевая среда |
|
|
|
|
|
|
|
глюкозо-солевая среда |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 68. Схематическое изображение классического опыта Н.Циндера и Е.Ледерберга
Полученные результаты не подтвердили предположение Н.Циндера и Е.Ледерберга о конъюгационном переносе наследственной информации у штаммов 2А и 22А S. typhimurium. Последующая проверка этих штаммов показала, что штамм 22А загрязнен фагом Р22. Этот фаг способен инфицировать и лизировать клетки штамма 2А. После проникновения через стеклянный фильтр этот фаг инфицировал клетки штамма 2А, репродуцировался и лизировал их. При этом освобождался фильтрующийся агент (ФА) (так его называли Н.Циндер и Е.Ледерберг). Он в свою очередь проникал через стеклянный фильтр. Под влиянием ФА некоторые клетки штамма 22А приобретают спе-
230
цифические наследственные свойства, характерные для того штамма (штамма 2А), из которого выделялся ФА – способность синтезировать триптофан. Было установлено, что активность агента, способного к фильтрации (ФА), не утрачивается при обработке его ДНКазой. Значит это не трансформация. Вместе с тем показано, что свойства фильтрующегося агента идентичны свойствам фага Р22. Был сделан вывод, что фаг Р22 переносит наследственную информацию от клеток штамма 2А в клетки штамма 22А.
Явление переноса генетической информации от клетки-донора к клетке-реципиенту с помощью фага было названо трансдукцией.
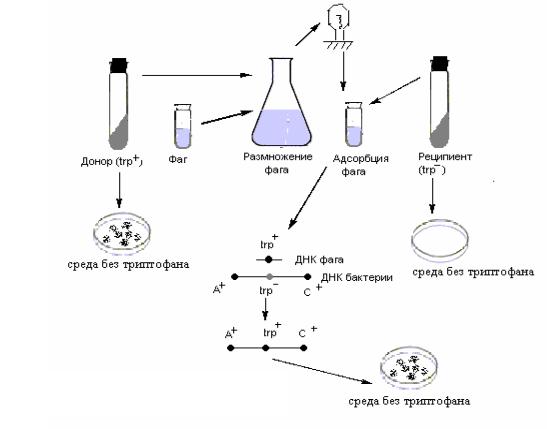
Трансдукция основана на том, что в процессе размножения фагов в бактериях могут образовываться фаговые частицы, которые наряду с фаговой ДНК или вместо нее содержат фрагменты бактериальной ДНК. Такие фаговые частицы называются трансдуцирующими. По морфологии и адсорбционным свойствам они ничем не отличаются от обычных фаговых вирионов, но при заражении ими новых клеток, передают генетические детерминанты предыдущего хозяина. Таким образом, чтобы осуществить трансдукцию необходимо размножить фаг на клетках штамма-донора, а затем заразить полученным фаголизатом клетки-реципиента. Отбор трансдуктантов проводят на селективных средах, где не могут расти исходные реципиентные клетки (рис. 69).
Рис. 69. Схема опыта по трансдукции
Изучение трансдукции показало, что одни фаги могут переносить разные бактериальные гены, а другие – только определенные гены. В соответствии с этим трансдукцию принято делить на:
-генерализованную (неспецифическую или общую);
-ограниченную или специфическую.
При генерализованной трансдукции может трансдуцироваться любой бактериальный ген примерно с одинаково высокой частотой. При специфической трансдукции могут переноситься строго определенные фрагменты ДНК.
В осуществлении генерализованной трансдукции бактериальный вирус является только переносчиком генетического материала бактерий. При специфической трансдукции вирус включает ДНК бактерий в свой геном и передает ее, лизогенизируя бактерии-реципиенты.
Разберем как осуществляется генерализованная и специфическая трансдукция.
7.5.3.1. Генерализованная трансдукция
Одним из умеренных бактериофагов, осуществляющих общую или неспецифическую трансдукцию, является уже упоминаемый нами фаг Р22 S. typhimurium, с которым работали Н.Циндер и Е.Ледерберг. Следовательно, эти ученые открыли неспецифическую трансдукцию. К фагам, осуществляющим общую трансдукцию относятся также фа-
ги: P1 E.coli, PBS1 B.subtilis и другие.
Генерализованная трансдукция обеспечивается дефектными частицами фагов. Образование таких частиц происходит в ходе репродукции фагов, сопровождающейся распадом бактериальной хромосомной ДНК. Следует отметить, что образование их может происходить как при литическом развитии фага (фаги Р22 S. typhimurium и P1 E.coli), так и после индукции профага ( фаг P1 E.coli). При этом часть фаговых оболочек начинает упаковываться не фаговой, а бактериальной ДНК. Размеры фрагментов бактериальной ДНК, включающейся в такие частицы, не превышают объем головки, т.е. упаковаться может столько сколько вмещает головка фага. Упаковываться в фаговые головки могут самые разнообразные фрагменты бактериальной хромосомы.
Если полученным фаголизатом, содержащим как нормальные, так и дефектные частицы, обработать клетки штамма-реципиента, то заражение их нормальным фагом ведет, как правило, к лизису клеток. Однако некоторые клетки инфицируют дефектные трансдуцирующие фаги. В клетки поступают короткие фрагменты двунитевой ДНК до-
232

нора. Циркуляризации бактериальной ДНК при этом не происходит, т.е. в рекомбинацию с ДНК реципиента вступают линейные фрагменты ДНК донора. Рекомбинация, происходящая при общей трансдукции, находится под контролем recA-гена, т.е. это общая гомологичная рекомбинация, осуществляемая путем реципрокного обмена соответствующими гомологичными участками. Возникают рекомбинанты, называемые трансдуктантами. Трансдуктанты нелизогенны и не обладают иммунитетом к фагам, так как трансдуцирующие частицы, вызвавшие образование их, не содержат фаговой ДНК (рис. 70).
При генерализованной трансдукции переносится может любой бактериальный признак с частотой 10-5–10-6. Количество бактериальной ДНК, которое может переносится фагом обычно составляет 1–2 % от всего количества ДНК, содержащегося в клетке. Исключение составляет бактериофаг РBS1 B.subtilis, который может трансдуцировать до 8% генома хозяина.
донор
фаголизат
реципиент
трансдуктант
Рис. 70. Схема общей трансдукции
Однако при общей или генерализованной трансдукции могут возникать не только истинные рекомбинанты-трансдуктанты, в которых привнесенный ген наследуется стабильно из поколения в поколение
233
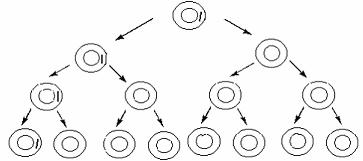
(полная или завершенная трансдукция), но и абортивные трансдуктанты. При абортивной или незавершенной трансдукции внесенный дефектным фагом фрагмент бактериальной хромосомной ДНК донора не рекомбинирует с хромосомной ДНК реципиентной клетки. Находясь в реципиентной клетке привнесенный ген экспрессируется, что придает клетке новый фенотип, например, приобретение клеткойреципиентом способности синтезировать какую-то аминокислоту. Однако ген экзогеноты (привнесенный ген) не способен реплицироваться. Вследствие этого при делении клетки он передается только одной из дочерних особей, но во второй клетке еще остается белок – продукт экспрессии привнесенного гена. Поэтому эта клетка в какойто мере сохраняет привнесенный фенотип. С ростом числа делений идет разведение данного продукта, поэтому абортивные трансдуктанты на селективной среде формируют микроколонии по сравнению с колониями истинных трансдуктантов. Такие микроколонии абортивных трансдуктантов содержат только одну клетку, несущую экзогеноту или привнесенный фагом ген донорной ДНК (рис. 71).
Рис. 71. Абортивная трансдукция
Впервые абортивную трансдукцию обнаружили при передаче генов, ответственных за жгутикообразование, по образованию на питательной среде «ползущих следов» или шлейфов. При исследовании под микроскопом таких клонов оказалось, что жгутик, а следовательно подвижность, сохраняет одна клетка. При посеве таких клонов в малоплотную (полужидкую) питательную среду клетки растут по уколу и появляется в среде волнистая структура («шлейф», «ползущий след»): подвижная клетки передвигается, делится и по дороге оставляет неподвижное потомство.
Установлено, что соотношение между завершенной и абортивной трансдукцией примерно равно 1:10, т.е. абортивная трансдукция происходит чаще чем полная завершенная.
234
7.5.3.2. Специфическая трансдукция
Специфическая трансдукция была открыта в 1956 году М.Морзе и супругами Е. и Дж.Ледерберг. Характерной особенностью специфической трансдукции является то, что каждый специфически трансдуцирующий фаг передает только определенную, весьма ограниченную область бактериальной хромосомы. Если в генерализованной трансдукции фаг выступает в качестве «пассивного» переносчика генетического материала бактерий, а генетическая рекомбинация у трансдуцируемых бактерийпроисходит по общим закономерностям рекомбинационного процесса, то при специфической трансдукции фаг не только переносит генетический материал, но и обеспечивает его включение в бактериальную хромосому.
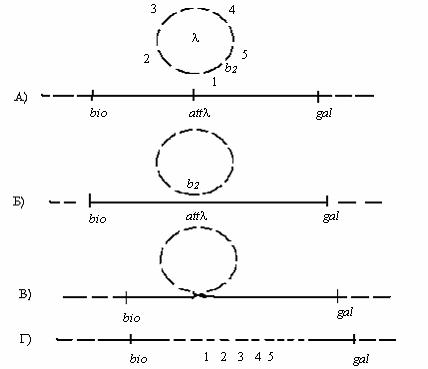
Наиболее известным примером специфической трансдукции является трансдукция, осуществляемая фагом λ, который способен заражать клетки бактерий E.coli (рис. 72).
Рис. 72 . Включение профага λ в хромосому E.coli
Примечание: А – кольцевая хромосома (ДНК) вегетативного фага λ и бактериальная хромосома E.coli. 1,2,3,4,5 – условно обозначенные гены фага λ; bio; attλ; gal - бактериальные гены; Б – синапс, образуемый между фаговой и бактериальной хромосомой в области бактериального гена attλ ; В – разрыв хромосомы фага в точке между генами 1 и 5 (область b2) и разрыв хромосомы бактерий в области
235
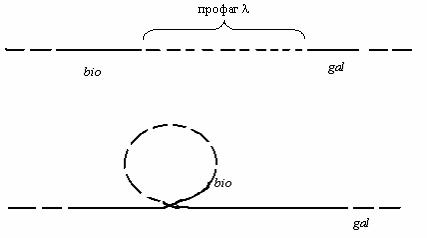
attλ. Возникновение кроссинговера между хромосомой фага и бактерии; Г – образование непрерывной генетической структуры, в которой встроена ДНК фага.
Умеренный фаг λ при лизогенизации бактерий встраивается в их хромосому только в одном месте на участке между локусами gal и bio в результате сайт-специфической рекомбинации (разрыв и перекрестное воссоединение цепей ДНК). Этот участок получил название attλ. Вырезание (эксцизия) профага из хромосомы при индукции профага осуществляется также по механизму сайт-специфической рекомбинации.
Сайт-специфическая рекомбинация происходит точно, но не безошибочно. Приблизительно один раз на 1 миллион при эксцизии профага рекомбинация осуществляется не в attλ-сайте, а захватывает участки gal или bio. Полагают, что это обусловлено «неправильным» образованием петли при дезинтеграции профага. В результате этого прилегающая к профагу область бактериального генома выщепляется из состава хромосомы и переходит в состав генома свободного фага. Соответствующая по расположению в петле область генома профага остается в бактериальной хромосоме (рис. 73). Таким образом, между профагом и бактериальной хромосомой осуществляется генетический обмен. Встраивающийся в геном фага бактериальный генетический материал может заместить до 1/3 генетического материала фага.
Рис. 73. Схематическое образование дефектных фаговых частиц
После упаковки такой фаговой ДНК, в которой ее часть замещена бактериальной ДНК, в фаговую головку образуются дефектные фаговые частицы. Фаг дефектен, потому что емкость головки ограничена и при включении в его геном фрагмента бактериальной ДНК, часть фагового генома остается в хромосоме бактерий. Если дефект несущест-
236
венен, то фаг живет, так как его белковая оболочка недефектна (адсорбция возможна). Такой дефектный фаг может заражать другие клетки, но не может вызвать репродуктивную инфекцию, так как гены, ответственные за репродукцию, отсутствуют. Если в таком дефектном фаге в ДНК сохранились липкие концы, обеспечивающие превращение ее в циркулярную форму, то ДНК дефектного фага вместе с фрагментом бактериальной ДНК может встроиться в ДНК реципиентных бактерий и вызвать их лизогенизацию.
Было установлено, что при индукции профага λ чаще образуются дефектные частицы, содержащие в своем геноме гены локуса gal. Такие дефектные частицы обозначают λdgal (от фаг λ, defective, gal). Если в геноме фага λ содержится ген, ответственный за синтез биотина,
то – λdbio.
Следовательно, если фаголизатом, полученным после заражения донорных бактерий фагом λ, в котором содержится дефектные частицы, обработать реципиентные клетки bio- или gal-, то с частотой 10-5
– 10-6 образуются трансдуктанты bio+ или gal+.
Специфическая трансдукция у E.coli осуществляется не только фагом λ, но и родственными ему фагами, получившими наименование ламбдоидных фагов. К числу таких фагов относятся Phi 80, 434, 21 и некоторые другие.
В частности фаг Phi 80 включается в хромосому вблизи генов, кодирующих ферменты, ответственные за синтез триптофана. По этой причине фаг Phi 80 пригоден для переноса генов trp.
Было установлено, что фаг P22 S.typhimurium кроме общей трансдукции может осуществлять и специфическую трансдукцию. При литическом цикле развития бактериофаг Р22 может осуществлять общую трансдукцию, а при лизогенизации – специфическую. ДНК фага Р22 интегрируется в участок хромосомы рядом с генами, ответственными за синтез пролина. Интеграция профага резко стимулирует образование специфически трансдуцирующих частиц.
Таким образом, для осуществления специфической трансдукции необходима предварительная лизогенизация бактерий-доноров и последующая индукция профага. Образовавшиеся при этом дефектные трансдуцирующие частицы фагов заражают клетки реципиентного штамма, происходит их лизогенизация, т.е. встраивание профага с участком генома бактерий донора в хромосому реципиента.
Использование трансдукции:
237
- можно трансдуцировать плазмиды и короткие фрагменты хромосомы донора;
-для конструирования штаммов заданного генотипа, в частности изогенных штаммов. Здесь малый размер передаваемых фрагментов обеспечивает преимущество трансдукции перед конъюгацией. Изогенные штаммы, сконструированные при помощи генерализованной трансдукции, различаются только по участку хромосомы, переносимому трансдуцирующим фагом;
-для точного картирования бактериальных генов, установления порядка и их расположения в оперонах и тонкой структуры отдельных генетических детерминант. Это делают с помощью комплементационного теста. Известно, что для синтеза определенной группы продуктов необходимо функционирование нескольких генов. Допустим,
что для синтеза какого-то фермента нужны гены а и b. Пусть есть 2 фенотипически одинаковые мутанты (АВ)- и (АВ)-, но мы не знаем они генетически идентичны или различны. Для идентификации генотипа проводят трансдукцию, т.е. размножают фаг на клетках одной популяции, а затем фаголизатом заражают вторую популяцию. Если затем при высеве на селективную среду формируются большие колонии истинных трансдуктантов и маленькие колонии абортивных трансдуктантов, тогда делают вывод, что мутации находятся в разных генах:
Если образуются только колонии истинных трансдуктантов, тогда делают вывод, что мутации находятся в одном гене, но в разных сайтах:
Если трансдуктанты вообще не образуются, то данные мутации идентичны:
238
