
- •Реферат на тему:
- •Глава 1. Развитие представлений об электролитической диссоциации
- •Основные положения теории Аррениуса
- •1.2. Недостатки классической теории электролитической диссоциации
- •1.3. Спектроскопические методы исследования строения растворов электролитов
- •Глава 2. Ион-дипольное взаимодействие в растворах электролитов.
- •2.1. Механизмы образования растворов электролитов
- •2.2. Энергия кристаллической решетки
- •2.3. Энергия сольватации
- •2.4. Корреляционные подходы к сравнению свойств растворителей
- •2.5. Состояние ионов в растворах
- •Глава 3. Ион-ионное взаимодействие в растворах электролитов.
- •3.1. Термодинамическое описание равновесий в растворах электролитов
- •3.2. Распределение ионов в растворе электролита и потенциал ионной атмосферы
- •3.3. Теория Дебая-Хюккеля
- •3.4. Ионная ассоциация в растворах электролитов
- •3.5. Эмпирические и полуэмпирические методы описания термодинамических свойств растворов
- •3.6. Современное состояние и перспективы развития теории растворов электролитов
- •Список литературы
2.3. Энергия сольватации
Энергия сольватации
представляет собой выигрыш в энергии,
который получается при перенесении
моля исследуемых ионов из вакуума в
данный растворитель. При этом
предполагается, что такой выигрыш
энергии не включает в себя электростатическое
взаимодействие ионов, которое неизбежно
сказалось бы уже при введении в
растворитель второго и каждого
последующего ионов. Чтобы избежать
этого осложнения, раствор нужно
поддерживать электронейтральным, т.е.
вводить в него соответствующее количество
ионов противоположного знака, а взаимное
притяжение катионов и анионов элиминировать
достаточным (теоретически бесконечным)
разбавлением раствора.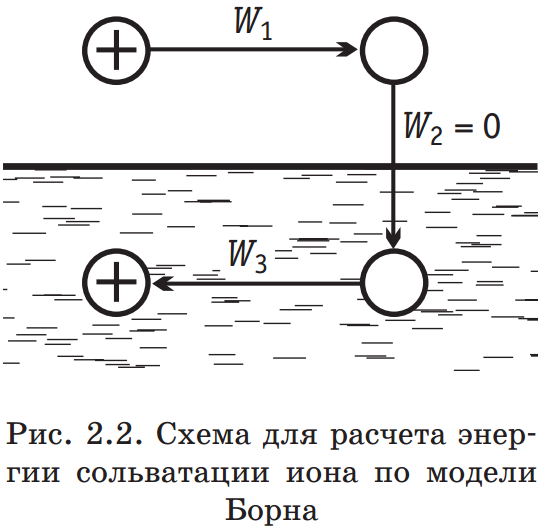
Наиболее простая модель для оценки энергии сольватации была предложена М. Борном. Согласно этой модели, ион рассматривается как заряженный шарик радиуса ri, а растворитель — как сплошная однородная среда (континуум) с диэлектрической постоянной ε. Процесс переноса заряженного шарика из вакуума в среду разбивается на три этапа: 1) разряд шарика в вакууме; 2) перенос незаряженного шарика из вакуума в растворитель; 3) заряжение шарика в среде (рис. 2.2). При этом предполагается, что работа на втором этапе W2 = 0, а для расчета работы на этапах 1 и 3 (W1 и W3) используются основные законы электростатики. Так, согласно закону Кулона, сила, действующая на каждый из двух зарядов q1 и q2 (с учетом знака), находящихся в среде с диэлектрической постоянной ε на расстоянии r, равна:
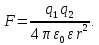 (2.3.1)
(2.3.1)
Поэтому напряженность поля X, т. е. сила, которая действует на заряд +1, находящийся в среде на расстоянии r от заряда q, составляет:
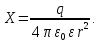 (2.3.2)
(2.3.2)
Поскольку напряженность
поля связана с электрическим потенциалом
ϕ общей формулой
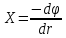 ,
то для потенциала на поверхности сферы
радиуса ri получаем:
,
то для потенциала на поверхности сферы
радиуса ri получаем:
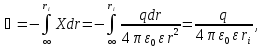 (2.3.3)
(2.3.3)
где нижний предел интегрирования соответствует выбору нулевого потенциала на бесконечно большом расстоянии от рассматриваемой сферы. Из уравнения (2.3.3) вытекает следующая формула для работы заряжения сферы:
 (2.3.4)
(2.3.4)
В соответствии с формулой (2.3.4), для работ W1 и W3 получаем выражения
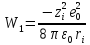 и
и
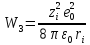 ,
,
где zie0 - заряд иона.
Учитывая, что свободная
энергия сольватации
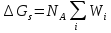 ,
,
выводим основную формулу модели Борна:
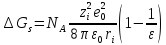 .
(2.3.5)
.
(2.3.5)
Если воспользоваться уравнением Гиббса—Гельмгольца, согласно которому
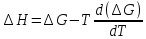 , (2.3.6)
, (2.3.6)
то из уравнения (2.3.5) можно получить также выражение для энтальпии сольватации:
-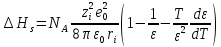 ,
(2.3.7)
,
(2.3.7)
Уравнение (2.3.7) называют уравнением Борна—Бьеррума.
Энергии гидратации, рассчитанные по модели Борна, весьма значительны и достаточны для разрушения кристаллической решетки при образовании растворов электролитов. Этот наиболее важный качественный вывод из теории Борна показывает, что основной причиной образования и устойчивости растворов электролитов служит сольватация ионов. К этому выводу можно прийти также, не производя расчетов, а сопоставляя формулы (2.2.6) и (2.3.5). Если в этих формулах пренебречь 1/n и 1/ε по сравнению с единицей, положить z1=z2, то энергия сольватации одного иона окажется равной половине энергии кристаллической решетки. Иначе говоря, энергия сольватации двух ионов - катиона и аниона - как раз скомпенсирует энергию разрушения решетки кристалла.
Для количественной проверки теории сольватации Борна удобно воспользоваться следующим приемом. Сложим энтальпии гидратации катиона и аниона и сравним полученную величину с тепловым эффектом сольватации соответствующей соли, вычисленным из термодинамического цикла. Например, для хлорида натрия
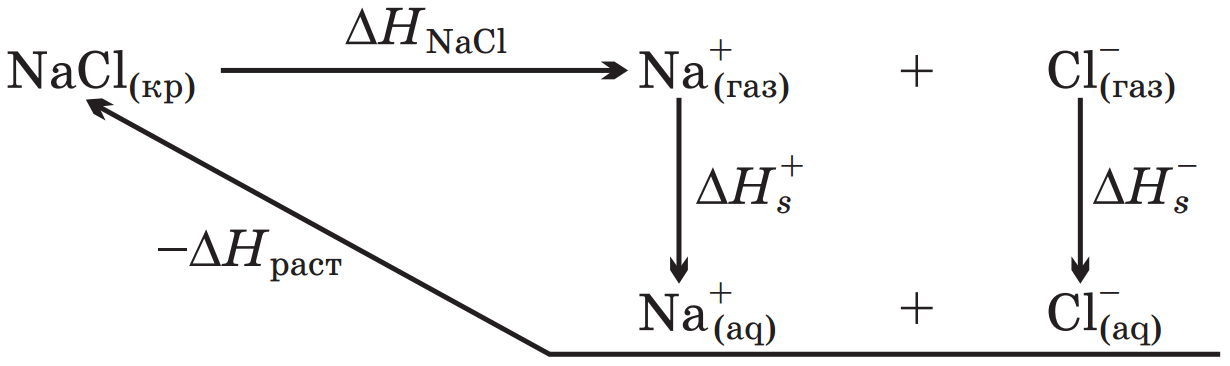
Где ∆Hраст – тепловой эффект растворения, экстраполированный на бесконечно разбавленный раствор соли.
Из этого цикла для теплового эффекта сольватации хлорида натрия получаем:
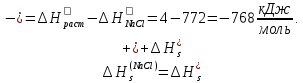
Аналогичным способом можно рассчитать ∆Hs и для другихсолей.
Рассчитанные по Борну величины ∆Hs (соли) значительно превышают соответствующие экспериментальные значения. Это указывает на весьма приближенный характер допущений, положенных в основу модели Борна. Поэтому были предприняты неоднократные попытки уточнить теорию сольватации Борна (Бернал и Фаулер; Уэбб; ван-Аркель и де-Бур; Эли и Эванс; Фрэнк и Венн и др.). Некоторые из них проводились в рамках все того же континуального подхода (например, поправки на уменьшение диэлектрической постоянной растворителя вблизи иона за счет более жесткой ориентации диполей в поле иона, а также учет работы сжатия растворителя при введении в него электролита — эффекта электрострикции). Предлагались также поправки, основанные на учете реальных микроскопических свойств дипольных жидкостей, например тетраэдрической структуры воды и энергии ее разрушения в ходе сольватации. Детализация микроскопического строения растворов, развитие молекулярно-статистических теорий и расчетных методов позволяют в настоящее время использовать значительно более сложные модели и во многих случаях устранить различия между рассчитанными и экспериментальными значениями ∆Hs (соли). Однако при детальной проверке этих моделей встает задача экспериментального определения энергии сольватации отдельного иона, так как при суммировании рассчитанных величин ∆Hs+ и ∆Hs− ошибки, обусловленные недостатками моделей, могут скомпенсироваться.
