
Химическая_термодинамика_практикум_II
.pdf
1 |
= |
1 |
+ |
1 |
CλС |
, |
|
|
||
|
λС |
|
λ2∞K0 |
|
|
|||||
|
|
λ∞ |
|
|
|
|||||
где СλС = κ0. |
|
|
1 |
|
||||||
Последнее из них - уравнение прямой в координатах |
−СλС , оно |
|||||||||
λ |
||||||||||
|
|
|
|
|
|
|
|
С |
|
|
представлено графически на рис.IV.1.
Экстраполяцией к C=0 (λС=0) имеем 1/λС =1/λ∞ , т.е. на оси ординат отсекается отрезок, равный величине 1/λ∞. Определив значение λ∞, рассчитывают α и KC для нескольких значений концентраций и среднее значение KC из графика по тангенсу угла наклона.
По окончании расчета полезно найти значение КС в единицах моль/л, обычно используемых в химической практике
1
λсС
α tgα= 1/λ2∞КС
1
λ ∞
0 |
λCc |
Рис.IV.1. График для вычисления λ∞ и Кс
Если измерить KC при двух температурах, то по уравнению ВантГоффа (II.5) можно вычислить ∆Ho и, следовательно, теплоту диссоциации. Далее, из уравнений:
∆G o = −RT ln K C и ∆Go = ∆Ho −T∆So
находят ∆So процесса диссоциации. По величинам ∆Ho и ∆So делают вывод о факторах, влияющих на диссоциацию электролита.
Для защиты работы студенту необходимо:
- по полученным данным рассчитать степень диссоциации и константу диссоциации, определить ее среднее значение,
41
- построить график и определить по тангенсу угла наклона значение константы диссоциации
- определить термодинамические параметры реакции диссоциации,
- объяснить, какие факторы определяют величину константы диссоциации.
IV.2. ИЗУЧЕНИЕ ЗАВИСИМОСТИ СРЕДНЕГО КОЭФФИЦИЕНТА АКТИВНОСТИ ИОНОВ ОТ КОНЦЕНТРАЦИИ ЭЛЕКТРОЛИТА
Цель работы: Методом ЭДС измеряются активности ионов в растворах электролитов, рассчитываются коэффициенты активности и определяется зависимость коэффициента активности от ионной силы раствора,
Реактивы: раствор сульфата меди или сульфата цинка, заданной преподавателем концентрации, дистиллированная вода,
Оборудование: потенциометр, элемент с хлорсеребряным электродом сравнения, конические колбы, пипетки, выпрямитель,
Порядок выполнения работы:
В работе измеряют активности ионов металлов - меди или цинка - в растворах их сульфатов. Найденные активности используют для вычисления коэффициентов активностей ионов меди или цинка. При одинаковых зарядах катиона и аниона их коэффициенты активностей примерно одинаковы и совпадают со средним значением коэффициента активности изучаемого элемента.
Исследуемый полуэлемент представляет собой медный или цинковый электрод, погруженный в раствор соответствующего сульфата. Гальванический элемент составляют из исследуемого элемента и электрода сравнения - хлорсеребряного или каломельного
Исследуемый раствор сульфата меди или цинка с заданной преподавателем начальной концентрацией С0 используют для приготовления пяти растворов более низкой концентрации. Рекомендуются следующие разбавления:
для ZnSO4 |
- 25 мл исходного раствора и 25 мл воды; |
для CuSO4 |
- 40 мл исходного раствора и 25 мл воды. |
Каждый из приготовленных растворов может быть использован для приготовления раствора еще более низкой концентрации путем разбавления водой в тех же пропорциях.
Металлические электроды должны быть подготовлены к работе. Поверхность металла очищают наждачной бумагой и промывают водой, затем на поверхности электрода осаждают электролитически свежий слой
42
металла. Для этого исследуемый электрод опускают в стакан с соответствующим раствором, например, медный электрод - в раствор сульфата меди, и подключают его к отрицательному полюсу выпрямителя. Второй электрод из этого же металла подключают к положительному полюсу. Устанавливают силу тока в пределах 80-120 мА и пропускают ток в течение 1 минуты. Затем электрод промывают и проверяют его пригодность.
Для проверки составляют гальванический элемент из цинкового или медного электрода с раствором сульфата определенной концентрации в паре с электродом сравнения. При использовании хлорсеребряного электрода сравнения и растворов сульфатов меди и цинка с концентрацией, равной 1 моль/л, ЭДС составленного элемента должна иметь следующие значения: 0,1004 В при работе с медным электродом и 0,9999 В при работе с цинковым.
Используя приготовленные ранее растворы сульфатов разных концентраций и хлорсеребряный электрод сравнения, составляют гальванические элементы и измеряют значения ЭДС. Затем рассчитывают потенциалы исследуемого электрода ϕх при различных концентрациях электролита и активности ионов металла в растворе, используя при расчете табличные значения стандартных потенциалов медного или цинкового электрода. Измерение ЭДС для каждой концентрации электролита проводят несколько раз и используют средние арифметические значения для каждой концентрации раствора. Из найденных активностей вычисляют коэффициенты активности и строят график зависимости lg γ± от √Ι. Результаты измерений и вычислений должны быть сведены в табл.IV.3.
Таблица IV.3
Результаты измерений и расчетов
№ п/п |
С, моль/л |
Е, В |
ϕх, В |
lg aX2+ |
aX2+ |
γ± |
lgγ± |
√I |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
… |
… |
… |
… |
… |
… |
… |
… |
… |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для защиты работы необходимо:
-записать схему гальванического элемента, реакции, протекающие на электродах и в элементе,
-записать выражения электродных потенциалов и ЭДС элемента,
43
-рассчитать коэффициенты активности меди или цинка в растворах различной концентрации,
-рассчитать ионную силу для всех концентраций раствора электролита,
-построить график в координатах lg γ± от √Ι. И сделать выводы о поведении (идеальный или неидеальный) раствора электролита.
IV.3. ОПРЕДЕЛЕНИЕ ИОННОГО ПРОИЗВЕДЕНИЯ ВОДЫ С ПОМОЩЬЮ ВОДОРОДНОГО КОНЦЕНТРАЦИОННОГО ЭЛЕМЕНТА
Цель работы: Определение ионного произведения воды методом ЭДС с использованием концентрационного водородного элемента без переноса ионов.
Реактивы: растворы 0,1 М КОН и 0,1 М НCl.
Оборудование: генератор водорода, хлорсеребряный электрод, водородный электрод, иономер.
Порядок выполнения работы:
Вода в очень слабой степени диссоциирует на ионы: Н2О - Н+ + ОН-
Константа равновесия этой реакции равна:
аН+ .аОН− |
|
|
Ка = |
|
. |
аН О |
||
|
2 |
|
Поскольку степень диссоциации воды незначительна, активность воды можно считать равной единице и, следовательно,
аН+•аОН- = Ка . аН2О = KW
где KW – постоянная величина при данной температуре, называемая ионным произведением воды.
Ионное произведение воды обычно определяют, используя водородный концентрационный элемент, состоящий из двух платиновых электродов, покрытых платиновой чернью и насыщенных водородом:
Pt, H2 | KOH || HCl | H2, Pt.
Один из электродов погружен в кислоту, другой – в раствор щелочи. В кислоте концентрация ионов водорода значительно больше, чем в растворе щелочи. Ионы водорода на левом электроде с водородного электрода будут переходить в раствор щелочи, а на электроде останутся электроны:
1/2H2 = H+ + e.
44
На электроде, погруженном в раствор кислоты, этот процесс выражен гораздо слабее, поэтому при замыкании цепи электроны переходят от электрода, находящегося в растворе щелочи, к электроду, находящемуся в кислоте, на котором будет происходить выделение водорода:
H+ + e = 1/2 H2.
Потенциал водородного электрода, помещенного в раствор щелочи,
при РН2 |
= 1 атм равен ϕ |
+ / H , Pt |
= 0,059lgaщ |
, |
||
|
|
H |
H+ |
|
||
где ащ |
|
|
2 |
|
|
|
+ |
активность ионов Н+ |
в растворе щелочи. Активности ионов Н+ в |
||||
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
растворе щелочи очень мала, поэтому ее выражают через активность ионов
гидроксила и ионное произведение воды |
aщ |
|
= |
|
Kw |
, где |
|
+ |
|
щ |
|
||||
|
H |
|
a |
− |
|
||
|
|
|
OH |
|
|||
|
|
|
|
|
|
||
aщ − активность ионов ОН− в растворе щелочи. Следовательно, потенциал
OH
электрода, находящегося в щелочи, примет вид:
|
|
|
ϕH+ / |
|
, Pt = 0,059lg |
Kw |
|
, |
|||
|
|
|
H |
aщ |
|
||||||
а для электрода в кислоте – |
|
2 |
|
|
ОН− |
||||||
|
|
|
= 0,059lg aK |
|
|
|
|||||
|
|
|
ϕ |
+ |
|
|
+ |
, |
|
||
|
|
|
H |
/ H |
2 |
, Pt |
H |
|
|
||
|
|
|
|
|
|
|
|||||
|
aK |
|
|
|
|
|
|
|
|
|
|
где |
+ |
- активность ионов |
|
водорода |
в растворе кислоты. Тогда |
||||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электродвижущая сила такого элемента выразится уравнением:
|
aK |
aщ |
|
E = 0,059 lg |
H+ |
OH− |
|
Kw |
|||
|
|||
Электродвижущую силу Е вычисляют из опытных данных - на основе измерения ЭДС двух элементов, состоящих из водородного и хлорсеребряного электродов, по сути используется концентрационный водородный элемент без переноса ионов:
Pt, H2 | KOH || KCl | AgCl, Ag ; 1 элемент
Pt, H2 | HCl || KCl | AgCl, Ag . 2 элемент
ЭДС первого элемента равна: Е1 = ϕхс − 0,059 lg aHЩ+
второго: E2 = ϕxc − 0,059lgaнк+
45

Активности акН+ и ащОН- рассчитывают по концентрациям растворов кислоты и щелочи, в которые погружены электроды.
Чтобы измерить Е1 или Е2 сначала составляют элемент 1 или 2. Для этого в водородный электрод наливают раствор кислоты (или щелочи), соединяют его с хлорсеребряным электродом и подключают водородный электрод к генератору водорода Водород пропускают медленно через электролит в течение 5 – 10 мин, следя за тем, чтобы пузырьки газа омывали платиновый электрод. Затем измеряют ЭДС, не прекращая при этом подачи водорода. Измерения повторяют несколько раз с интервалом в 1-2 мин, пока не будут получены одинаковые значения ЭДС. Разность электродвижущих сил Е = Е1 – Е2 равна ЭДС водородного концентрационного элемента
Pt, H2 | KOH || HCl | H2, Pt..
|
aК |
aЩ |
|
Таким образом, Е = 0,059 lg |
H+ |
OH− |
. Из этого уравнения вычисляют |
|
|
||
|
KW |
||
ионное произведение воды.
Активности ионов Н+ и ОН− вычисляют, исходя из концентраций раствора кислоты и щелочи и коэффициентов активности:
акН+ = СНСl . γ Н+ ащОН- =СКОН . γОН− .
Коэффициенты активности находят из табл.IV.4 по рассчитанным значениям ионной силы раствора.
Таблица IV.4
Ионная сила |
0,005 |
0,01 |
|
Коэфф.активн. |
|
|
|
однозарядн. иона |
0,93 |
0,90 |
|
0,02 |
0,05 |
0,1 |
0,2 |
0,87 0,82 0,78 0,75
Для защиты работы студенту необходимо:
-записать схему концентрационного водородного элемента без переноса ионов,
-рассчитать ионную силу раствора щелочи и кислоты, определить коэффициенты активности ионов водорода и гидроксила и их активности,
-рассчитать ионное произведение воды при температуре измерения
исравнит со справочными данными,
-рассчитать ошибку эксперимента и объяснить ее источники.
46
IV.4. ОПРЕДЕЛЕНИЕ ДИФФУЗИОННОГО ПОТЕНЦИАЛА
Цель работы: Определение диффузионного потенциала и чисел переноса ионов методом ЭДС.
Реактивы: растворы НCl разной концентрации, раствор AgNO3 Оборудование: генератор водорода, хлорсеребряные электроды,
водородный электрод, иономер.
Порядок выполнения работы:
Для определения диффузионного потенциала необходимо провести измерения ЭДС двух концентрационных элементов: с переносом и без переноса ионов. Чтобы составить концентрационный элемент с переносом ионов необходимо приготовить два хлорсеребряных полуэлемента:
Cl- (a1) | AgCl, Ag
Cl- (a2) | AgCl, Ag .
Для этого в растворы соляной кислоты с различными активностями а1 и а2 добавить несколько капель раствора AgNO3, после перемешивания перелить полученные растворы в ячейки с серебряными электродами.
Из указанных двух хлорсеребряных полуэлементов составить элемент с переносом ионов
Ag, AgCl | HCl (a1) |HCl (a2) | AgCl, Ag
Соединительным раствором между этими двумя полуэлементами должен служить один из двух растворов соляной кислоты. Измерить ЭДС (Епи).этого элемента.
Для получения ЭДС аналогичного элемента без переноса ионов составить элементы I и II:
I Pt, H2 | HCl (a1) | AgCl, Ag;
II Pt, H2 | HCl (a2) | AgCl, Ag .
Общим электролитом в каждом из элементов служит соляная кислота соответствующей концентрации. Измерение ЭДС этих элементов проводится так, как описано в работе IV.3. По результатам измерений рассчитывается ЭДС элемента без переноса ионов:
Ебп = ЕI – ЕII.
Используя полученные результаты, рассчитать значения диффузионного потенциала и чисел переноса ионов Н+ и Cl-, используя уравнения, приведенные в теоретической части.
Для защиты работы необходимо:
-уметь выводить уравнение диффузионного потенциала,
-объяснить, как величина диффузионного потенциала влияет на величину ЭДС гальванического элемента, как можно уменьшить это влияние?
47
-составить схемы концентрационных элементов с переносом и без переноса ионов,
-рассчитать ЭДС составленных элементов,
-рассчитать диффузионный потенциал,
- рассчитать числа переноса ионов водорода и хлора, - показать, как числа переноса связаны с подвижностями ионов.
IV.5. ОПРЕДЕЛЕНИЕ ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ МАЛО РАСТВОРИМОЙ СОЛИ В ВОДЕ С ПОМОЩЬЮ КОНЦЕНТРАЦИОННОГО ЭЛЕМЕНТА
Цель работы: определение произведения растворимости мало растворимой соли методом ЭДС с использованием концентрационного элемента.
Реактивы: 0,1 М AgNO3, 0,1 М КХ (Х= Сl, Br, I)
Оборудование: потенциометр или иономер, серебряные электроды, химический стакан на 50 мл.
Порядок выполнения работы:
Для определения произведения растворимости используют серебряный концентрационный элемент, состоящий из двух серебряных электродов, один из которых помещают в 0,1 М раствор хорошо растворимой соли серебра AgNO3, а другой – в 0,1 М раствор КХ, насыщенный AgX:
Ag, |AgX, |
KX || AgNO3 | Ag |
а1, |
0,1М а2, 0,1М , |
где аi - активности растворов солей.
Каждый из двух электродов можно рассматривать как обратимый серебряный электрод, на котором протекает реакция:
Ag+ + e 
 Ag.
Ag.
Выражение для электродного потенциала каждого электрода:
ϕ |
Ag |
+ |
/ Ag |
= ϕ0 |
+ |
/ Ag |
+ 0,059 lg a |
Ag |
+ , |
(IV.4) |
|
|
Ag |
|
|
|
|
Потенциал галогенидосеребряного электрода может быть выражен с учетом произведения растворимости соли AgX:
a Ag+ = |
LAgX |
|
||
|
|
, |
(IV.5) |
|
a |
|
|||
|
X− |
|
||
48
ϕ |
|
= ϕ0 |
|
|
|
+ 0,059lg |
|
LAgX |
= |
|
||||
/ AgX , Ag |
/ Ag |
|
a |
|
|
|||||||||
X − |
Ag+ |
|
|
|
|
− |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
ϕAg+ / Ag + 0,059lg LAgX + 0,059 Lg |
|
|
= |
|
(IV.6) |
|||||||||
a |
X − |
|
||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
ϕ0 |
|
+ 0,059lg |
|
|
|
|
|
|
|
|
||||
/ AgX , Ag |
a |
|
|
|
|
|
|
|
|
|||||
X − |
|
|
|
|
− |
|
|
|
|
|||||
|
|
|
|
|
|
X |
|
|
|
|
||||
где |
ϕ0X− / AgX,Ag =ϕ0Ag+ / Ag +0,059lgLAgX |
(IV.7) |
||||||||||||
Электродвижущая сила рассматриваемого концентрацион-ного |
||||||||||||||
элемента равна: |
|
|
a2 |
|
|
|
|
|
|
|
|
|
|
|
|
E = 0,059 lg |
|
|
|
|
|
|
|
|
|
(IV.8) |
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
||
где а2 - активность ионов Ag+ в растворе AgNO3,
а1 - активность ионов Ag+ в растворе КХ, насыщенном AgX.
Для выполнения работы необходимо собрать гальванический элемент из двух серебряных электродов, опущенных в растворы AgNO3 и AgX. Для уменьшения диффузионного потенциала между электродами используют солевой мостик - стаканчик с насыщенным раствором KNO3.
Измерить ЭДС и результаты записать в табл.IV.6 Средние коэффициенты активности для однозарядных ионов Ag+ и NO3− в первом и втором растворах находят по табл.IV.4, по рассчитанной ионной силе раствора. Затем, используя концентрацию раствора AgNO3, находят активность ионов серебра а2. Активность ионов серебра а1 в растворе вычисляют, используя а2 и опытное значение ЭДС. Для расчета произведение растворимости LAgX рассчитывают по найденной активности ионов серебра в исследуемом растворе и активности ионов Х-, вычисленной из концентрации КХ, и коэффициента активности этого раствора.
Если соль AgX растворена в чистой воде, то ввиду отсутствия других электролитов выполняется равенство аAg+= aX-. Вследствие того, что AgX является мало растворимой солью, концентрации ионов в растворе очень малы, и можно считать, что в этих условиях коэффициенты активности близки к единице, а поэтому:
a |
Ag |
+ = C |
Ag |
+ = C, a |
X |
− = C |
X |
− = C, L |
AgX |
= C2 |
|
|
|
|
|
|
где С - концентрация растворенной соли.
49
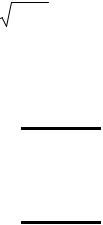
Растворимость S соли в чистой воде равна концентрации каждого из ионов:
S = CAg+ = CX− = LAgX . |
(IV.9) |
|
Таблица IV.6 |
Определение произведения растворимости мало растворимой соли
№ п/п |
Е, В |
lg a2/a1 |
a2/a1 |
|
a2 |
LAgX |
Si |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К защите работы необходимо:
-записать вывод уравнения ЭДС концентрационного элемента,
-рассчитать значения произведения растворимости всех солей, для которых проводилось измерение ЭДС,
-провести расчет произведения растворимости для этих же солей с использованием справочных данных по уравнению (IV.7),
-рассчитать относительную ошибку и объяснить ее источник.
IV.6. ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК РЕАКЦИИ, ПРОТЕКАЮЩЕЙ В ГАЛЬВАНИЧЕСКОМ ЭЛЕМЕНТЕ
Цель работы: определение термодинамических характеристик ∆H0, ∆S0 и ∆G0 реакции, протекающей в гальваническом элементе, путем изучения зависимости ЭДС от температуры.
Оборудование: гальванический элемент (задается преподавателем), ультратермостат, потенциометр или иономер, штатив.
Порядок выполнения работы:
Термодинамические характеристики химической реакции, протекающей в гальваническом элементе, ∆H°, ∆G°, ∆S°, можно получить, изучая зависимость ЭДС от температуры. Для этого воспользуемся уравнениями:
50
