
voltamper
.pdf
|
Cs |
|
|
|
~~----~---+-E |
|
СА |
|
|
||
|
|
|
|
|
|
К.Т.Т. |
|
Рис.3.1. Взаимосвязь полярографии (вольтамперометрии) и ампе
рометрического титрования
а - вольтамперограммы (полярограммы) вещества А (С1>С2>...)
б- зависимость диффузионного тока от концентрации вещества А
Вкачестве примера рассмотрим титрование вещества А с исполь
зованием реакции осаждения титрантом, который является электрохи
мически неактивным. Тогда к ячейке прилагают внешнее напряжение,
обеспечивающее потенциал микроэлектрода в области диффузионного
тока (например, Е1 на рис.3.1.,а) и добавляют титрант, измеряя величину предельного тока после добавления каждой порции титранта. Значения диффузионного тока будут уменьшаться, оставаясь каждый раз пропор
циональными концентрации вещества А в растворе до тех пор, пока ве
щество А не будет полностью осаждено. Дальнейшее добавление тит
ранта не вызовет в данном случае изменений тока. Зависимость Id от объема титранга (VT) выражается кривой, имеющей два линейных участ ка, пересекающихся в точке, соответствующей эквивалентному количе
ству реагирующих частиц.
Для амперометрического титрования используют различные типы химических реакций: осаждения, окисления-восстановления, комплексо
образо~ания. Проведение амперометрического титрования требует зна
ния электрохимических характеристик веществ, участвующих в реакции
при титровании (в том числе и продуктов реакции). Поэтому разработка методик амперометрического титрования в общем случае начинается с
получения вольтамперных кривых компонентов химической реакции. Эти кривые снимают в тех же условиях, в которых затем будут прово дить титрование (тот же индикаторный электрод, фоновый электролит, температура, рН раствора и др.).
Таким образом, для проведения амперометрического титрования
34
http://www.mitht.org/forum
следует выбрать химическую реакцию и материал электрода, сообщить этому электроду потенциал, отвечающий области предельного тока того
вещества, которое участвует в электродном процессе и концентрация
которого меняется в процессе титрования. При этом следует иметь в виду, что определяемое вещество может быть электрохимически неак
тивным, если электроактивным является титрант или продукт реакции.
Последнее выгодно отличает амлерометрическое титрование от поля рографии (вольтамперометрии).
3.2. Индикаторные электроды
В качестве индикаторных электродов при проведении амперомет
рического титрования с одним поляризованным электродом используют
чаще всего электроды двух типов: ртутный капающий и платиновый вращающиЙся. В последнее время все шире начинают использовать
микроэлектроды из углеродных материалов: графитовые, углеситалло вые и стеклоуглеродные. Для уменьшения пористости и повышения
воспроизводимости измерений графитовые элеl<ТРОДЫ пропитывают
(импрегнируют) воском, парафином, силиконовым маслом и другими
вещ~ствами, а поверхность электродов из углеситалла и стеклоуглеро
да шлифуют и полируют.
Выбор материала электрода определяется, прежде всего, тем, ка
кой электродной реакцией предполагается воспользоваться при ампе рометрическом титровании: реакцией электродного окисления или вос
становления.
Амперометрическое титрование наиболее часто осуществляют в
водных растворах, в которых электродные процессы ограничены с ка
тодной стороны выделением водорода, а с анодной стороны - выделе
нием кислорода или окислением самого материала электрода. Все ос
тальные электродные реакции восстановления и окисления возможно
осуществить, если они происходят при потенциалах, имеющих промежу точное значение между потенциалами указанных выше процессов.
На платине водород выделяется при потенциалах, близких к рав
новесным. В кислых растворах выделение водорода на платине проис
ходят при потенциалах, незначительно отличающихся от нулевого зна
чения, а в щелочных - при потенциалах около -0,6 В. Выделение водо
рода на ртути происходит при более отрицательных потенциалах, чем
равновесные значения, Т.е. водород на ртути выделяется с перенапря
жением. В кислых растворах разряд ионов НзО+ начинается при потен
циалах около -1 В, а в нейтральных и щелочных выделение водорода
происходит при более отрицательных потенциалах. В анодной области
потенциалов использование ртутного электрода ограничено вследствие анодного окисления ртути.
Таким образом, платиновый электрод может быть использован
преимущественно для осуществления электродных реакций окисления
35
http://www.mitht.org/forum
неорганических и органических соединений. На платине можно таюке
проводить восстановление сильных окислителей. Ртутный капающий электрод используется, главным образом, для восстановления органи
ческих и неорганических соединений.
Наглядное представление о том, какой электрод целесообразно
выбрать для той или иной электродной реакции, дают вольтамперные
кривые. На рис.З.2. приведены вольтамперные кривые для 1 М раствора серной кислоты, снятые на ртутном капающем, вращающемся платино
вом и импрегнированном графитовом электродах.
з 1
-0,5 -1,0
1
IAН.
РИС.З.2. Вольтамперные кривые выделения водорода (катодная
область) и кислорода (анодная область) на ртутном капающем (1), пла тиновом (2) и графитовом (3) электродах в 1 М растворе серной кисло
ты.
При графическом изображении волыамперных кривых принято ве
личины катодного тока откладывать на положительной ветви ординаты
(вверх), а величины анодного тока - на отрицательной ветви (вниз). От
рицательные значения потенциала электрода, откладываются по оси
абсцисс вправо, положительные значения - влево от нуля (на рис.2 по
тенциалы даны по отношению к потенциалу насыщенного каломельного
электрода).
Из рассмотрения приведенных на рис.З.2. данных видно, что на
ртутном капающем электроде возможно осуществлять преимуществен
но катодные процессы в области ОТРИU::lтельных значений потенциала.
На платиновом электроде возможны катодные процессы при положи
тельных значениях потенциала и анодные процессы в той же области
потенциалов.
36
http://www.mitht.org/forum
Графитовый электрод может ИСГlOльзоваться Kal( для проведения
процессов анодного окисления, так и процессов катодного восстановле
ния. Следовательно, эти электроды не заменяют, а взаимно дополняют друг друга. Их использование позволяет значительно расширить диапа
зон потенциалов, при которых можно проводить амперометрическое
титрование.
Для того чтобы осуществить амперомеТРИ'lеское титроваllие, ос
нованное на той или иной электрохимической решщии, следует, прежде всего, установить, к I{акой области потенциалов - положителыюй или
отрицательной относится данная реакция. В соответствии с областью
потенциалов следует выбрать материал ИНДИI{~ПОРНОГО электрода
(ртуть, платина или графит), а затем установить потенциал, при котором необходимо проводить титроваl-tие.
3.3. Выбор потенциала ИIIДИI(аторного электрода.
Амперометрическое ТИ1рооание следует проводить при потенциа ле ИНДИI{аторного электрода соответствующем области предельного (диффузионного) TOI(a элеl<троактивного компонента. В общем случае
потенциал индикаторного электрода выбирают по ЭI(сперименталыю по
лучеl-tliЫМ волыампеР~IЫМ I<РИВЫМ для всех элеl<троактивных веществ
даlitlой реакции.
Если ппрование предгюлагается осуществлять с ртутным капаю
щим электродом, то для выбора потенциала элеl<трода можно восполь зоваться таблицами потенциалов полуволн. Значения потенциалов по
луволн не соответствуют области предельного (диффузионного) TOI<a, поэтому для устаl-tовления необходимого потен, "1С1ла следует выбрать его веЛИЧИIlУ на O,2-0,~ В отрицательнее, чем указанный в таблице
потенциал гюлуволны. При этом следует учитывать состав исследуемо
го раствора (наличие примесей, рН и др.), Т.К. при выбранном по те~fЦиале может происходить элеl<тродная реаlЩИЯ I<акой-либо примеси,
ионов ГИДРОКСОIIИЯ или молекул воды.
При использовании вращающихся тверды x ИlIдикаторных электро
дов потеliЦиал электрода выбирают экспериментально.
Рассмотрим, какие фаl<ТОРЫ будут влиять на величину измеряе мого в процессе титрования диффузионного тока (Id = КС).
Выражение для I<оэффициента пропорциональности '(зависит от того, на каком индикаторном электроде измеряется диффузионный ток -
на ртутном капающем или твердом вращающемся.
При ИСГlOльзовании ртутного капающего элег<трода величина сред него диффузионного тока определяется известным уравнеltием Илько
вича:
Id=605л-о1l2m2J30t1/6с,
где n - число электронов, участвующих в электродной реаtщии; D - коэффициент диффузии;
37
http://www.mitht.org/forum
m - масса ртути, вытекающей в единицу времени;
т - период капания.
При работе с платиновым вращающимся электродом коэффициент К достаточно хорошо описывается следующим выражением:
n·S·D·F
К= о '
где S - площадь электрода,
о - толщина диффузионного слоя,
F - постоянная Фарадея (в уравнении Ильковича эта постоян
ная учтена в числовом множителе).
Таким образом, величина предельного (диффузионного) тока при использовании указанных индикаторных электродов будет определяться
следующими факторами: концентрацией электроактивного вещества С,
его коэффициентом диффузии О, величиной поверхности электрода S
или характеристикой капилляра m2/з.т1I6, а также числом электронов п.
Отсюда следует, что для получения воспроизводимых результатов из
мерений при титровании необходимо, чтобы температура существенно
не изменялась, а состав и концентрация фона были более или менее постоянными. В случае твердых электродов, кроме того, следует под держивать постоянной скорость вращения этих электродов. Установле но, что при скорости вращения 600-800 об/мин толщина диффузионного слоя <3 имеет практически постоянное значение.
3.4. Форма кривых титрования
Форма кривых амперометрического титрования зависит от потен
циала индикаторного электрода, а также от того, какие участники хими
ческой реакции проявляют электрохимическую активность.
Представим химическую реакции в общем виде:
А+В ~C,
где А - определяемое (титруемое) вещество, В - титрант , С - про
ду", реакции.
Взаимосвязь между ВQльтамперными кривыми, потенциалом инди
каторного электрода и возможными кривыми титрования приведены на
рис.3.3.
Если на электроде электрохимически реагирует определяемое ве
щество, а титрант и продукт реакции электрохимически неаl<ТИВНЫ, то с
самого начала будет измеряться предельный ток, который в процессе
титрования уменьшается вследствие понижения концентрации опреде
ляемого вещества. В таком случае кривая титрования будет иметь вид, изображенный на рис.3,а. Вблизи конечной точки титрования (к.т.т.) кри
вая имеет характерный криволинейный изгиб, наличие которого объяс
няется обратимостью химической реакции. Чаще всего такой "размы тый" вид кривой амперометричеокого титрования наблюдается в случае
38
http://www.mitht.org/forum
реакций осаждения (неполное связывание определяемого вещества вследствие некоторой растворимости осадка) и.комплексообразования
(образование не очень прочного комплекса). Подобное явление наблю
дается и при получении кривых амперометрического титрования других
типов. Конечную точку титрования находят как точку пересечеl-!ИЯ ли
нейных участков кривой титрования.
Титрование, представлеНtlое кривой рис.З.З.,а, называlOТ титрова нием по току определяемого вещества. Примером .этого типа титрования является титрование ио~юв свинца (11) сульфатили оксалат-ионами с
ртутным капающим электродом и титрова~lие ИОДI1Д-ИОНОВ иодатом ка
лия с использованием вращающегося платинового электрода (по току окислеllИЯ иодида).
Когда необходимо оттитровать амперометрически вещество, кото
рое не восстанавливается и не окисляется в доступной области по тенциалов (для выбранного индикаторного электрода), то следует ис
пользовать титрант, обладающий этой способностыо. Тогда кривая тит рования будет иметь форму, приведенную на рис.З.З.,б. До тех пор пока
титраllТ будет расходоваться на взаимодействие с определяемым ве
ществом, регистрируемый ток не будет меllЯТЬСЯ (остаточный ток). По
сле завершения химической реакции и появления изБЫТl(а титра~па он
будет реагировать на электроде, вызывая увеличение тока. ПР~lмером
может служить титрование ~1OHOB маn-tия (11) или бериллия (11) раствором
оксихинолина на ртутном капающем электроде при -1,6 В. Титрование
указанного типа называют амrlерометрическим титрованием по току тит
ранта. Оно наиболее удобно и часто используется в аналитической
практике.
39
http://www.mitht.org/forum
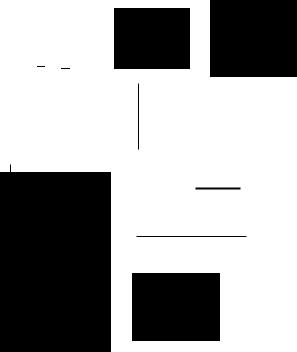
11~11
IДAf(ГвВP;
l1JLiLr.. .~ '-Е
Е1 Е2
I
Е1
'пр. |
2 |
|
I пр. |
|
|||
|
|
|
|
К.Т.Т. Vтит.
::J
К'Т.Т. Vтит.
t'пр. д)
VI
К.Т.Т. Vтит.
I Пр.кат. г)
·Е |
Vтит. |
I анод. |
I Пр.аноД. |
Рис.3.З. Взаимосвязь между вольтамперными кривыми и кривыми
амперометрического титрования с одним поляризованным электродом:
1- волыамперные кривые компонентов реакции; 2- кривые амперометрического титрования (Е1, Е2 - потенциалы
индикаторного электрода)
Кривые титрования иной формы получаются, если при выбранном
потенциале на индикаторном электроде реагируют. как определяемое
вещество, так и титрант. При этом возможны два случая.
1. Определяемое вещество и титрант дают однородную электрод ную реакцию, Т.е. при за;Цанном значении потенциала электрода оба
окисляются или восстанавливаются на электроде. Кривая титрования в
этом случае характеризуется уменьшением диффузионного тока с само го начала титрования. Величина тока достигает минимального значения в конечной точке титрования, а затем возрастает после добавления из
бытка титранта (рис.З.З.;в). Такая кривая получается, например, при ам
перометрическом титровании ионов свинца (11) раствором хромата калия
40
http://www.mitht.org/forum
с ртутным капающим элеl<ТРОДОМ при потеllциале -1 В (OTII. нас.I<.э.). В этом случае на индикаторной электроде будут восстанавливаться I<al<
ионы свинца, так и хромат-ионы.
2.ПРИ выбранном потенциале электрода определяемое вещество
ититрант дают разнородные электродные реаlЩИИ, Т.е. одно из них lIa
электроде окисляется, а другое восстанавливается. Как и в первом слу
чае, ток в начале титрования будет уменьшаться, достигая в конеч~юй точке титрования нулевого Зllачения. После добавления избытка тит ранта начинается возr<1СТ8tlие тока обратного направления. Кривая тит
рования вещеСl ва, способного к электродному восстановлению, титран
том, дающим электродную реакцию окисления, приведена на рис. 3.3., г. Рекомендуем самостоятелыю рассмотреть случай титрования С"'цест
ва, окисллющегося на электроде, титрантом, способным к электрощюму
восстановлению.
Встречаются и случаи амперометрического титрования, в которых
за ходом процесса следят по TOI<y разряда продуктов гомогенной peal<-
ции. Таким приемом, например, можно титровать МЫШЬЯК (V) иодидом
калия в кислой среде с платиновым вращающимся электродом при по
тенциале восстановления свободного иода, образующегося в ходе хи мической реаlЩИИ. В этом случае ток будет возрастать в ходе тит рования до достижеllИЯ l<онеЧIIОЙ точки титрования, оставаясь в даль
нейшем практически ПОСТОЯНIIЫМ (рис.3.3., д).
Заслуживает внимания использование "полярографичеСI<ОГО инди
катора" в амперометрическом титровании. Этот прием заключается в
том, что l<Онечная точка титрования устанавливается по ИЗМСIIСIIИЮ
диффузионного ТОI<Э электрохимически активного вещества (И~lДикато ра), специально добавляемого к анализируемому раствору. Это вещест
во должно, реагировать с титрантом после того, Kal< завершится реакция
с определяемьiм веществом. Использование Tal(OrO способа позволяет
проводить титроваllие неэлеl<Троаl<ТИВНЫХ веществ титрантами, таlOке не
способными к элеl<ТРОДНЫМ реакциям. НаГ1ример, ионы алюминия (111)
можно титровать фторид-ионами с платиновым вращающимся электро
дом в присутствии ионов железа (111), играющих роль ИНДИI{аторного ве
щества. В процессе титрования сначала связываются ионы алюминия,
фторидные комплеl(СЫ которого значительно устойчивее фторидных
комплексов железа (111). После того как ионы алюминия будут практиче СI<И полностыо связаны фторид-ионами, начнется образоваllие фторид
ных l<омплеl<СОВ железа (111), что вызовет уменьшеllие тока восстановле ния железа (111). Предлагаем самостоятельно начертить возможную кри
вую титрования.
При наЛ~1ЧИИ в исследуемом растворе нескольких веществ в ряде
случаев модно flОЛУЧИТЬ l<рИВУЮ титрования, по которой определяют ка
ждый компонеllТ смеси. Предположим, что в аllализируемом растворе
находятся два l<омпOtlента, последовательно реагирующих с титрантом.
Если электроактивным является только один из них, а таюке титрант, то
41
http://www.mitht.org/forum
получится кривая амперометрического титрования, по которой можно
определить оба компонента. Предлагаем самостоятельно начертить
возможные кривые титрования для данного случая.
3.5. Области использования
Характерной особенностью амперометрического титрования явля ется то, что при простом аппаратурном оформлении этот метод позво
ляет проводить определения в весьма разбавленных растворах. Нижняя
граница определяемых концентраций составляет 10·5моль/л. Обычно
амперометрически титруют пробы, содержащие 0,01 - 1 мг определяе мого вещества. Относительное стандартное отклонение большинства методик составляет 0,01 - 0,03. Этот метод, подобно потенциометриче
скому и кондуктометрическому титрованию, можно использовать для
анализа мутных и окрашенных растворов. При этом амперометрический метод значительно более чувствителен, чем указанные методы.
Среди достоинств амперометрического титрования следует таюке
отметить возможность определения различных веществ, в том числе и
неэлектроактивных. В последнее время этот метод все шире исполь
зуется для определения различных неорганических и органических ве
ществ (аминов, амидов, карбонильных и серусодержащих веществ, по лисахаридов и др.). Амперометрическое титрование примеН51ется в ана лизе минерального сырья и продуктов его переработки, природных и
промышленных растворов, фармацевтических препаратов,. продуктов и
полупродуктов органического синтеза, полимеров и др.
42
http://www.mitht.org/forum
