
- •Кафедра «Моделирование систем и информационные технологии»
- •Москва 2005
- •Введение
- •Электродные потенциалы
- •2. Гальванические элементы
- •3. Электролиз. Различие гальванического элемента и электролизера
- •4. Электролиз в водном растворе
- •5. Экспериментальная часть
- •5.1. Сравнение химической активности различных металлов
- •5.2. Гальванический элемент. Электролизер
- •Поместить в 2 пробирки по грануле металла
- •Литература
2. Гальванические элементы
Если два различных металла погрузить в раствор электролита, то между ними возникает электрическое напряжение (разность потенциалов) из-за различной способности отдавать катионы в раствор. Такая система:
Металл 1 раствор электролитаМеталл 2
называется гальваническим элементомилигальванической цепью. Если оба металла соединены металлическим проводником, то электроны будут перемещаться от менее благородного металла (с меньшим значением Е0) к более благородному металлу (с большим значением Е0). При этом в растворе электролита катионы будут двигаться к благородному металлу и разряжаться под действием имеющихся на нем электронов.
Электрохимические процессы, лежащие в основе действия гальванических элементов:
|
Неблагородный металл |
Благородный металл |
|
Окисление (отдача электронов, образование катионов) |
Восстановление (прием электронов, разрядка катионов) |
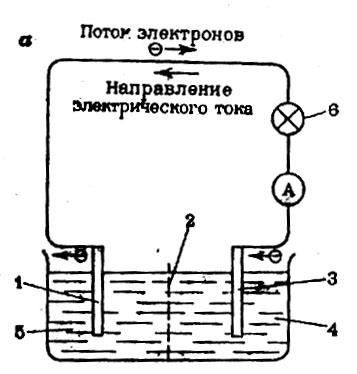
Пример.Гальванический элемент Даниэля-Якоби (рис. 2) состоит из цинкового электрода – цинковая пластина, погруженная в раствор сульфата цинка, – и медного электрода – медная пластина, погруженная в раствор сульфата меди:
ZnZnSO4 CuSO4Cu
Т
Рис. 2
Гальванический
элемент Даниэля-Якоби: 1 – цинковая
пластина; 2 – диафрагма;
3 – медная пластина;
4 – раствор
5 – раствор
6 – лампа накаливания![]() ;
;![]() ;
;
Металл 1 раствор электролита 1раствор электролита 2Металл 2
При замыкании цепи в этом элементе протекают следующие электродные процессы:
Zn0 - 2e-=Zn2+ (окисление); Е0 = -0,76 В.
Cu2++ 2e-=Cu0 (восстановление); Е0 = +0,34 В.
Cуммарная окислительно-восстановительная реакция:
Zn0 +Cu2+ =Zn2+ +Cu0
Каждый гальванический элемент состоит из двух электродов, один из которых поставляет электроны в гальваническую цепь, а другой их принимает. При этом на одном электроде возникает избыток электронов (в приведенном примере – на цинке), на другом – недостаток электронов (на меди).
Электрод с избытком электронов, металл которого имеет меньшее значение потенциала, называют отрицательным полюсомгальванического элемента илианодом, а электрод с недостатком электронов, металл которого имеет большее значение потенциала, –положительным полюсом, иликатодом (в элементе Даниэля-Якоби это соответственно цинковый и медный электроды).
Отрицательным полюсом гальванического элемента является менее благородный металл, на котором имеется избыток электронов.
Положительным полюсом гальванического элемента является более благородный металл, на котором имеется недостаток электронов.
Электроны по внешнему участку цепи (по металлическому проводнику) переходят от отрицательного к положительному полюсу гальванического элемента.
Напряжение, которое показывает вольтметр, подключенный к полюсам (клеммам) гальванического элемента, называется напряжением на клеммах. Это напряжение вследствие наличия внутреннего сопротивления элемента, меньше действительного напряжения, называемого электродвижущей силой, (обозначениеU). При стандартных условиях (250С, 101,3 кПа, концентрация каждого электролита 1 моль/л)
действительное напряжение гальванического элемента равно разности между стандартным потенциалом положительного полюса и стандартным потенциалом отрицательного полюса:
U= Е0пол.п- Е0отр.п
Пример. Действительное напряжение гальванического элемента Даниэля-Якоби равно:
U= Е0Cu- Е0Zn= +0,34 - (-0,76) = 1,10 В.
Напряжение гальванического элемента тем выше, чем больше отличаются между собой значения стандартного электродного потенциала.
