
- •I. Исследование углеводородов нефтИ и нефтепродуктов
- •1.1.Фракционный состав нефти
- •Результаты фракционной перегонки нефти
- •Материальный баланс фракционной перегонки нефти
- •1.2. Методы получения и химические свойства углеводородов
- •Циклические
- •Алицикли-ческие СnH2n
- •Аромати-ческие
- •1.3. Определение содержания аренов состава с8 в бензиновой фракции
- •1.4. Анализ смеси углеводородов методами газо-жидкостной хроматографии и рефрактометрии
- •1.5. Рефрактометрический метод определения содержания ароматических углеводородов в бензиновых фракциях
- •Величина df,c ароматических углеводородов бензиновых фракций
- •Значение коэффициента к
- •1.6. Количественное определение олефинов в нефтепродукте методом иодных чисел по Маргошесу
- •1.7. Количественное определение олефинов в нефтепродукте на основе реакции бромирования
- •1.8. Определение группового состава бензиновой фракции
- •1.Определение анилиновой точки методом равных объемов (гост 12329-77)
- •Массовая доля циклоалканов, % в деароматизированной бензиновой фракции в зависимости от анилиновой точки.
- •2. Удаление аренов адсорбцией на силикагеле
- •1.9. Структурно-групповой анализ нефтей по данным инфракрасной спектроскопии
- •Характеристические полосы поглощения в ик - спектрах углеводородах
- •II. Каталитические превращения углеводородов
- •2.1. Каталитический крекинг кумола
- •2.2. Дегидрирование циклогексана в присутствии алюмо-кобальт-молибденового катализатора
- •2.3. Дегидроциклизация н-гептана над оксидными катализаторами
- •III. Анализ гетероатомных соединений нефти
- •3.1. Определение содержания общей серы в нефтях и нефтепродуктах пиролитическим ламповым методом
- •3.2.Кислородсодержащие соединения. Определение кислотного числа объемнометрическим титрованием
- •1. Свойства кислородсодержащих соединений Опыт 1. Обpазование и гидpолиз алкоголятов
- •Опыт 2. Окисление этилового спиpта хpомовой смесью
- •2. Определение кислотного числа методом объемно-метрического титрования
- •3.3. Определение кислотного числа потенциометрическим методом на приборе «Ионометр и-135»
- •IV. Исследование нефтяных дисперсных систем
- •4.1. Определение дисперсности ндс методом турбидиметрии
- •4.2. Определение кинетической устойчивости асфальтеносодержащих нефтяных систем
- •Коэффициенты Стьюдента t при различном числе измерений n в различной надежности α.
- •4.3. Деэмульсация водонефтяной эмульсии термохимическим путем
- •Исходные данные для оценки коэффициента эффективности деэмульгатора (Кд)
- •119991, Москва, Ленинский проспект, 65
1.2. Методы получения и химические свойства углеводородов
Углеводороды – это органические соединения, молекулы которых состоят только из атомов углерода и водорода. Существует несколько типов такого рода соединений в зависимости от того, как соединены между собой атомы углерода. Они делятся на соединения с открытой цепью или ациклические, и соединения с замкнутой цепью или циклические.
Углеводороды СхНу


Алифатические
(ациклические)Циклические


Алканы СnH2n+2
Алицикли-ческие СnH2n
Алкены
СnH2n
СnH2n-6
Аромати-ческие




Алкины СnH2n-2
Алкадиены
СnH2n-2

*Выделены углеводороды, встречающиеся в нефти.
Ряд углеводородов, объединенных общей молекулярной формулой, имеющих схожие строение и химические свойства, но отличающихся на одну или несколько групп –СН2- называется гомологическим рядом.
Углеводороды с открытой цепью или ациклические углеводороды, в которых все связи углерод-углерод простые (одинарные: С-С), носят название алканов (насыщенных или парафиновых углеводородов). Они имеют общую формулу СnH2n+2 и характеризуются химической инертностью, т.е. не вступают в реакции при обычных условиях. Основной тип реакций – замещение.
Другие типы гомологических рядов ациклических углеводородов - это алкены, алкадиены и алкины. Алкены (этиленовые углеводороды или олефины), соединения в молекуле которых помимо простых связей С-С имеются двойные углерод-углеродные связи С=С. Общая формула этого гомологического ряда СnH2n. Алкины (ацетиленовые углеводороды) – это углеводороды, в молекулах которых имеется тройная связь между атомами углерода С≡C. Oбщая формула гомологического ряда ацетиленовых углеводородов СnH2n-2. В молекулах углеводородов может быть несколько двойных и тройных связей. Например, алкадиены - углеводороды с двумя двойными связями в молекуле, с общей формулой СnH2n-2. Алкены, алкины и алкадиены относятся к непредельным соединениям. Присутствие двойных и тройных связей в молекуле заметно влияет на химические свойства этих углеводородов, делает их химически активными. Наиболее характерны реакции присоединения.
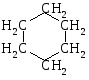
Циклические углеводороды включают два гомологических ряда: алициклический и ароматический. Углеводороды алициклического ряда содержат кольца, состоящие из углеродных атомов, связанных между собою простыми связями, как, например, в циклогексане:
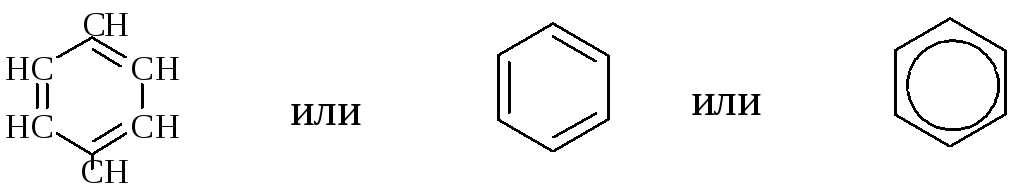
Ароматические углеводороды - соединения, имеющие в молекуле бензольное кольцо:
Химические свойства циклоалканов во-многом похожи на химические свойства алканов.
Химические свойства аренов зависят от их строения. Сам бензол химически инертный. Гомологи бензола: толуол, этилбензол и др. химически более активны.
Экспериментальная часть. Лабораторная работа №2.
Опыт 1. Получение и свойства метана
В ступке растирают одну часть ацетата натрия (CH3COONa) с двумя частями натронной извести (NaOH). Смесь пересыпают в сухую пробирку с газоотводной трубкой и нагревают сначала осторожно, а затем сильно.
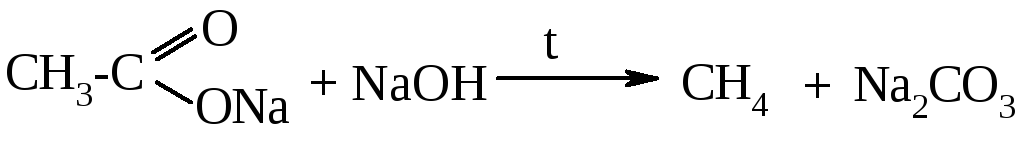
Чтобы убедиться в том, что метан трудно вступает в химические реакции, его пропускают в пробирки, наполненные раствором перманганата калия и бромной водой. Окраска растворов при этом не изменяется, так как в обычных условиях метан не окисляется и не вступает в реакции замещения.
Опыт 2. Получение и свойства этилена.
В пробирку с газоотводной трубкой помещают 1 мл этилового спирта и, осторожно взбалтывая, приливают 4 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипелку и начинают медленно и осторожно нагревать пробирку до начала равномерного выделения газа. Реакционная смесь при этом темнеет:
tо
С Н3СН2ОН
CH2=CH2
+ H2O
Н3СН2ОН
CH2=CH2
+ H2O
H2SO4
Заранее готовят две пробирки, заполненные на 2/3 объема бромной водой и раствором перманганата калия. Как только из газоотводной трубки начинает выделяться этилен, опускают поочередно газоотводную трубку в эти пробирки. Непредельный характер этилена проявляется в быстроте его бромирования и окисления. Бромная вода обесцвечивается, так как бром присоединяется к этилену:
C

 H2=CH2
+ Br2
CH2-CH2
H2=CH2
+ Br2
CH2-CH2
Br Br
При окислении этилена раствором перманганата калия образуется этиленгликоль, в результате чего также происходит обесцвечивание раствора:
C

 H2=CH2
+ H2O
+ [O] CH2-CH2
H2=CH2
+ H2O
+ [O] CH2-CH2
OH OH
Эти две реакции (обесцвечивание бромной воды и раствора перманганата калия) используют как качественные реакции, позволяющие обнаруживать непредельные углеводороды в нефтепродуктах.
Опыт 3. Сравнение свойств жидких алканов и алкенов
В качестве примера жидких парафиновых углеводородов возьмем н-гексан (СН3СН2СН2СН2СН2СН3). В качестве примера жидких алкенов возьмем гексен-1 (СН2=СН-СН2-СН2-СН2-СН3)
В две пробирки наливают по 1 мл н-гексана и н-гексена. В обе пробирки прибавляют 0,5 мл бромной воды. В первой пробирке обесцвечивания не происходит, т.е. в обычных условиях н-гексан с бромом не реагирует. Во второй пробирке наблюдается исчезновение окраски, т.е. гексен-1 прореагировал с бромом:
C

 H2=CH-CH2-CH2-CH2-CH3
+ Br2
CH2-CH-CH2-CH2-CH2-CH3
H2=CH-CH2-CH2-CH2-CH3
+ Br2
CH2-CH-CH2-CH2-CH2-CH3
Br Br
Затем, готовят опять две пробирки с н-гексаном и гексеном и приливают по 1 мл раствора перманганата калия (KMnO4). После встряхивания содержимого пробирок отмечают, что в первой пробирке изменений не происходит, раствор не обесцвечивается, т.е. реакция не идет. Во второй пробирке характерный фиолетовый цвет исчезает, т.к. гексен реагирует с KMnO4.
Опыт 4. Получение и свойства ацетилена.
В сухую пробирку помещают кусочки карбида кальция, затем прикапывают насколько капель воды и быстро закрывают пробирку пробкой с газоотводной трубкой. В пробирке наблюдается вспенивание за счет выделения газа. Газоотводную трубку опускают в пробирки с заранее приготовленными растворами бромной воды и перманганата калия. Наблюдается обесцвечивание растворов:
![]()

 Br
Br
Br
Br
H

 C≡CH
+ Br2
HC – CH
C≡CH
+ Br2
HC – CH
Br Br
Арены
Опыт 5.
а) Бромирование бензола и толуола.
В одну пробирку помещают 1 мл бензола, в другую - 1 мл толуола. В каждую из пробирок добавляют по 1 мл бромной воды и встряхивают. Пробирки нагревают на водяной бане. Бромирование бензола в этих условиях не происходит, а толуол бромируется - происходит исчезновение окраски брома. Бромирование бензола возможно только в присутствии катализатора (железные опилки). Если в первую пробирку добавить железных опилок, встряхнуть и нагреть на водяной бане, то произойдет исчезновение окраски, следовательно, бензол бромируется.

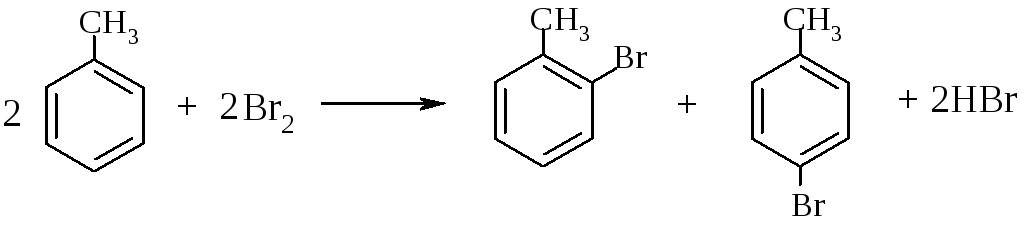
толуол орто-бром- пара-бром-
толуол толуол
В молекуле толуола к ароматическому кольцу присоединена группа -СН3. Это заместитель I-го рода, он облегчает введение следующего заместителя в ароматическое кольцо и направляет его в орто- и пара-положения.
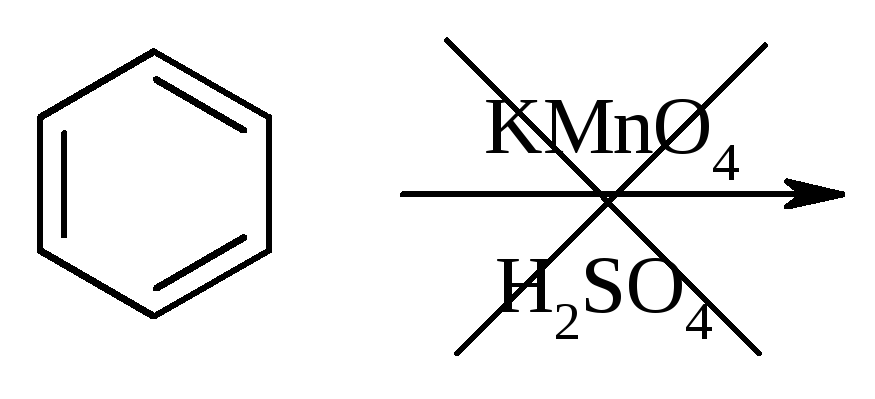
Опыт 6. Окисление ароматических углеводородов
Опыт проводят одновременно с бензолом и толуолом. В две пробирки помещают по 1 мл раствора перманганата калия и разбавленной серной кислоты, затем добавляют по 0,5 мл в одну пробирку бензола, в другую -толуола. Сильно встряхивают каждую пробирку в течение нескольких минут. Отмечают изменение окраски в пробирках.
Бензол весьма устойчив к окислению и практически не реагирует с перманганатом калия ни в кислой, ни в щелочной среде. (Если реакция идет, вероятно, бензол содержит примесь тиофена). Гомологи бензола окисляется значительно легче.
бензол
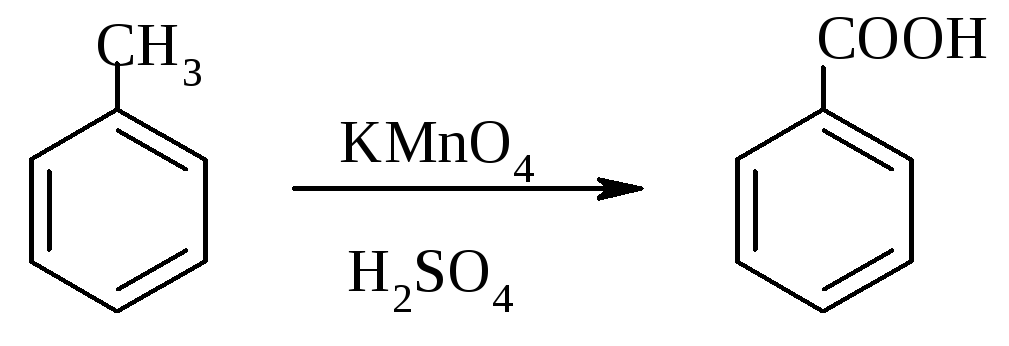
толуол бензойная кислота
Опыт 7. Нитрование нафталина
В пробирку наливают 2 мл концентрированной азотной кислоты. К азотной кислоте добавляют 0,5 г нафталина. Содержимое пробирки встряхивают и нагревают на горячей водяной бане 5 мин. Затем содержимое пробирки выливают в стаканчик с холодной водой. Образовавшийся нитронафталин выделяется в виде оранжевого масла, которое быстро затвердевает при встряхивании.
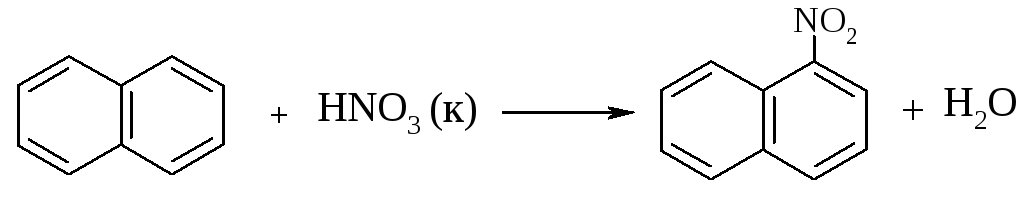
нафталин -нитронафталин
Нафталин нитруется значительно легче, чем бензол и толуол. Поэтому нитрование нафталина проводят не нитрующей смесью, а только концентрированной азотной кислотой.
Опыт 8. Качественная реакция на ароматические углеводороды (формалитовая реакция)
Ароматические углеводороды образуют с формалином в присутствии серной кислоты ярко окрашенные продукты конденсации. Это свойство используют как качественную реакцию на присутствие ароматических углеводородов в нефтепродуктах.
В фарфоровую чашечку капают 6-8 капель концентрированной серной кислоты, затем прибавляют 3-4 капли формалина и 2-3 капли исследуемого вещества. При отсутствии ароматических углеводородов смесь остается бесцветной. Появление яркого красно-бурого окрашивания свидетельствует о наличии ароматических углеводородов в испытуемом продукте.
Меры безопасности
1. При выполнении опытов необходимо соблюдать правила противо-пожарной безопасности. Поскольку все органические вещества горючи, то при работе с ними надо соблюдать особую осторожность. Открытый конец нагреваемой пробирки не должен попадать в зону горелки.
2. Необходимо соблюдать осторожность при работе с концентрированными кислотами (опыты 2,7,8). Не допускать пролива кислот, попадания кислот на кожу.
3. Многие низкомолекуклярные углеводороды являются легколетучими соединениями, поэтому при выполнении опытов 3,5,6 следует брать строго рекомендованное количество углеводородов, не подносить к носу и не вдыхать пары углеводородов.
Контрольные вопросы
1. Какие гомологические ряды образуют углеводороды и каковы отличительные черты каждого из гомологических рядов.
2. Углеводороды каких гомологических рядов встречаются в нефтях?
3. Какие ряды углеводородов отличаются наибольшей химической активностью, с чем это связано? Какой тип реакций характерен для них?
4. Какие качественные реакции используются для выявления алканов, алкенов, алкинов, аренов?
5. Почему алкилзамещенные арены более химически активны, чем бензол?
