
- •1. Электрохимия
- •1.1. Гальванические элементы
- •1.2. Механизм возникновения э.Д.С.
- •Определение величины электродного потенциала
- •2. Поверхностные явления и дисперсные системы
- •2.1. Поверхностные явления и адсорбция
- •Измерение поверхностного натяжения на границе раздела жидкость/жидкость
- •Обработка полученных результатов
- •2.2. Пены. Получение и свойства
- •2.3. Эмульсии и их свойства
- •2.4. Мицеллярные растворы iiab
- •2.5. Вязкость дисперсных систем.Структурная вязкость
- •2.6. Электрические свойства дисперсных систем
- •2.7. Седиментационный анализ суспензий и эмульсий
- •Практикум по курсу “Физическая и коллоидная химия”
- •Отдел оперативной полиграфии издательства *Нефть и газ"
- •11991 Гсп-1 Ленинский проспект, д.65
ВВЕДЕНИЕ
Практикум по курсу "Физическая и коллоидная химия" является вторым изданием, переработанным и дополненным. Наиболее глубоким изменениям подверглись такие сложные разделы практикума, как "Электрохимия", "Поверхностные явления и адсорбция", "Электрокинетические явления в дисперсных системах", в другие разделы практикума внесены менее значительные изменения и дополнения.
В каждом разделе практикума перед описанием лабораторной работы приводится теоретическое введение, которое, на наш взгляд, позволит студенту лучше понять закономерности, получаемые им в ходе лабораторных работ.
Кроме основных теоретических положений в каждом разделе данного практикума указываются области практического применения изучаемых явлений и законов в нефтяной промышленности.
В качестве объектов исследования в лабораторных работах, выполняемых в лабораторном практикуме, студентам предлагается использовать реагенты и вещества, применяемые в нефтепромысловом деле.
В конце практикума приводится приложение, которое включает сведения справочного характера, и список учебной литературы, необходимой для более полного усвоения изучаемого курса.
1. Электрохимия
1.1. Гальванические элементы
При соприкосновении двух проводников, различающихся физическими или химическими свойствами, на границе раздела между ними возникает скачок потенциала, который равен разности потенциалов проводников:
![]() ,
,
![]() ,
… (1.1)
,
… (1.1)
Если составить цепь из нескольких соприкасающихся проводников, то скачки потенциалов возникнут на всех границах раздела и сумма их составит электродвижущую силу (э.д.с.) цепи:
![]() . (1.2)
. (1.2)
Из соотношений (1.1) и (1.2) вытекает, что э.д.с. цепи равна разности потенциалов между последним и первым проводниками, входящими в цепь:
![]() . (1.3)
. (1.3)
При замыкании правильно разомкнутой цепи (первый и последний проводник из одного и того же металла), состоящей только из металлов, в цепи ток не возникает; э.д.с. таких цепей равна нулю. Если хотя бы один из проводников, входящих в цепь, представляет собой электролит, то э.д.с. такой правильно разомкнутой цепи отличается от нуля; при замыкании такой цепи на границе соприкосновения металлов и электролитов протекают химические реакции и в цепи возникает электрический ток. Цепи, которые состоят из металлических проводников и электролитов, называются гальваническими. Часть гальванической цепи, состоящая из электролита и двух погруженных в него металлических электродов, называется гальваническим элементом.
1.2. Механизм возникновения э.Д.С.
Э.д.с. гальванической цепи складывается из скачков потенциалов, возникающих на границе соприкосновения двух металлов (контактных потенциалов), скачков потенциалов, возникающих на границе соприкосновения металла с раствором электролита (электродных потенциалов), скачков потенциалов, возникающих на границе соприкосновения двух растворов электролитов (диффузионных потенциалов). Механизм возникновения скачков потенциалов различен.
Контактные потенциалы. Свободные электроны могут выходить из металла, это приводит к возникновению на поверхности металла положительного потенциала. Величина этого потенциала зависит от природы металла. Это одна из причин возникновения скачка потенциала на границе соприкосновения двух металлов. Скачок потенциала на границе двух металлов возникает также за счет перехода свободных электронов из одного металла в другой. Так как энергетические уровни электронов в металлах не одинаковы, то из того металла, где этот уровень выше, большее количество электронов будет переходить в другой металл, где этот уровень ниже, чем в обратном направлении за то же самое время. Направленный процесс перехода прекратится, когда энергетические уровни электронов в обоих металлах выровняются. При этом металл, из которого преимущественно выходили электроны, зарядится положительно, а другой - отрицательно. Контактные потенциалы обычно малы и при измерении э.д.с. гальванических элементов их можно не учитывать.
Электродные потенциалы. Возникновение электродных потенциалов обусловлено физико-химическими процессами, протекающими на границе соприкосновения металла с электролитом.
При погружении металла в раствор его соли ионы, находящиеся на поверхности кристаллической решетки металла, гидратируются сильно полярными молекулами воды. Силы их взаимодействия с остальными ионами кристаллической решетки уменьшаются, и часть ионов, которые обладают достаточно большой кинетической энергией теплового движения, переходит в раствор. Одновременно происходит обратный процесс перехода ионов из раствора на поверхность металла. Если скорость перехода ионов в раствор больше, чем скорость перехода ионов из раствора на металл, то поверхность металла заряжается отрицательно за счет избыточных электронов. Возникает электростатическое притяжение между электронами металла и ионами, перешедшими в раствор. Скорость перехода ионов в раствор уменьшается, а скорость перехода ионов на металл увеличивается. Обе скорости выравниваются и устанавливается подвижное равновесие. На границе раздела металл-раствор образуется двойной электрический слой и возникает определенный скачок потенциала (рис. 1).

Рис. 1 Рис. 2
Если начальная скорость перехода ионов из раствора на металл больше скорости перехода ионов с металла в раствор, металл заряжается положительно, а раствор у поверхности металла отрицательно (рис. 2) за счет избытка анионов. Вследствие электростатического взаимодействия уменьшается скорость перехода конов из раствора на металл и увеличивается скорость обратного процесса. Обе скорости выравниваются, устанавливается подвижное равновесие. На границе металл-раствор образуется двойной электрический слой и возникает скачок потенциала.
Электродные потенциалы определяют э.д.с. гальванического элемента.
Диффузионные потенциалы. Диффузионный потенциал возникает на границе раздела между двумя растворами различных электролитов или растворами одного электролита различной концентрации.
При соприкосновении двух растворов одного и того же электролита различной концентрации ионы переходят из одного раствора в другой. Причем ионы из более концентрированного раствора будут переходить в менее концентрированный раствор быстрее, чем в обратном направлении. Так как подвижность катионов и анионов различна, то и количество их, проходящее в начале диффузии через границу раздела растворов, будет различно. Если подвижность катионов больше, то их больше перейдет через границу раздела в менее концентрированный раствор, чем анионов. Тогда менее концентрированный раствор у границы раздела зарядится положительно, а более концентри-рованный - отрицательно. На границе раздела растворов возникнет скачок потенциала, который называется диффузионным потенциалом. Диффузионный потенциал на границе двух растворов приводит к уменьшению скорости перемещения катионов и увеличению скорости движения анионов, Через некоторое время скорости движения катионов и анионов через границу раздела выравниваются. Количества катионов и анионов, пересекающих границу раздела в единицу времени, станут одинаковыми,
Диффузионные потенциалы невелики; их величина не превышает нескольких сотых долей вольта. Точно измерить величину диффузионного потенциала трудно, так как она зависит не только от состава и концентрации соприкасающихся растворов, но и от других причин. Поэтому при измерениях э.д.с. необходимо исключить диффузионный потенциал, Это достигается введением солевого мостика, соединяющего растворы электролитов. Солевой мост состоит из концентрированного раствора соли, ионы которой обладают одинаковой или близкой подвижностью (KCl, NН4NО3).
Возникновение тока в гальванических элементах. Скачки потенциалов на границе металл-раствор возникают и принимают разновесное значение через очень короткий промежуток времени. При замыкании цепи гальванического элемента электроны от более отрицательного электрода потекут по соединительному проводу к электроду, имеющему белее положительный электродный потенциал, Как только количество электронов на первом электроде начнет уменьшаться, нарушится равновесие в двойном электрическом слое и катионы с первого электрода станут переходить в раствор. Электроны, подойдя ко второму электроду, вызывают нарушение равновесия в двойном электрическом слое, что приводит к восстановлению катионов, находящихся вблизи электрода, до нейтральных атомов. Таким образом, происходит непрерывное растворение одного электрода и выделение металла на другом электроде; одновременно во внешней цепи текут электроны, в растворе электрический ток переносятся анионами, и гальванический элемент непрерывно дает ток.
Термодинамика обратимых гальванических элементов. Максимальная величина электрической энергии, которая может быть получена от гальванического элемента, эквивалентна полезной максимальной работе протекающего в нем процесса;
nFE = -G, (1.4)
или
![]() , (1.5)
, (1.5)
где Е - электродвижущая сила (э.д.с.), то есть разность потенциалов на концах равновесной электрохимической цепи;
G - максимальная полезная работа процесса;
n - число электродов, принимающих участие в электрохимическом процессе;
F - число Фарадея, равное 96485 Кл/моль.
Если в гальваническом элементе протекает химическая реакция
А + В
![]() С + D,
С + D,
то величину ее максимальной полезной работы рассчитывает по уравнению
![]() , (1.6)
, (1.6)
где R - универсальная газовая постоянная:
Т - абсолютная температура;
Кa - константа равновесия реакции; aA, aB, aC, aD - активности веществ, участвующих в реакции.
Активность (а) связана с моляльпой концентрацией (т) следующим соотношением:
![]()
где - коэффициент активности.
Разделив обе части уравнения (1.6) на nF, получим
![]() . (1.7)
. (1.7)
Если на электроде протекает реакция
Меn + пе Me0,
то
![]() . (1.7)
. (1.7)
Так
как
![]() = const
,
то
= const
,
то
![]() , (1.8)
, (1.8)
где
![]() называется стандартным электродным
потенциалом. Стандартный электродный
потенциал - это потенциал электрода,
помещенного в раствор электролита с
активностью ионов металла
в
растворе равной 1 (
называется стандартным электродным
потенциалом. Стандартный электродный
потенциал - это потенциал электрода,
помещенного в раствор электролита с
активностью ионов металла
в
растворе равной 1 (![]() ).
).
Тогда уравнение Нернста для электродного скачка потенциала можно записать следующим образом:
![]() . (1.9)
. (1.9)
Электроды
Электроды, составляющие гальванический элемент, можно разделить на 3 вида:
1) электрода 1 рода, обратимые относительно катиона;
2) электроды 2 рода, обратимые относительно аниона;
3) окислительно-восстановительные электроды (редокс-электроды).
Поскольку мы в работе будем использовать электроды первых двух видов, рассмотрим их подробнее.
Электроды, обратимые относительно катионов.
К электродам первого рода, обратимым относительно катионов, относятся металлические электроды, погруженные в растворы своих солей, а также водородный электрод.
. Водородный электрод состоит из платиновой пластинки, на которую нанесен слой тонкодисперсной платины, наполовину погруженной в раствор, содержащий ионы водорода, и омываемый газообразным водородом. На границе раздела между электродом и раствором протекает реакция
Н+ + е 1/2 H2 .
Электродныq потенциал водородного электрода выражается уравнением:
 . (1.10)
. (1.10)
Водородный
электрод используется в
качестве
электрода сравнения для измерения
электродных потенциалов других
электродов, так как при
![]() и
и
![]() = 1 атм
его злектродный потенциал
= 1 атм
его злектродный потенциал
![]() условно
принят pавным
0 при всех температурах. Устройство
водородного электрода схематически
показано на рис. 3.
условно
принят pавным
0 при всех температурах. Устройство
водородного электрода схематически
показано на рис. 3.

Электроды, обратимые относительно аниона
К таким электродам относятся металлические электроды, покрытые малорастворимой солью соответствующего металла и пoгpуженные: в раствор другой, хорошо растворимой соли, содержащей тот же анион; примерами таких электродов могут служить каломельный электрод, хлорсеребряный и некоторые другие.
а) Каломельный электрод (рис. 4).
Этот электрод состоит из ртути, над которой находится паста из каломели (Hg2Cl2), смешанной с металлической ртутью, и раствора KCl, предварительно насыщенного каломелью. На границе раздела Нg/Hg2Cl2,КСl протекает реакция
1/2
Hg2Cl2
+
е
Нg
+
![]() .
.
Активности Hg2Cl2 и Hg постоянны, поэтому
![]() .
.
А ктивность
ионов
определяется концентрацией раствора
KCl,
и электродный потенциал каломельного
электрода зависит от концентрации
используемого раствора KCl.
Если используется насыщенный раствор
KCl,
то электрод называется насыщенным
каломельным, его электродный потенциал
при 25°С равен 0,2420 В,
температурный коэффициент –0,00076 В/град,
если используется 1 н раствор KCl,
то электрод называют нормальным,
электродный потенциал его при 25°С равен
0,2810 В,
температурный коэффициент
ктивность
ионов
определяется концентрацией раствора
KCl,
и электродный потенциал каломельного
электрода зависит от концентрации
используемого раствора KCl.
Если используется насыщенный раствор
KCl,
то электрод называется насыщенным
каломельным, его электродный потенциал
при 25°С равен 0,2420 В,
температурный коэффициент –0,00076 В/град,
если используется 1 н раствор KCl,
то электрод называют нормальным,
электродный потенциал его при 25°С равен
0,2810 В,
температурный коэффициент
–0,00025 В/град. Схема устройства каломельного электрода приведена на рис.4.

Элемент Вестона. Для измерения э.д.с. гальванических элементов в компенсационных схемах применяется в качестве эталонного элемента химический элемент Вестона. Одним из электродов элемента Вестона является 12,5%-ная амальгама кадмия, находящаяся в контакте с насыщенным водным раствором Cd.SO4. Вторым электродом служит ртуть, покрытая твердым сульфатом ртути (I) в растворе сульфата кадмия (рис. 5):
Pt, Hg – Cd | CdSO4 | Hg2SO4| Hg, Pt.
Электродвижущая сила этого элемента отличается постоянством и малым температурным коэффициентом, что позволяет использовать этот элемент в потенциометрических измерениях.

Лабораторная работа 1. ИЗМЕРЕНИЕ ЭЛЕКТРОДВИЖУЩИХ СИЛ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
В
Рис. 6. Схема
установки для измерения
э.д.с. гальванических элементов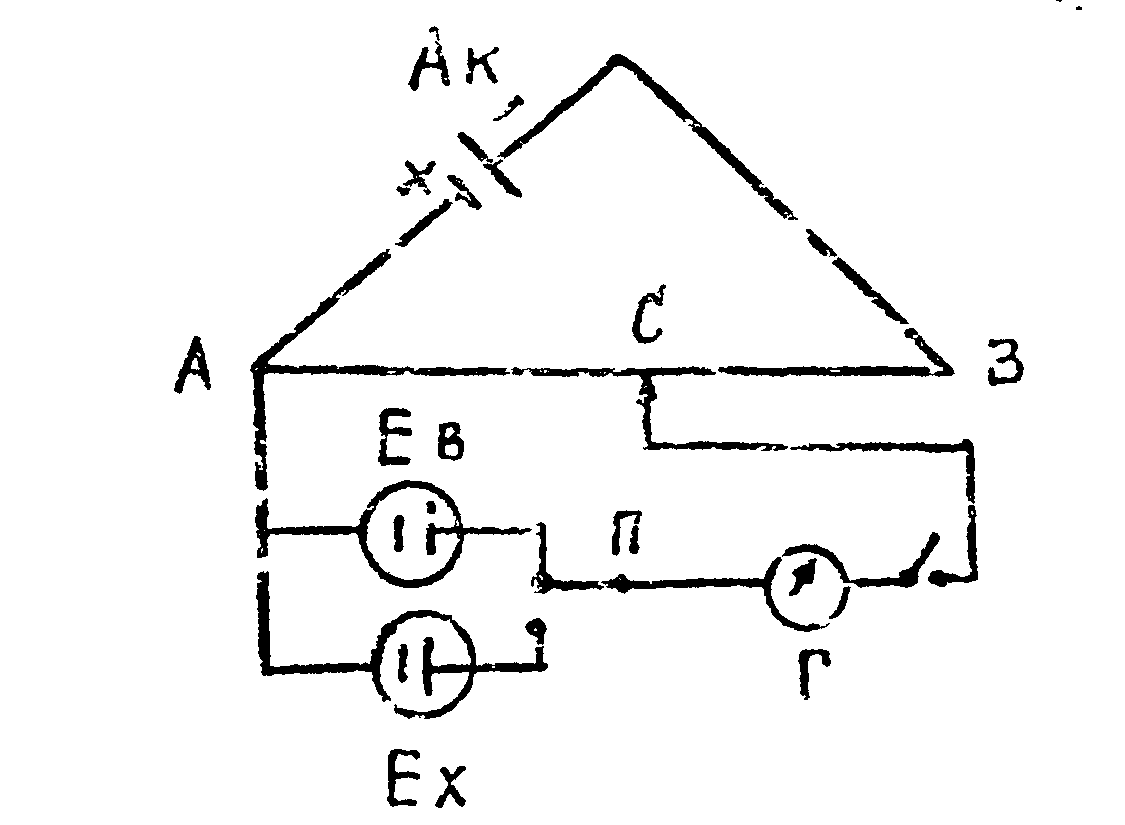
Принципиальная схема установки для измерения э.д.с. гальванических элементов показана на рис, 6. Аккумулятор (АК) подключен к концам реохорда, представляющего собой проволоку из нихрома или константана длиной 1000 мм, натянутую на барабан. С помощью переключателя П в цепь схемы можно попеременно включать либо стандартный элемент Вестона (ЕВ), либо исследуемый элемент с э.д.с., равной EX. Сначала находят точку компенсации нормального элемента Вестона, то есть определяют такое положение подвижного контакта С, при котором гальванометр (Г) покажет отсутствие тока в цепи (АК - элемент Вес тона - С). В этом случае падение напряжения аккумулятора на участке АС численно равно э.д.с. элемента Вестона. Затем переключатель П переводят в такое положение, когда он включает в цепь исследуемый элемент, и аналогично находится новая точка компенсации э.д.с. исследуемого элемента (АСI). Для первого и второго случаев можно соответственно написать:
ЕАК/АВ = ЕВ/АС (1.11)
ЕАК/АВ = ЕХ/АСI. (1/12)
Из равенств (1.11) и (1.I2) следует, что EВ/AC = EX/ACI или
![]() . (1.13)
. (1.13)
Для точных измерений э.д.с. гальванических элементов применяют специальные приборы - потенциометры, принцип действия которых основан на описанном выше компенсационном методе. Применение потенциометра упрощает проведение измерений и исключает необходимость в расчетах.
Размещение узлов на панели высокоомного потенциометра показано на рис. 7, где 1,2- зажимы для исследуемых гальваническпх элементов, 3 - зажимы для присоединения гальванометра; 4 - зажимы для подключения нормального элемента Вестона; 5 - зажимы для подключения батареи; R - ручки декадных переключателей (реохордов), с помощью которых определяется точка компенсации; r - ручки реохордов грубой и тонкой настройки потенгшометра по нормальному элементу Вэстона, 6 - ручка кулачкового переключателя для включения в цепь нормального элемента или исследуемого; 7 - температурная декада нормального элемента. Кнопки "430 кОм" и "0" служат для замыкания цепи гальванометра. При замыкании кнопки "430 кОм" вводится соответствующее сопротивление, чем ограничивается сила тока, протекающего через обмотку гальванометра. Кнопка "КЗ" служит для успокоения гальванометра. Рабочий ток потенциометра равен 0,1 А.
При использовании потенциометра Р-307 ошибка измерении э.д.с. не превышает 0,2-0,3 мВ,
Внешний вид панели высокоомного потенциометра Р-307 представлен на рис. 7.
Измерение э.д.с. с помощью потенциометра проводится в следующем порядке:
1
Рис. 7. Внешний
вид панели высокоомного потенциометра
Р-307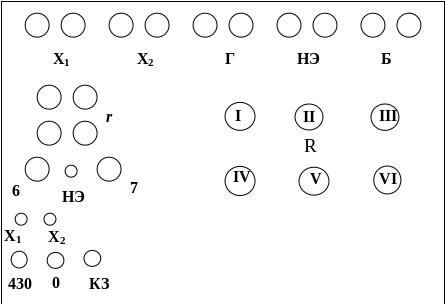
2.Устанавливают рабочий ток потенциометра, для чего переключатель температурной декады ставится в положение, соответствующее э.д.с. элемента Вестона при температype опыта.
3. Переключатель «НЭ-X1-X2» ставят в положение «НЭ» и поворотам декадных ручек "грубо" и "точно" добиваются компенсации нормального элемента. Гальванометр включают в цепь последовательным нажатием кнопок "430" при грубой компенсации и "0" при более точной.
4. Переключатель ''НЭ-Х1-Х2» ставят в положение Х1 или Х2 и поворотом ручек R декадных переключателей добиваются точной компенсации исследуемого элемента.
5. Значение измеряемой э.д.с. вычисляют суммированием произведений цифр, видных в окошках верхней панели, на множители у соответствующих декад.
6. Рабочий ток потенциометра следует периодически проверять и регулировать.
ИЗМЕРЕНИЕ ЭДС ЭЛЕМЕНТА ДАНИЭЛЯ- ЯКОБИ
Для проведения опыта составляют элемент Даниэля-Якоби, включающий 2 полуэлемента: цинковкй и медный. Составленная цепь записывается еледующд:л образом:
(-) Zn/ ZnSO4 || KCl насысщ. || СuSO4 | Сu (+).
В этом элементе протекает суммарная химическая реакция
Zn° + Сu2+ = Сu°+ Zn2+,
поэтому такая цепь называется химической.
Цепь записывается таким образом, чтобы слева был отрицательный электрод, а справа - положительный. Двойная черта (||) обозначает, что в этой цепи отсутствует диффузионный потенциал.
Внешний вид собранного элемента Даниэля-Якоби изображен на рис. 8.
К
Рис. 8. Элемент
Даниэля-Якоби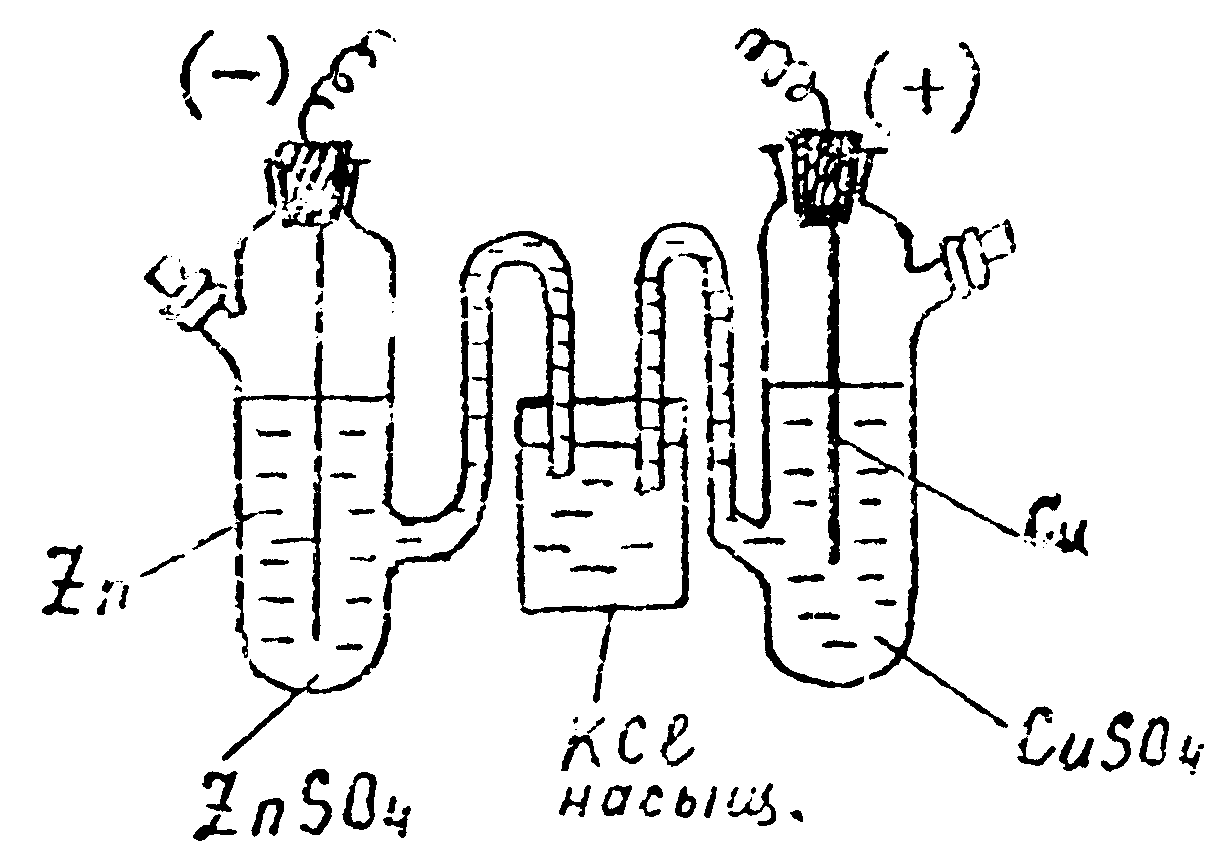
Таблица 1.
№ п/п |
Гальванический элемент |
Еизм., В |
|
1 |
(-)Zn|ZnSO4|| KClнасыщ.|| CuSO4| Cu (+) 1 н 1 н |
|
|
Полученный результат сравнивают о рассчитанным по уравнению Нернста. Коэффициенты активности ионов 6ерут из таблицы в конце практикума.
