
Молярная электропроводность растворов электролитов
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора Смолярная электропроводность связана следующим соотношением:
![]() ,
Ом-1см2моль-1
,
Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении (рис. 2, 3).
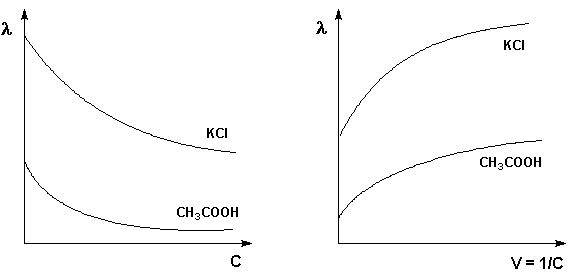
Рис. 2. Зависимость молярной Рис. 3. Зависимость молярной электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса:
![]()
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и λo является суммой молярных электропроводностей катиона и аниона λ+ и λ– (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов:
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
![]()
Подставив в это выражение уравнение Аррениуса и приняв, что при бесконечном разведении степень диссоциации α равна единице, получим:
![]()
![]()
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
Электрохимия 3. Продолжение материала, начитанного в аудитории
Работа с водородным электродом неудобна, поэтому в качестве электрода сравнения можно использовать более простые в обращении каломельный и хлорсеребряный электрод, электродные потенциалы которых известны и зависят только от температуры. Чаще всего используется насыщенный хлорсеребряный электрод. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Каломельный электрод – это ртуть, помещенная в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Нg , Нg2Сl2 / КСl
Hg2Сl2 + ē ↔ 2Hg0 + 2Сl-
![]()
В основе классификации электрохимических цепей лежат несколько принципов:
источник получения ЭДС - концентрационные и химические цепи;
наличие и отсутствие диффузионного скачка потенциала - соответственно, цепи с переносом и без переноса;
обратимость цепей - обратимые и необратимые цепи.
Химическая цепь - это гальванический элемент, состоящий из двух различных по природе электродов.
Концентрационная цепь – это гальванический элемент, состоящий из двух одинаковых по природе электродов, различающихся концентрацией окисленной или восстановленной форм а1> а2.
Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны.
Электродвижущая сила возникает за счет выравнивания концентраций электродного материала (концентрационные цепи без переноса) или концентраций электролита (концентрационные цепи с переносом).
а) Концентрационная цепь без переноса
(-)Pt,Cl2|HCl|Cl2,Pt(+)
Р(Cl2)1≠ Р(Сl2)2
б) Концентрационная цепь с переносом
(-) Ag | AgN03¦AgN03|Ag(+)
a(AgN03)1 ≠a(AgN03)2
ЭДС концентрационного гальванического элемента:
![]()
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
