
- •1.Классификация и номенклатура органических соединений
- •2)Реакции окисления
- •3)Реакция восстановлениия
- •7.1) Качаственная реакция!!!концевая 3-ая связь
- •6.Галогенпроизводные ув
- •8.Заместители бензольного кольца и их влияние на направление и скорость реакции Se:
- •9.Кислородсодержащие соединения. Спирты
- •9.1Ненасыщенные спирты:
- •10.Многоатомные спирты: гликоли
- •11.Ароматические спирты и фенолы
- •12 Альдегиды и кетоны
- •13.Карбоновые кислоты.
- •14.Углеводы
- •Моносахариды
- •15.Нитросоединения
- •Способы получения нитросоединений
- •Химические свойства
- •16. Основные химические свойства аминов.
6.Галогенпроизводные ув
Получение галогенпроизводных:
прямое галогенирование(хлорирование, бромирование)
гидрогалагенирование(HCl, HBr, HI) алкенов, диенов, алкинов.
Р-ии нуклеофильного замещения гидроксильной группы в спиртах воздействием
-галогенидов -фосфора -серы
CH3-CH(OH)-CH2-CH3

CH3-CH(Cl)-CH2-CH3


Получение ненасыщенных галогенопроизводных УВ.
СН2=СН-СН3
 CH2=CH-CH2Cl
3хлорпропен1
CH2=CH-CH2Cl
3хлорпропен1
Физические свойства:
Низшие хлориды имеют плотность<1
Бромиды и иодиды плотность>1
Нерастворимые в воде
Химические свойства:
Р-ии нуклеофильного замещения Sn
C𝛅+ →xδ- , где х=Cl, Br, I
В качестве нуклеофилов:
1.NaOH,KOH
2.RONa – алкоголяты
3.KCN – цианиды
4NaNO3- нитриты Na, K
5.RNH2 и NH3 амины и аммиак
6.RCOONa соли карбоновых к-т
Шелочной гидролиз:
CH3-CH2-CH2δ+(субстрат)→ Clδ- + Naδ+OHδ-реагент(NaCl)
→CH3-CH2-CH2-OH
RONa алкоголяты:
CH3-CH2- CH2δ+→ Clδ-+ CH3-CH2-Оδ-Naδ+
 CH3-CH2-CH2-O-CH2-CH3
этилпропиловый
эфир
CH3-CH2-CH2-O-CH2-CH3
этилпропиловый
эфир
Обмен галонега цианидную группу:
CH3-CH2-CH2δ+(субстрат)→
Clδ-
CH3-CH2-CH2-CN нитрил бутановой к-ты
Обмен галогена на нитро группу:
CH3-CH2-
CH2δ+-Clδ- CH3-CH2-
CH2-NO2
CH3-CH2-
CH2-NO2
1нитро пропан
Аммонолиз гологенопроизводных:
CH3-CH2-
CH2δ+-Clδ- CH3-CH2-
CH2-NH-R
CH3-CH2-
CH2-NH-R
[CH3-CH2- CH2-NH-R]+Cl-
соли карбоновых к-т
 -
- + CH3-C(=O)-
+ CH3-C(=O)- →
CH3-C(=O)-OCH3 метилацетат(сл.эфир)+NaBr
→
CH3-C(=O)-OCH3 метилацетат(сл.эфир)+NaBr
р-я отщипления (элиминирования Е)галогеноводородов с образованием алкЕнов:
CH3-(CH3)C(Br)-
CH(H)-CH2-CH3
2бром2метилпентан
CH3-(CH3)C=CH-CH2-CH3 2метилпентен2
Реакции галогенопроизводных идут с Ме с образов. Металлоорганических соединений(реактив Гриньяра)
R-CH2-Br
+ Mg R-CH2-Mg-Br
(R-CH2-магнийбромид)
R-CH2-Mg-Br
(R-CH2-магнийбромид)
Для Na – как Вюрца на алканы.
Применение галогенопроизводных:
Хлорметаны – растворители жиров,масел, смол, каучуков. CHCl3 – наркотическое в-во
Винилхлорид – получ.ПВХ
Тетрафторэтилен (CF2=CF2) полимеризуется в присутствии водорода перекиси в тефлон.
7.Арены – циклические соединения, обладающие особыми Физическими и химическими св-вами.
-устойчивы к действию окислителей,
-малохарактерны р-ии присоединения
-характерны р-ии замещения
Ароматичность- склонность в-ва при явной ненасыщенности проявлять св-ва насыщенных соединений.
в
нафталин(конденсированное соединение)
Арены
– гомологи безола( )
)
Изомерия обусловлена:
1)положением заместителей в цикле
2) в боковой цепи

Получение галогенпроизводных:
Тримеризация ацетилена.

3СН≡СН

Р-я Вюрца-фиттига:

Сплавление солей карб. К-т со щелочью:

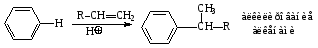
Алкилирование аренов
а)галогеналканами:

б)алкенами:

Физические свойства:
Бензол и его гомологи – бесцветные жидкости с характерным запахом. Высшие гомологи – твёрдые вещества. плотность <1.
Нераств. В Н2О, но отлично в органических растворителях.
Легковоспламеняются , много копоти, пары – токсичны.
Химические свойства:
Реакции присоединения идут с нарушением ароматичности, те.е с разрывом.
А)гидрирования:

Б) галогенирования:
 гексахлор-циклогексан
гексахлор-циклогексан
Р-ии замещения:
А) р-яя галогенирования

Б)р-ии нитрования

В)р-я окисления

Г)р-ии электрофильного замещения, замещение атома водорода на электрофил.

Бромирование, хлорирование:

Сульфирование:

Алкилирование галогеналканами:

Алкилирование алкенами:
Ацилирование:

