-
З
Влад
акон сохранения массы гласит,
что в ходе химической реакции остается
постоянной
|
-
В
первой половине XVIII
века увеличение массы металла после
прокаливания на воздухе объясняли
|
-
Гашеная
известь – это
|
-
Эквивалентная
масса карбоната натрия в реакции:
Na2CO3
+ HCl = NaHCO3
+ NaCl равна
|
-
Моль
вещества это такое его количество,
которое
|
-
В
каком из этих соединений больше
массовая доля водорода
|
-
Максимальная
степень окисления железа равна
|
-
Бор
использовал в своей модели атома
|
-
Главное
квантовое число может принимать
значения
|
-
Орбитальное
квантовое число может принимать
значения
|
-
Магнитное
квантовое число может принимать
значения
|
-
Спиновое
квантовое число может принимать
значения
|
-
Порядок
заполнения электронами орбиталей
атома определяется принципами
|
-
I
правило Клечковского
|
-
Атом
поглощает или излучает энергию при
|
-
Правило
Хунда
|
-
Энергия
химической связи тем больше, чем
|
-
Физический смысл
орбитального квантового числа
(АО – атомная
орбиталь)
|
-
Символы только
d
– элементов расположены в ряду
|
-
Для какого
металла в основном состоянии имеет
место «провал» электрона типа:
1e
4s
→ 3d
|
-
Число
неспаренных электронов в атоме золота
равно
|
-
Максимально
возможное число электронов на третьем
энергетическом уровне
|
-
Амминокомплексом
является
|
-
Элементом
с конфигурацией внешнего слоя 3d104s1
является
|
-
Невозможна
следующая конфигурация в атоме
|
-
Молекула
HF
образована следующей химической
связью
|
-
Заряд
комплексообразователя в комплексной
соли K[Fe(H2O)2(SO4)2]
равен:
|
-
Химическая
связь в молекуле KCl
называется
|
-
В
ряду элементов Li,
Be,
B,
C,
N,
O,
F
электроотрицательность
|
-
В
атоме серы число неспаренных электронов
равно
|
-
Химическая
кинетика
– это наука
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Термодинамика
есть наука, изучающая
|
-
Закон
Гесса необходим для
|
-
Размерность
энтальпии
|
-
При
р, Т = const
изменение энергии Гиббса вычисляется
по формуле:
|
-
С
увеличением температуры энтропия:
|
-
В
результате изотермического процесса
вся теплота
|
-
Пара
следующих ионов может находиться
совместно в растворе
|
-
Соль,
гидролизующаяся только по катиону
|
-
Соль,
гидролизующаяся только по аниону
|
-
Соль,
гидролизующаяся по катиону и аниону
|
-
Растворимость
– это концентрация насыщенного
раствора
|
-
Нормальность
– это, содержащееся в 1 л раствора
количество
|
-
10
мл 0,2 N
H2SO4
реагирует с 5 мл гидроксида натрия.
Какова нормальная концентрация
щелочи?
|
-
Моляльная
концентрация измеряется в
|
-
Если
смешать 35 г калийной селитры и 65 г
воды, какова массовая доля KNO3
в растворе:
|
-
Сколько
г гидроксида аммония нужно взять,
чтобы получить 2 М раствор?
|
-
Константа
равновесия равна
|
-
Константа
скорости реакции зависит от
|
-
Осмос
– это проникновение через полупронецаемую
перегородку в раствор
|
-
Следующие
электролиты при диссоциации в водном
растворе образуют ионы водорода:
|
-
Равновесие
процесса
N2
+ 3H2
2NH3
при повышении
давления сместится в сторону
|
-
Для реакции
Zn
+ 2HCl
(г)
ZnCl2
+ H2
при понижении
давления равновесие сместится в
сторону
|
-
Раствор
отличается от химического соединения
|
-
Растворитель-это
компонент раствора
|
-
Растворимость
хлорида натрия выше в
|
-
Электролиты
– это
|
-
По
величине степени диссоциации
электролиты делятся
|
-
Сильной
кислотой является
|
-
Для
слабых бинарных электролитов выражение
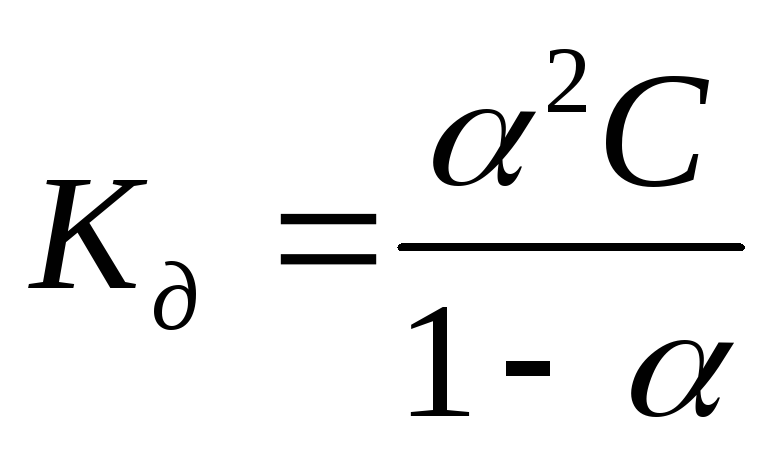
носит название
|
-
При
250С
константа диссоциации уксусной
кислоты равна 1,810-5.
Степень диссоциации кислоты в 1 N
водном растворе равна
|
-
Из
приведенных электролитов выберите
самый слабый
|
-
Слабым
основанием является
|
-
Ионное
произведение воды равно
|
-
Индикаторы
– это
|
-
Фенолфталеин
в щелочной среде имеет цвет
|
-
Лакмус
в кислой среде имеет цвет
|
-
Окраска
лакмуса в щелочной среде
|
-
Значение
рН щелочного раствора рассчитывают
по формуле
|
-
рН
в 0,0001 N
растворе гидроксида калия равен:
|
-
Среда
водного раствора, водородный показатель
которого рН = 13,0
|
-
Диссоциация
ортофосфорной кислоты по второй
ступени описывается уравнением
|
-
Реакции
Fe(OH)3
+ 3HCl
FeCl3
+ 3H2O
отвечает следующее
ионное уравнение
|
-
Реакции
Al2(SO4)3
+ 3BaCl2
2AlCl3
+ 3BaSO4
отвечает следующее ионное уравнение
|
-
В
растворе хлорида цинка среда
|
-
В
растворе сульфата калия среда
|
-
Электролиз
– это
|
-
Коррозия
– это
|
-
Температура
замерзания раствора
|
-
Изменение
температуры кипения раствора
рассчитывается по формуле:
|
-
Окислителями
являются
|
-
Восстановителем
является
|
-
Марганец
восстанавливается по схеме Mn+7+5e=Mn+2
|
-
Укажите,
какие из приведенных процессов
представляют собой окисление
|
-
В
нейтральной среде взаимодействие
KMnO4
с Na2SO3
приводит
к образованию:
|
-
Из
KMnO4
в результате реакции KMnO4+FeSO4+H2SO4
образуется следующее вещество
|
-
В
результате реакции K2Cr2O7+Na2SO3+H2SO4
образуется следующее вещество
|
-
В
результате реакции KBr+Cl2
образуется следующее вещество
|
-
В
результате реакции H2SO3+H2S
образуется следующее вещество
|
-
В
результате реакции Cu+HNO3(k)
образуется следующее вещество
|
-
В
результате реакции KMnO4+Na2SO3+KOH
образуется следующее вещество
|
-
Наиболее
характерные степени окисления для
железа
|
-
Имеет степени
окисления
–1,
0, +1, +3, +5, +7
|
-
Степень
окисления хрома в дихромате калия
|
-
Уравнение
Нернста для электродов I
рода
|
-
При
растворении в щелочах свинец проявляет
степень окисления, равную
|
-
Царская
водка – это
|
-
Малахит
– это
|
-
Горная порода
доломит, химический состав которого
соответствует формуле CaMg(CO3)2,
относится к
классу:
|
-
Эквивалент
химического элемента зависит от
|
-
Эквивалентный
объем водорода составляет
|
-
Эквивалентная
масса металла составляет 9. Чему равна
эквивалентная масса его оксида?
|
-
Эквивалентная
масса азота в его оксиде составляет
7. Какова формула оксида?
|
-
Н
Слава
ормальная концентрация есть
отношение
|
-
М  оляльная
концентрация есть отношение оляльная
концентрация есть отношение
|
-
Мольная
доля есть отношение
|
-
Молярная
концентрация есть отношение
|
-
Процентная
концентрация есть отношение
|
-
Присутствие
сульфатов в водном растворе можно
определить по образованию белого
осадка с
|
-
Осмотическое
давление есть такое давление, которое
|
-
Процесс
осмоса характеризуется
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Закон
Рауля формулируется следующим образом
|
-
Эбуллиоскопическая
константа необходима для расчета
|
-
Криоскопическая
константа необходима для расчета
|
-
Термодинамика
– наука, изучающая
|
-
Размерность
энтальпии:
|
-
Энергия
Гиббса – это термодинамический
потенциал в
|
-
В
результате изотермического процесса
вся теплота
|
-
Согласно
постулата Планка для идеального
кристалла при 0 К равна нулю
|
-
Математическое
выражение первого начала термодинамики
имеет следующий вид
|
-
Закон
Гесса необходим для
|
-
Абсолютный
нуль (-273,15 С)
– это температура, при которой
происходит
|
-
В
результате изотермического процесса
вся теплота
|
-
Энтропия
возрастает в процессе
|
-
Энергия
химической связи тем больше, чем
|
-
Физический смысл
орбитального квантового числа
АО – атомная
орбиталь
|
-
Число
неспаренных электронов в атоме золота
равно
|
-
Максимально
возможное число электронов на 3
энергетическом уровне
|
-
Невозможна
следующая конфигурация в атоме
|
-
Молекула
NaCl образована следующей химической
связью
|
-
Соль,
гидролизующаяся только по аниону
|
-
Соль,
гидролизующаяся только по катиону
|
-
Соль,
гидролизующаяся по катиону и аниону
|
-
Растворимость
– это концентрация раствора
|
-
Какой
продукт образуется из Cr2(SO4)3 в реакции
Cr2(SO4)3+Br2+KOH
|
-
В
результате реакции KMnO4+Na2SO3(в
кислой среде) образуется
|
-
Из
KMnO4 в результате реакции KMnO4+FeSO4+H2SO4
образуется следующее вещество
|
-
Из
K2Cr2O7 в результате реакции
K2Cr2O7+Na2SO3+H2SO4
образуется следующее вещество
|
-
Из
KBr в результате реакции KBr+Cl2
образуется следующее вещество
|
-
Степень
окисления марганца в перманганате
калия
|
-
Степень
окисления хлора в перхлорате калия
|
-
Степень
окисления серы в сульфите калия
|
-
Бор
использовал в своей модели атома
|
-
Главное
квантовое число может принимать
значения
|
-
Орбитальное
квантовое число может принимать
значения
|
-
Магнитное
квантовое число может принимать
значения
|
-
Спиновое
квантовое число может принимать
значения
|
-
Максимальная
степень окисления железа равна
|
-
Степень
окисления хрома в бихромате калия
равна:
|
-
Заряд комплексного
иона равен
в следующем
комплексе:
|
-
Амминокомплексом
является
|
-
Аквакомплексом
является
|
-
Гидроксокомплексом
является
|
-
Следующие
электролиты при диссоциации в водном
растворе образуют ионы водорода:
|
-
Растворитель-это
компонент раствора
|
-
Белый
осадок AgCl растворяется с образованием
комплекса
|
-
Химическая
кинетика – это наука
|
-
Константа
равновесия равна
|
-
. Равновесие
процесса
N2 + 3H2
2NH3
при повышении
давления сместится в сторону
|
-
Константа
скорости реакции зависит от
|
-
Для реакции
Zn + 2HCl (г)
ZnCl2 + H2
при понижении
давления равновесие сместится в
сторону
|
-
Сильной
кислотой является
|
-
Для слабых
бинарных электролитов выражение

носит название
|
-
При
250С константа диссоциации уксусной
кислоты равна 1,810-5.
Степень диссоциации кислоты в 1 N
водном растворе равна
|
-
Из
приведенных электролитов выберите
самый слабый
|
-
Слабым
основанием является
|
-
Ионное
произведение воды равно
|
-
Размерность
энтропии
|
-
В
изобарно-изотермических условиях
реакции протекают самопроизвольно
в направлении
|
-
Изменение
энергии Гиббса в изобарно-изотермическом
процессе вычисляется по формуле
|
-
Для
определения влияния давления на
температуру фазовых превращений в
однокомпонентных системах постоянного
состава применяют уравнение
|
-
Фенолфталеин
в щелочной среде имеет цвет
|
-
Лакмус
в кислой среде имеет цвет
|
-
Значение
рН щелочного раствора рассчитывают
по формуле
|
-
Среда водного
раствора, водородный показатель
которого
рН = 13,0
|
-
Электролиты
– это
|
-
Степень
диссоциации – это
|
-
Сильные
электролиты – это вещества
|
-
Слабые
электролиты – это вещества
|
-
Реакции
Fe(OH)3 + 3HCl
FeCl3 + 3H2O
отвечает следующее
ионное уравнение
|
-
В
каком из этих соединений больше
массовая доля водорода
|
-
Электролиз
– это
|
-
Коррозия
– это
|
-
Уравнение
Нернста для электродов I рода
|
-
Царская
водка – это
|
-
Горная порода
доломит, химический состав которого
соответствует формуле CaMg(CO3)2,
относится к
классу:
|
-
Сусальное
золото – это
|
-
Метасиликат
натрия
|
-
СаС2+Н2О=С2Н2+Са(ОН)2Сколько
литров ацетилена (н.у.) выделилось,
если гидроксида кальция образовалось
7,4 г?
|
-
Какую
максимальную степень окисления может
проявлять атом рения?
|
-
Сколько фосфорной
кислоты (М=98 г/моль) вступило в реакцию
H3PO4+Ca(OH)2→
CaHPO4+2H2O, если в
результате образовалось 36 г воды?
|
-
В
каких единицах выражена универсальная
газовая постоянная R, если ее значение
равно 8,31
|
-
Моль
– это
|
-
Требуется
для реакции 0,5 моль гидроксида натрия.
Этому количеству вещества соответствует
его масса, равная
|
-
Одновременно
в растворе могут находиться:
|
-
Для
вычисления количества вещества газа
уравнением Авогадро можно воспользоваться,
если:
|
-
Хлорная
кислота – это
|
-
Какой
объем кислорода (н.у.) пойдет на сжигание
24 г магния 2Mg+O2=2MgO?
|
-
Присутствие
хлоридов в водном растворе можно
определить по образованию белого
осадка с:
|
-
Эквивалент
азота в аммиаке равен…
|
-
Вычислить
эквивалентную массу металла, если
при взаимодействии 24 г его с соляной
кислотой образовалось 2 г водорода
|
-
Эквивалентная
масса гидроксида натрия равна…
|
-
6,02·1023
молекул газа при нормальных условиях
занимают объем:
|
-
В
98 г серной кислоты содержится водорода:
|
-
Постоянная
Авогадро это:
|
-
Определить
карбонатную породу можно
|
-
Массовую
долю железа в Fe2(SO4)3 можно вычислить
по формуле:
|
-
Первым
доказательством сложного строения
атома явилось открытие и изучение
|
-
Символ
f соответствует значению орбитального
квантового числа
|
-
С
Саша
реди перечисленных элементов
наибольшее сродство к электрону имеет
|
-
У  атома никеля число электронов на
внешнем уровне составляет:
атома никеля число электронов на
внешнем уровне составляет:
|
-
Состояние
электрона в атоме описывается при
помощи функции
|
-
На
электронном энергетическом подуровне
6d могут разместиться
|
-
В
ряду Mg – Al – Ca металлические свойства
убывают или возрастают:
|
-
Координационное
число железа в комплексе K[Fe(H2O)2(SO4)2]
равно
|
-
Сколько
протонов находится в ядре атома
вольфрама?
|
-
Какое
максимальное количество электронов
может находиться на четвертом уровне?
|
-
Символы
только d-элементов расположены в ряду:
|
-
Согласно
квантовой теории, орбиталь – это:
|
-
Удаленность
электрона от ядра атома определяется
|
-
В
ряду гидроксидов Ва(OH)2 – Al(OH)3 – Si(OH)4
основные свойства:
|
-
Какая
электронная конфигурация возможна?
|
-
Согласно
теории Бора, энергия электрона в атоме
|
-
Набор
значений магнитного квантового числа
показывает
|
-
Электролитом
является
|
-
Белый
осадок при добавлении раствора нитрата
серебра образует следующий комплекс
|
-
В
водном растворе комплексные соединения
диссоциируют на
|
-
Раствор
отличается от химического соединения
|
-
Нормальная
концентрация это
|
-
В
одном килограмме 2 % раствора соляной
кислоты масса растворенного вещества
равна
|
-
Величина
осмотического давления рассчитывается
по формуле:
|
-
К
понятию «сильный электролит» не
относится высказывание:
|
-
Для
какого из растворов концентрацией
0,1 моль/кг содержание ОН– будет
наибольшим?
|
-
Выбрать
способ расчета рН раствора сероводородной
кислоты (H2S)
|
-
Гидролиз
– это химическое взаимодействие с
водой:
|
-
Буферный
раствор образуется при реакции:
|
-
Растворимость
соли всегда возрастает при
|
-
Раствор
отличается от механической смеси …
|
-
Массовая
доля это
|
-
Если
в 2 кг раствора содержится 100 г серной
кислоты, то массовая доля кислоты в
растворе равна
|
-
Если
в 2 литрах раствора содержится 0,8 г
NaOH, то молярная концентрация раствора
равна
|
-
В
уравнении осмотического давления СМ
- это
|
-
Фенолфталеин
в щелочной среде имеет цвет
|
-
Реакции
Al(OH)3+3HCl→AlCl3+3H2O
Отвечает следующее
ионное уравнение
|
-
Сильную
кислоту можно отличить от слабой по:
|
-
В
растворе какой соли рН будет меньше
7?
|
-
Произведение
растворимости это
|
-
В
растворе содержится 1,6 кг воды и
400 г NaOH. Процентная концентрация
раствора равна
|
-
Растворитель
– это компонент раствора
|
-
Молярная
доля это
|
-
Выбрать
способ расчета рН раствора серной
кислоты
|
-
Сильным
основанием является
|
-
рН
раствора (NH4)2SO4 рассчитывается следующим
образом:
|
-
Растворимость
BaSO4 можно понизить за счет:
|
-
Произведение
растворимости гидроксида алюминия
выражается формулой
|
-
Гидролиз
нитрата аммония описывается уравнением
|
-
В
окислительно-восстановительных
реакциях K2Cr2O7 является:
|
-
при
восстановлении перманганата калия
в сернокислой среде образуется
соединение:
|
-
Окислителем
не является
|
-
В
щелочной среде перманганат
восстанавливается до степени окисления
|
-
Окислительно-восстановительная
реакция пойдет под номером….
|
-
При протекании
реакции KMnO4+Na2SO3+H2SO4=
Перманганат
калия является
|
-
Правильные
продукты реакции KMnO4+Na2SO3+KOH=указаны в
номере….
|
-
равновесное
состояние – это когда:
|
-
Для
реакций, протекающих в объеме, скорость
процесса определяется уравнением:
|
-
Во
сколько раз возрастет скорость
химической реакции при увеличении
температуры системы на 200,если
температурный коэффициент равен 2?
|
-
Во
сколько раз возрастет скорость
химической реакции при увеличении
температуры системы на 100,если
температурный коэффициент равен 2?
|
-
Для
реакции:
Ba(NO3)2
+ H2SO4
BaSO4 + 2HNO3
константа
равновесия равна
|
-
Скорость
реакции пропорциональна произведению
концентраций реагентов в степенях,
равных
|
-
Согласно
правилу Вант-Гоффа, при повышении
температуры на 100 скорость химической
реакции:
|
-
Константа
равновесия зависит
|
-
Для реакции:
СаСО3
СаО + СО2
при понижении
давления равновесие сместится в
сторону
|
-
Для
реакции (считая ее элементарной)
H2+I2=2HI
скорость прямого процесса определяется
уравнением:
|
-
К
простым веществам относятся
|
-
Химический
элемент- это
|
-
Относятся
к основаниям:
|
-
Химическая
формула - это
|
-
К
минералам
не
относятся:
|
-
Реакциями
соединения
называются
|
-
Количество
вещества рассчитывают по формуле –
|
-
Хлорная
кислота это -
|
-
Сколько
моль вещества содержится в 64 г
кислорода?
|
-
Одним
из минералов, входящих в состав
вольфрамовых руд, является шеелит.
Его формула – CaWO4,
а химическое название:
|
-
Карбонатами
называются соли:
|
-
К
благородным
газам относятся:
|
-
К
щелочным
элементам относятся:
|
-
В
земной коре наиболее распространены
элементы
|
-
Эквивалентная
масса кислорода
(г/моль)
|
-
Эквивалентный
объем хлора составляет (л/моль)
|
-
Эквивалентная
масса металла составляет 12.
Чему
равна эквивалентная масса его оксида?
|
-
Эквивалентная
масса азота в его оксиде составляет
7. Какой это оксид?
|
-
Бор
использовал в своей модели атома
|
-
Главное
квантовое число может принимать
значения
|
-
Какую
максимальную степень окисления может
проявлять атом рения?
|
-
Число
квантовых чисел, характеризующих
состояние электронов в атомах
элементов, равно
|
-
Порядок
заполнения электронами орбиталей
атома определяется принципами
|
-
"Запрет"
Паули заключается в том, что
|
-
Максимальное
число электронов на одной орбитали
равно
|
-
Правило
Хунда гласит:
|
-
К
s-элементам
относятся
|
-
К
p-элементам
относятся
|
-
К
d-элементам
относятся
|
-
К
f-
элементам относятся
|
-
В
атоме кислорода число неспаренных
электронов равно
|
-
В
ряду элементов Li,
Be,
B,
C,
N,
O,
F
Электроотрицательность
возрастает или убывает
|
-
Химическая
кинетика
– это наука
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Для реакции
H2
+ I2
= 2HI
скорость обратного процесса определяется
уравнением
|
-
Константа
скорости химической реакции зависит
от
|
-
По
правилу Вант-Гоффа при повышении
температуры на 100
скорость реакции увеличится
|
-
Уравнение
Аррениуса имеет вид:
|
-
Для
реакции: aA+bBcC+dD
закон
действующих масс выражается уравнением:
|
-
Величина
К в выражении закона действующих масс
называется
|
-
Принцип
Ле Шателье заключается в следующем:
если на
систему, находящуюся в равновесии,
оказать какое-либо внешнее воздействие,
то равновесие в системе
|
-
При
повышении температуры равновесие
смещается в сторону:
|
-
Д
Дима
ля реакции
CaCO3
= CaO
+ CO2
при понижении давления равновесие
сместится в сторону:
|
-
К онстанта
равновесия не зависит от онстанта
равновесия не зависит от
|
-
Константа
равновесия реакции
Fe3O4
+ CO
3FeO
+ CO2
равна:
|
-
Раствором
называется
|
-
Растворимостью
вещества называется
|
-
К
безразмерным способам выражения
концентрации растворов относятся:
|
-
Молярность
раствора – это число молей растворенного
вещества, приходящееся на
|
-
Единицы
измерения нормальной концентрации
(СN)?
|
-
Единицы
измерения моляльной концентрации
(Сm):
|
-
Мольная
доля растворенного вещества показывает
|
-
Температура
замерзания раствора
|
-
Изменение
температуры кипения раствора
рассчитывается по формуле:
|
-
Окислителями
называются
|
-
Восстановителем
является
|
-
Марганец
восстанавливается по схеме Mn+7+5e=Mn+2
в какой среде?
|
-
Укажите,
какие из приведенных процессов
представляют собой окисление
|
-
В
нейтральной среде взаимодействие
KMnO4
с Na2SO3
приводит
к образованию:
|
-
Найдите
формулу комплексного соединения с
химическим названием: нитрат
акватетрааммин-цианокобальта (III)
|
-
Чему
равен заряд комплексного иона в
соединении – гексацианоферрат калия
(III)?
|
-
Молярная
концентрация 0,06 N
раствора ортофосфорной кислоты равна
|
-
40
г гидроксида натрия содержится в
следующем количестве 5 % раствора
|
-
В
растворе содержится 2 кг воды и 400 г
NaOH.
Моляльная концентрация раствора
равна
|
-
В
2 литрах децимолярного раствора серной
кислоты содержится растворенного
вещества
|
-
В
соответствии с законом Вант - Гоффа
осмотическое давление разбавленных
растворов равно
|
-
Электролиты
- это
|
-
Степень
диссоциации электролита - это
|
-
В
растворах слабых электролитов
присутствуют
|
-
Из
приведенных электролитов выберите
самый слабый
|
-
Сильным
основанием является
|
-
Какое
из приведенных уравнений соответствует
первой стадии диссоциации угольной
кислоты?
|
-
Ионное
произведение воды равно
|
-
Индикаторы
– это
|
-
Фенолфталеин
в щелочной среде имеет цвет
|
-
Сильную
кислоту можно отличить от слабой по:
|
-
Какой
из электролитов при диссоциации
образует ионы Н+
в водном
растворе?
|
-
В
растворе
0,005
М серной кислоты рН равен
|
-
рН
рассчитывают по формуле:
|
-
Среда
водного раствора, водородный показатель
которого рН = 13,2
|
-
В
растворе Ba(OH)2
концентрацией 0,0005 М водородный
показатель равен
|
-
При
написании молекулярно-ионных уравнений
реакций обмена следует писать в виде
ионов …
|
-
Реакции
обмена
CaCO3
+ 2HCl
= CaCl2
+ CO2
+ H2O
отвечает
молекулярно-ионное уравнение
|
-
Гидролизом
называется реакция
|
-
Гидролизу
практически не подвергаются соли,
образованные
|
-
В
водном растворе гидрокарбоната калия
лакмус приобретает окраску:
|
-
В
результате гидролиза AlCl3
в водном растворе преимущественно
образуется:
|
-
Растворимость
соли всегда понижается
|
-
Произведение
растворимости это
|
-
Произведение
растворимости AgSCN
равно 1,1610-12.
Растворимость соли в воде (моль/л)
равна
|
-
Значение
электродного потенциала рассчитывается
по уравнению:
|
-
Масса
образовавшегося в ходе электролиза
вещества рассчитывается по уравнению:
|
-
Тепловой
эффект изотермического процесса
равен:
|
-
При
р, Т = const
изменение энергии Гиббса вычисляется
по формуле:
|
-
Энтропия
имеет размерность
|
-
Самопроизвольные
процессы при данных р, Т
|
-
Какую
воду называют жесткой?
|
-
Какая
жесткость воды называется временной?
|
-
При
нормальных условиях объем, занимаемый
32 г кислорода равен
|
-
Оксид
мышьяка содержит 75,76% по массе мышьяка.
Химический эквивалент мышьяка в этом
оксиде равен
|
-
Относятся
к основаниям: …(даны формулы веществ)
|
-
Гидроксосульфат
меди (II)
- это
|
-
Химические
реакции - это
|
-
Относятся
к кислым солям
|
-
Степенью
окисления
элемента в химическом соединении
называется
|
-
Количество
вещества рассчитывают по формуле –
|
-
Восстановлением
называется
|
-
Окислителями
в химии называются
|
-
Сернистая
кислота - это
|
-
Восстановление
марганца в реакциях перманганата с
восстановителями происходит по схеме
Mn+7+3e=Mn+4
|
-
Укажите,
какие из приведенных процессов
представляют собой восстановление
|
-
В
сильнощелочной среде взаимодействие
KMnO4
с Na2SO3
приводит
к образованию:
|
-
Горная
порода доломит, химический состав
которого соответствует формуле
CaMg(CO3)2,
относится к классу:
|
-
Степень
окисления азота в соединениях NH3,
N2H4,
NH2OH,
N2,
N2O,
NO,
HNO2,
NO2,
HNO3
соответственно равна:
|
-
К
галогенам
относятся:
|
-
Относятся
к щелочноземельным элементам:
|
-
Число
молей в 36 граммах жидкой воды равно
|
-
Самым
распространенным химическим элементом
в земной коре является
|
-
Эквивалентная
масса серной кислоты равна в г/моль
|
-
Гидридом
является соединение
|
-
Номер
элемента – 52. Элемент называется
|
-
Силикатом
является
|
-
Число
электронов в атомах элементов равно
|
-
Число
квантовых чисел, характеризующих
состояние электронов в атомах
элементов, равно
|
-
Число
значений главного квантового числа
электронов атома n
равно
|
-
Главное
квантовое число может принимать
значения
|
-
Какую
максимальную степень окисления может
проявлять атом ниобия?
|
-
Число
значений спина электрона равно
|
-
Порядок
заполнения электронами орбиталей
атома определяется принципами
|
-
"Запрет"
Паули заключается в том, что
|
-
В
атоме кремния число неспаренных
электронов равно
|
-
Максимальное
число электронов на одной орбитали
равно
|
-
Валентности
атома углерода (IV)
соответствует электронная конфигурация
|
-
У
атома никеля число электронов на
внешнем уровне составляет
|
-
Какова
формула оксида циркония (IV)
|
-
Правило
Хунда гласит:
|
-
К
s-элементам
относятся
|
-
К
p-элементам
относятся
|
-
К
d-элементам
относятся
|
-
К
f-элементам
относятся
|
-
Орбитальное
квантовое число может принимать
значения
|
-
Основными
типами химической связи атомов в
молекулах веществ являются
|
-
В
ряду элементов Na,
Mg,
Al,
Si,
P,
S,
Cl
окислительная
способность
|
-
В
молекуле водорода число неспаренных
электронов равно
|
-
Химический
элемент с электронным паспортом
1s22s22p63s23p63d64s2
называется
|
-
Химическая
кинетика
– это наука
|
-
Зависимость
скорости реакции от концентрации
реагирующих веществ выражается
законом
|
-
Катализаторы
- это
|
-
К
Вика
инетическое уравнение химической
реакции записывается в следующем
виде:
|
-
Т емпературный
коэффициент скорости реакции равен
При повышении температуры на 400
скорость реакции увеличится емпературный
коэффициент скорости реакции равен
При повышении температуры на 400
скорость реакции увеличится
|
-
Энергия
активации реакции это
|
-
Химическое
равновесие в обратимых химических
реакциях наступает
|
-
Из
20 молей SO2
и 20 молей
O2,
смешанных в сосуде, объемом 10 л, при
равновесии образовалось по реакции
2SO2 + O
2 = 2SO3
16 молей SO3.
Константа равновесия этой реакции
равна
|
-
Раствором
в химии называется
|
-
В
зависимости от концентрации растворы
бывают:
|
-
Растворимостью
вещества называется
|
-
К
безразмерным способам выражения
концентрации растворов относятся:
|
-
К
имеющим размерность способам выражения
концентрации растворов относятся:
|
-
Моляльность
раствора – это число молей растворенного
вещества, приходящееся на
|
-
Сумма
мольных долей всех компонентов
раствора равна
|
-
Молярность
10%-го водного раствора NH4NO3
(плотностью
= 1,08 г/мл) равна:
|
-
Масса
растворенного вещества в одном литре
0,1 н раствора серной кислоты равна
|
-
Если
в 2 кг раствора содержится 100 г серной
кислоты, то массовая доля кислоты в
этом растворе равна
|
-
Раствор
приготовлен из 1,6 кг воды и 400 г NaOH.
Концентрация этого раствора в % по
массе равна
|
-
В
1 литре миллимолярного раствора серной
кислоты содержится растворенного
вещества
|
-
Температура
кипения растворов нелетучих компонентов,
растворенных в летучем растворителе,
|
-
Криоскопическая
постоянная воды равна 1,86 К·молькг.
Раствор, содержащий 1 моль NaCl
(=1)
в 1 кг воды кристаллизуется при
температуре
|
-
Электролитами
называются вещества,
|
-
Электролиты
относятся к проводникам
|
-
Процесс
диссоциации молекул слабых электролитов
на ионы
|
-
По
величине степени диссоциации
электролиты делятся на
|
-
К
сильным электролитам из перечисленных
относятся
|
-
К
сильным кислотам из перечисленных
относятся
|
-
Количественной
мерой силы (слабости) электролитов,
не зависящей от их концентрации,
служит величина
|
-
При
изменении концентрации раствора
слабого электролита (уксусная кислота)
степень его диссоциации
|
-
При
250С
константа диссоциации синильной
кислоты равна 4,9310-10.
Степень диссоциации HCN
в 1 М водном растворе равна
|
-
Лакмус
в щелочной среде имеет цвет
|
-
Из
приведенных электролитов выберите
самый слабый
|
-
Слабым
основанием является
|
-
Какое
из приведенных уравнений соответствует
второй стадии диссоциации угольной
кислоты?
|
-
Ионное
произведение воды равно
|
-
Для
количественной оценки кислотности
и щелочности разбавленных водных
растворов обычно используют величину
|
-
Сумма
водородного и гидроксильного
показателей в водном растворе при
250С
равна
|
-
При
250С среда водного раствора,
водородный показатель которого рН =
8,0
|
-
В
10-4 н
водном растворе серной кислоты
водородный показатель равен
|
-
Значение
электродного потенциала рассчитывается
по уравнению
|
-
Размерность
энтальпии
|
-
Экзотермической
называется
реакция,
протекающая
|
-
Гидролизом
называется реакция
|
-
Гидролизу
практически не подвергаются соли,
образованные
|
-
Из
перечисленных солей не подвергаются
гидролизу
|
-
При
смешивании водных растворов
Na2CO3
и FeCl3
образуются:
|
-
Жесткость
воды обусловлена присутствием ионов
|
-
Произведение
растворимости CaCO3
равно
4,410-9.
Растворимость кальцита в воде (моль/л)
равна
|
-
Количество
электричества, обуславливающее
электрохимическое превращение одного
эквивалента вещества, называется
константой
|
-
К
простым веществам относятся
|
-
Химический
элемент- это
|
-
Хлорная
кислота - это
|
-
Сколько
моль вещества содержится в 16 г
кислорода?
|
-
Одним
из минералов, входящих в состав
вольфрамовых руд, является шеелит.
Его формула – CaWO4,
а химическое название:
|
-
Относятся
к основаниям:
|
-
Химическая
формула - это
|
-
К
минералам
не
относятся:
|
-
Реакциями
соединения
называются
|
-
Количество
вещества рассчитывают по формуле –
|
-
Карбонатами
называются соли:
|
-
К
благородным
газам относятся:
|
-
К
щелочным
элементам относятся:
|
-
К
группе галогенов не относится
|
-
Эквивалентная
масса хлора(г/моль)
|
-
Эквивалентный
объем брома составляет (л/моль)
|
-
Эквивалентная
масса металла составляет 12.
Чему
равна эквивалентная масса его оксида?
|
-
Эквивалентная
масса азота в его оксиде составляет
7. Какой это оксид?
|
-
Химическая
кинетика
– это наука
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Для реакции
H2
+ I2
= 2HI
скорость обратного процесса определяется
уравнением
|
-
Константа
скорости химической реакции зависит
от
|
-
По
правилу Вант-Гоффа при повышении
температуры на 100
скорость реакции увеличится
|
-
Уравнение
Аррениуса имеет вид:
|
-
Величина
К в выражении закона действующих масс
называется
|
-
При
повышении температуры равновесие
смещается в сторону:
|
-
Для
реакции
CaCO3
= CaO
+ CO2
при понижении давления равновесие
сместится в сторону:
|
-
Константа
равновесия не зависит от
|
-
Константа
равновесия реакции
Fe3O4
+ CO
3FeO
+ CO2
равна:
|
-
Раствором
называется
|
-
Растворимостью
вещества называется
|
-
Произведение
растворимости это
|
-
Произведение
растворимости AgSCN
равно 1,1610-12.
Растворимость соли в воде (моль/л)
равна
|
-
К
безразмерным способам выражения
концентрации растворов относятся:
|
-
Молярность
раствора – это число молей растворенного
вещества, приходящееся на
|
-
Единицы
измерения нормальной концентрации
(СN)?
|
-
Единицы
измерения моляльной концентрации
(Сm):
|
-
Мольная
доля растворенного вещества показывает
|
-
Температура
замерзания раствора
|
-
Изменение
температуры кипения раствора
рассчитывается по формуле:
|
-
В
соответствии с законом Вант - Гоффа
осмотическое давление разбавленных
растворов равно
|
-
Окислителями
называются
|
-
Восстановителем
является
|
-
Марганец
восстанавливается по схеме Mn+7+5e=Mn+2
в
|
-
Укажите,
какие из приведенных процессов
представляют собой окисление
|
-
В
нейтральной среде взаимодействие
KMnO4
с Na2SO3
приводит
к образованию:
|
-
Найдите
формулу комплексного соединения с
химическим названием: нитрат
акватетрааммин-цианокобальта (III)
|
-
Чему
равен заряд комплексного иона в
соединении – гексацианоферрат калия
(III)?
|
-
Молярная
концентрация
0,09
N
раствора ортофосфорной кислоты равна
|
-
80
г гидроксида натрия содержится в
следующем количестве 5 % раствора
|
-
В
растворе содержится 2 кг воды и 400 г
NaOH.
Моляльная концентрация раствора
равна
|
-
В
2 литрах децимолярного раствора серной
кислоты содержится растворенного
вещества
|
-
Электролиты
- это
|
-
Степень
диссоциации электролита - это
|
-
В
растворах слабых электролитов
присутствуют
|
-
При
250С
константа диссоциации уксусной
кислоты равна 1,810-5.
Степень диссоциации кислоты в 1 N
водном растворе равна
|
-
Из
приведенных электролитов выберите
самый слабый
|
-
Сильным
основанием является
|
-
К
Никита
акое из приведенных уравнений
соответствует первой стадии диссоциации
угольной кислоты?
|
-
И онное
произведение воды равно онное
произведение воды равно
|
-
Индикаторы
– это
|
-
Фенолфталеин
в щелочной среде имеет цвет
|
-
Сильную
кислоту можно отличить от слабой по:
|
-
Какой
из электролитов при диссоциации
образует ионы Н+
в водном
растворе?
|
-
В
растворе
0,001
М серной кислоты рН равен
|
-
рН
рассчитывают по формуле:
|
-
Среда
водного раствора, водородный показатель
которого рН = 13,2
|
-
В
растворе Ba(OH)2
концентрацией 0,0005 М водородный
показатель равен
|
-
При
написании молекулярно-ионных уравнений
реакций обмена следует писать в виде
ионов
|
-
Реакции
обмена
CaCO3
+ 2HCl
= CaCl2
+ CO2
+ H2O
отвечает
молекулярно-ионное уравнение
|
-
Гидролизу
практически не подвергаются соли,
образованные
|
-
В
водном растворе гидрокарбоната калия
лакмус приобретает окраску:
|
-
В
результате гидролиза хлорида железа
в водном растворе преимущественно
образуется:
|
-
Значение
электродного потенциала рассчитывается
по уравнению:
|
-
Масса
образовавшегося в ходе электролиза
вещества рассчитывается по уравнению:
|
-
Тепловой
эффект изотермического процесса
равен:
|
-
При
р, Т = const
изменение энергии Гиббса вычисляется
по формуле:
|
-
Энтропия
имеет размерность
|
-
Самопроизвольные
процессы при данных р, Т
|
-
Какую
воду называют жесткой?
|
-
Какая
жесткость воды называется временной?
|
-
Бор
использовал в своей модели атома
|
-
Главное
квантовое число может принимать
значения
|
-
Какую
максимальную степень окисления может
проявлять атом фтора?
|
-
Число
квантовых чисел, характеризующих
состояние электронов в атомах
элементов, равно
|
-
Порядок
заполнения электронами орбиталей
атома определяется принципами
|
-
"Запрет"
Паули заключается в том, что
|
-
Максимальное
число электронов на одной орбитали
равно
|
-
Правило
Хунда гласит:
|
-
К
d-элементам
относятся
|
-
К
f-
элементам относятся
|
-
В
атоме азота число неспаренных
электронов равно
|
-
В
ряду элементов Li,
Be,
B,
C,
N,
O,
F
электроотрицательность
|
-
Степень
окисления хрома в бихромате калия
равна
|
-
Метасиликат
натрия
|
-
СаС2+Н2О=С2Н2+Са(ОН)2Сколько
литров ацетилена (н.у.) выделилось,
если гидроксида кальция образовалось
7,4 г?
|
-
Какую максимальную
степень окисления может проявлять
атом рения?
|
-
Сколько
фосфорной кислоты (М=98 г/моль) вступило
в реакцию H3PO4+Ca(OH)2→
CaHPO4+2H2O,
если в результате образовалось 36 г
воды?
|
-
В каких единицах
выражена универсальная газовая
постоянная R, если ее значение равно
8,31
|
-
Основная соль
алюминия имеет вид
|
-
0,5
моль гидроксида
натрия.
Этому количеству вещества соответствует
его масса, равная
|
-
Одновременно в
растворе могут находиться:
|
-
Для
вычисления
количества вещества газа
уравнением
Авогадро можно воспользоваться, если:
|
-
Хлорная кислота
- это
|
-
Какой объем
кислорода (н.у.) пойдет на полное
сжигание 24 г антрацита?
|
-
Присутствие
хлоридов в водном растворе можно
определить по
образованию белого
осадка
с:
|
-
Эквивалент
азота в
аммиаке
равен
|
-
Вычислить
эквивалентную массу металла, если
при
равна
взаимодействии 25 г его с соляной
кислотой образовалось 2 г водорода
|
-
Эквивалентная
масса
гидроксида
кальция
|
-
Царская водка -
это
|
-
В 98 г серной
кислоты содержится водорода:
|
-
Сусальное золото
|
-
Определить
карбонатную породу можно
|
-
Массовую долю
железа в Fe2(SO4)3 можно вычислить по
формуле:
|
-
Первым
доказательством сложного строения
атома явилось открытие и изучение
|
-
Бор использовал
в своей модели атома
|
-
Символ f
соответствует значению орбитального
квантового числа
|
-
Первым
доказательством сложного строения
атома явилось открытие и изучение
|
-
Бор использовал
в своей модели атома
|
-
Символ f
соответствует значению орбитального
квантового числа
|
-
Главное квантовое
число может принимать значения
|
-
У атома никеля
число электронов на внешнем уровне
составляет:
|
-
Состояние
электрона в атоме описывается при
помощи функции, которая
называется:
|
-
На электронном
энергетическом подуровне 6d могут
разместиться
|
-
В ряду Mg – Al –
Ca металлические свойства:
|
-
В
ряду элементов Na, Mg, Al, Si, P, S, Cl
окислительная
|
-
Координационное
число железа в комплексе K[Fe(H2O)2(SO4)2]
равно
|
-
Сколько протонов
находится в ядре атома вольфрама?
|
-
Какое максимальное
количество электронов может находиться
на четвертом уровне?
|
-
Согласно
квантовой теории, орбиталь – это:
|
-
Удаленность
электрона от ядра атома определяется
|
-
В ряду
гидроксидов Ва(OH)2 – Al(OH)3
– Si(OH)4 основные свойства:
|
-
Какая
электронная конфигурация возможна?
|
-
Согласно
теории Бора, энергия электрона в атоме
|
-
Набор
значений магнитного квантового числа
показывает
|
-
Размерность
энтропии
|
-
Электролитом
является
|
-
Тепловой эффект
изотермического
процесса равен:
|
-
Белый
осадок при добавлении раствора нитрата
серебра образует следующий комплекс
|
-
В водном
растворе комплексные соединения
диссоциируют на
|
-
Моляльная концентрация
-
показывает:
|
-
Раствор
отличается от химического соединения
|
-
Нормальная
концентрация это
|
-
В одном
килограмме 2 % раствора соляной кислоты
масса растворенного вещества равна
|
-
Величина
осмотического давления рассчитывается
по формуле:
|
-
К понятию
«сильный электролит» не относится
высказывание:
|
-
Для
какого из растворов концентрацией
0,1 моль/кг содержание ОН– будет
наибольшим?
|
-
Выбрать
способ расчета рН раствора сероводородной
кислоты (H2S)
|
-
Гидролиз
– это химическое взаимодействие с
водой:
|
-
Буферный
раствор образуется при реакции:
|
-
Растворимость
соли всегда возрастает
|
-
Раствор отличается от
механической смеси
|
-
Массовая
доля это
|
-
Если в
2 кг раствора содержится 100 г серной
кислоты, то массовая доля кислоты в
растворе равна
|
-
Если в
2 литрах раствора содержится 0,8 г NaOH,
то молярная концентрация раствора
равна
|
-
В
уравнении осмотического давления СМ
- это
|
-
Фенолфталеин
в щелочной среде имеет цвет
|
-
Реакции Al(OH)3+3HCl→AlCl3+
-
3H2O
отвечает следующее ионное уравнение
|
-
Сильную
кислоту можно отличить от слабой по:
|
-
В растворе
какой соли рН будет меньше 7?
|
-
Буферные
растворы не используют
|
-
Произведение
растворимости это
|
-
В
Артём
растворе содержится 1,6 кг воды
и 400 г NaOH. Процентная концентрация
раствора равна
|
-
Растворитель
– это компонент раствора
|
-
М олярная
доля это олярная
доля это
|
-
Выбрать способ
расчета рН раствора серной кислоты
|
-
Сильным
основанием является
|
-
рН
раствора (NH4)2SO4 рассчитывается следующим
образом:
|
-
Растворимость
BaSO4 можно понизить за счет:
|
-
Произведение
растворимости гидроксида алюминия
выражается формулой
|
-
Гидролиз
нитрата аммония описывается уравнением
|
-
В
окислительно-восстановительных
реакциях K2Cr2O7 является:
|
-
На рисунке Е – это:
-
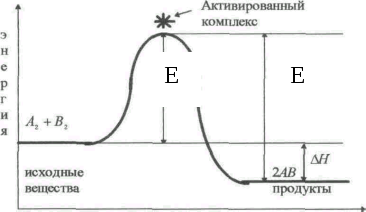
|
-
Во
сколько раз возрастет скорость
химической реакции при увеличении
температуры системы на 200,если
температурный коэффициент равен 2?
|
-
Во
сколько раз возрастет скорость
химической реакции при увеличении
температуры системы на 100,если
температурный коэффициент равен 2?
|
-
Для реакции:
Ba(NO3)2 + H2SO4
BaSO4 + 2HNO3
константа равновесия равна
|
-
Скорость
реакции пропорциональна произведению
концентраций реагентов в степенях,
равных
|
-
Согласно правилу
Вант-Гоффа, при повышении температуры
на 100 скорость химической реакции:
|
-
Константа
равновесия зависит
|
-
Для
реакции:
СаСО3 СаО + СО2
при
понижении давления равновесие сместится
в сторону
|
-
Для реакции
(считая ее элементарной) H2+I2=2HI скорость
прямого процесса определяется
уравнением:
|
-
Действие
катализатора основано на:
|
-
Малахит – это
|
-
Горная
порода доломит, химический состав
которого соответствует формуле
CaMg(CO3)2,
относится
к классу:
|
-
Негашеная известь
– это
|
-
Гидроксофосфат
бария –
это
|
-
Кислой солью
является
|
-
Дисперсную
систему жидкость – жидкость
называют:
|
-
Уравнение
Нернста для
электродов
I рода:
|
-
Константа
равновесия равна
|
-
Константа скорости
реакции зависит от
|
-
Тепловой эффект
изобарного процесса равен:
|
-
Первый закон
термодинамики выражается формулой:
|
-
Энтропия возрастает
при:
|
-
В изобарно-изотермических
условиях реакции протекают
самопроизвольно в направлении:
|
-
Равновесие
устанавливается в процессах
|
-
Для
реакции:
Na2CO3 + H2O NaHCO3 + NaOH
константа
равновесия равна
|
-
Для
реакции:
3Н2 (г) + N2 (г) = 2NH3 (г)
увеличение
давления приведет к смещению равновесия
в сторону:
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Для
реакции
aA+bBcC+dD
закон
действующих масс выражается уравнением:
|
-
Уравнение
Аррениуса имеет вид:
|
-
Для
реакции (считая ее
элементарной) H2+I2=2HI
скорость обратного процесса
определяется
уравнением:
|
-
Как
изменится скорость реакции
CO(Г)+Н2О(Г)→СО2(Г)+Н2(Г)
при
увеличении концентрации Н2О в 5 раз?
|
-
Согласно
правилу Вант-Гоффа, при повышении
температуры на 100 скорость химической
реакции:
|
-
Действие
катализатора
заключается
в:
|
-
Коррозия - это
|
-
На
рисунке Е – это:
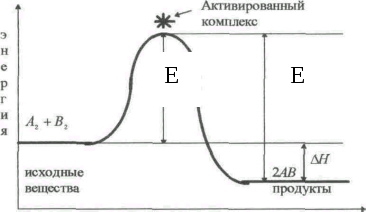
|
-
Присутствием
каких ионов
обусловлена
жесткость воды?
|
-
Морская вода -
это
|
-
Двуокись кремния
- это
|
-
Сусальное золото
- это
|
-
Малахит - это
|
-
Царская водка -
это
|
-
Сульфатом
натрия
является соединение
|
-
Хлоридом калия
является соединение
|
-
В атомах какого
элемента заполняется подуровень 2р
|
-
Строению
атома какого элемента отвечает
электронная конфигурация
1s22s22p63s23p64s1
|
-
Какое число
электронов находится на подуровне
3d у атома V
|
-
Нашатырный спирт
- это
|
-
Карбонатом калия
является
|
-
Из перечисленных
соединений аммиачным комплексом
является
|
-
Эквивалентная
масса ортофосфата калия равна (г/моль)
|
-
Ионом аммония
является
|
-
Степень окисления
S в ряду соединений H2S,
S, SO2, H2SO4
равна
|
-
Степень окисления
N в ряду соединений N2O, NO, NO2, HNO3 равна
|
-
Из перечисленных
соединений к кислотам относятся
|
-
Метаалюминат
кальция - это
|
-
Из перечисленных
соединений к солям относятся
|
-
Гидросульфит
калия - это
|
-
Дихроматом калия
является
|
-
Основной солью
является
|
-
Эквивалент
химического элемента зависит от
|
-
Эквивалентная
масса кислорода (г/моль)
|
-
Эквивалентный
объем Cl2 составляет (л/моль)
|
-
Эквивалентная
масса металла составляет 21. Чему равна
эквивалентная масса его оксида?
|
-
Главное квантовое
число определяет
|
-
Магнитное
квантовое число характеризует
|
-
Спиновое квантовое
число определяет
|
-
Основное следствие
запрета Паули
|
-
Формулировка
«электрон может вращаться вокруг
ядра только по некоторым определенным
круговым орбитам (стационарным)»
относится к
|
-
Заполнение
электронных оболочек атомов происходит
таким образом, чтобы суммарный спин
был максимальным – это относится к
|
-
Какая из
перечисленных электронных конфигураций
возможна?
|
-
В молекуле Н2
связь
|
-
В молекуле
хлорида натриясвязь
|
-
Гидролизом
называется
|
-
Соль, не
подвергающаяся гидролизу
|
-
Что является
одним из продуктов гидролиза карбоната
калия?
|
-
В присутствии
основания фенолфталеин становится
|
-
Гидролиз
усиливается от совместного присутствия
следующих соединений
|
-
В присутствии
основания лакмус становится
|
-
В присутствии
кислоты фенолфталеин становится
|
-
Термодинамика
- это наука, изучающая
|
-
Под первым началом
термодинамики понимают
|
-
Под вторым началом
термодинамики понимают
|
-
Под третьим
началом термодинамики (постулатом
Планка) понимают следующую формулировку:
|
-
Изохорическим
называется процесс, протекающий в
системе при постоянном
|
-
Закон Гесса
еобходим для
|
-
Энтальпия
(теплота) образования - это
|
-
Энтропия измеряется
в
|
-
Электролиты -
это
|
-
Слабые электролиты
– это
|
-
Растворами
называются
|
-
Эбуллиоскопическая
константа необходима при расчете
|
-
Криоскопическая
константа необходима для расчета
|
-
Процесс
осмосахарактеризуется
|
-
Размерность
нормальной концентрации
|
-
Размерность
молярной концентрации
|
-
Р
Дима
азмерность моляльной концентрации
|
-
20% раствор Na2SO4
содержит
|
-
1 N раствор H2SO4 содержит (объём 1 л)
N раствор H2SO4 содержит (объём 1 л)
|
-
Раствор HCl c
моляльной концентрацией (Cm ), равной
1, содержит
|
-
На нейтрализацию
50 мл 0,2 N раствора HCl потребовалось 10
мл раствора NaOH. Какова CN NaOH?
|
-
Данные соединения
не могут находиться совместно в
растворе
|
-
Химическая
кинетика – это наука
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Для реакции
aA+bBcC+dD закон
действующих масс выражается уравнением:
|
-
Окислителями
называются
|
-
Элемент, имеющий
в соединениях степень окисления,
равную (2-)
|
-
Один из продуктов
реакции: KMnO4+Na2SO3+ +H2SO4(р)=
|
-
Один из продуктов
реакции: KMnO4+FeSO4+ KOH =
|
-
Ионное произведение
воды
|
-
Значение рН
раствора, содержащего [Н+]=10-7 моль/л
|
-
Если рН раствора
равен 8.2, то реакция среды
|
-
Чему равен рН
0,001 N раствора NaOH
|
-
Реакция среды
дистиллированной воды
|
-
Электролиз - это
|
-
Уравнение Нернста
|
-
Медный купорос
- это
|
-
Сульфидом
Na
является соединение
|
-
Перманганатом
калия является соединение
|
-
Цианидом калия
является соединение
|
-
В атомах какого
элемента заполняется подуровень 3d?
|
-
Строению атома
какого элемента отвечает электронная
Конфигурация 1s22s22p63s23p64s2
|
-
Ангидридом какой
кислоты является Cl2O7
?
|
-
Карбонатом Mg
является
|
-
Из перечисленных
соединений Кристаллогидратом является
|
-
Эквивалентная
масса едкого натра равна
|
-
Эквивалентная
масса кислоты зависит от
|
-
Кислотным оксидом
является
|
-
Степень окисления
P в ряду соединений
P2O5,
P, H3PO4
равна
|
-
Степень окисления
Mn в ряду соединений
MnCl2, Mn,
KMnO4 равна
|
-
Из перечисленных
соединений к основаниям относятся
|
-
Из перечисленных
соединений к солям относятся
|
-
Манганат натрия
–Это
|
-
Гидроксохлорид
меди (II) – это
|
-
Кислой солью
является
|
-
Эквивалентная
масса оксида элемента- 27 (г/моль). Чему
равна эквивалентная масса элемента?
|
-
Амфотерным не
является оксид
|
-
Жесткость воды
обусловлена наличием солей
|
-
К группе галогенов
относится
|
-
Параметр,
определяющий пространственную
ориентацию данной атомной орбитали
и отчасти её форму
|
-
Параметр,
характеризующий собственный магнитный
момент электрона
|
-
Формулировка
«электрон может вращаться вокруг
ядра только по некоторым определенным
круговым орбитам» относится к
|
-
Какая из
перечисленных электронных Конфигураций
возможна?
|
-
Сколько электронов
в атоме скандия находится на подуровне
4s?
|
-
Кислую реакцию
имеет раствор
|
-
В присутствии
основания лакмус становится
|
-
Щелочную реакцию
имеет раствор
|
-
Среди
перечисленных реакцией нейтрализации
является
|
-
Окислительно-восстановительной
реакцией является
|
-
Cо
щелочами реагирует оксид
|
-
При взаимодействии
Са + Н2О образуется
|
-
Царская водка –
это
|
-
Химические
процессы, протекающие с поглощением
теплоты, называются
|
-
Энтальпия – это
|
-
Формулировка
«энтропия идеального кристалла
чистого вещества при 0 К равна нулю»
относится к
|
-
Энергия Гиббса
– это термодинамический потенциал
в
|
-
Формулировка
«тепловой эффект химической реакции
зависит от состояния исходных веществ
и продуктов реакции, но не зависит от
пути реакции и ее промежуточных
стадий» относится к
|
-
Изобарическим
называется процесс, протекающий в
системе при постоянном
|
-
Уравнение Q=dU+W
является математическим выражением
|
-
Изменение энтропии
для реакции: NH3 (газ.)
+ HCl(газ.) = NH4Cl
(тв.)
|
-
Неэлектролитами
являются
|
-
Свойство растворов,
являющееся коллигативным
|
-
Нормальная
концен-трация есть отношение
|
-
Мольная
доля есть отношение
|
-
Молярная
концентрация есть отношение
|
-
Процентная
концентрация есть отношение
|
-
50% раствор H2SO4
содержит
|
-
1 М раствор едкого
натра содержит (объем 1 л)
|
-
1 N
раствор соляной кислоты содержит
|
-
Осмосом
называют
|
-
Раствор содержит
10 г Na2SO3
и 90 г воды. Какова процентная концентрация
раствора?
|
-
Дана реакция: H2
+ J2 = 2HJ.
Написать выражение для скорости
прямой реакции.
|
-
Константа
равновесия химической реакции: СО2
+ С = 2СО имеет вид
|
-
Возможные степени
окисления Сl
|
-
Элемент, имеющий
степень окисления,равной ( -2 )
|
-
К группе благородных
газов не относится
|
-
Повышение
температуры кипения раствора можно
найти как
|
-
Закон Рауля
формулируется следующим образом
|
-
Жесткость воды
обусловлена присутствием ионов:
|
-
Возможные степени
окисления Fe
|
-
Степень окисления
кислорода в молекуле озона
|
-
Один из продуктов реакции
KMnO4+MnSO4+
+H2O=
|
-
Один
из продуктов реакции
KMnO4+Na2SO3+
+KOH=
|
-
Ионное произведение
чистой воды при 250 С равно
|
-
Водородный
показатель (рН) - это
|
-
При взаимодействии
концентрированной H2SO4
c Cu
образуется
|
-
На титрование
10 мл кислоты израсходовали 20 мл 0,5 N
раствора щелочи. Какова концентрация
кислоты?
|
-
Роданид аммония
- это
|
-
рН раствора
серной кислоты:
|
-
Лакмус в кислой
среде
|
-
Фенолфталеин в
щелочной среде
|
-
Сусальное золото-
это
|
-
Закон сохранения
массы гласит, что в ходе химической
реакции остается постоянной
|
-
В первой половине
XVIII века увеличение массы металла
после прокаливания на воздухе объясняли
|
-
Гашеная известь
- это
|
-
Эквивалентная
масса карбоната натрия в реакции:
Na2CO3 + HCl
= NaHCO3 + NaCl
равна
|
-
В каком из этих
соединений больше доля водорода
|
-
Максимальная
степень окисления железа равна
|
-
Бор использовал
в своей модели атома
|
-
Главное квантовое
число может принимать значения
|
-
Орбитальное
квантовое число может принимать
значения
|
-
Магнитное
квантовое число может принимать
значения
|
-
Спиновое квантовое
число может принимать значения
|
-
П
Влад
орядок заполнения электронами
орбиталей атома определяется
принципами
|
-
I правило Клечковского
правило Клечковского
|
-
Атом поглощает
или излучает энергию при
|
-
Физический смысл
орбитального квантового числа (АО –
атомная орбиталь)
|
-
Правило Хунда
|
-
Символы
только
d –
элементов расположены в ряду
|
-
Для какого металла
в основном состоянии имеет место
«провал» электрона типа: 1e 4s → 3d
|
-
Число неспаренных
электронов в атоме золота равно
|
-
Амминокомплексом
является
|
-
Элементом с
конфигурацией внешнего слоя 3d104s1
является
|
-
Невозможна
следующая конфигурация в атоме
|
-
Молекула HF
образована следующей химической
связью
|
-
В ряду элементов
Li, Be, B, C, N, O, F Электроотрицательность
|
-
Химическая
кинетика – это наука
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Термодинамика
есть наука, изучающая
|
-
Закон Гесса
необходим для
|
-
При р, Т = const
изменение энергии Гиббса вычисляется
по формуле:
|
-
С увеличением
температуры энтропия:
|
-
Пара следующих
ионов может находиться совместно в
растворе
|
-
Соль, гидролизующаяся
только по катиону
|
-
Растворимость
– это концентрация раствора
|
-
Нормальность –
это, содержащееся в 1 л раствора
количество
|
-
10 мл 0,2 N H2SO4
реагирует с 5 мл гидроксида натрия.
Какова нормальная концентрация
щелочи?
|
-
Моляльная
концентрация измеряется в
|
-
Если смешать 35
г калийной селитры и 65 г воды, какова
массовая доля KNO3 в растворе:
|
-
Константа
равновесия равна
|
-
Константа скорости
реакции зависит от
|
-
Осмос – это
проникновение через полупронецаемую
перегородку в раствор
|
-
Следующие
электролиты при диссоциации в водном
растворе образуют ионы водорода:
|
-
Равновесие
процесса N2 + 3H2
2NH3 при повышении давления сместится
в сторону
|
-
Раствор отличается
от химического соединения
|
-
Растворитель-это
компонент раствора
|
-
Электролиты -
это
|
-
По величине
степени диссоциации электролиты
делятся
|
-
Сильной кислотой
является
|
-
Для слабых
бинарных электролитов выражение
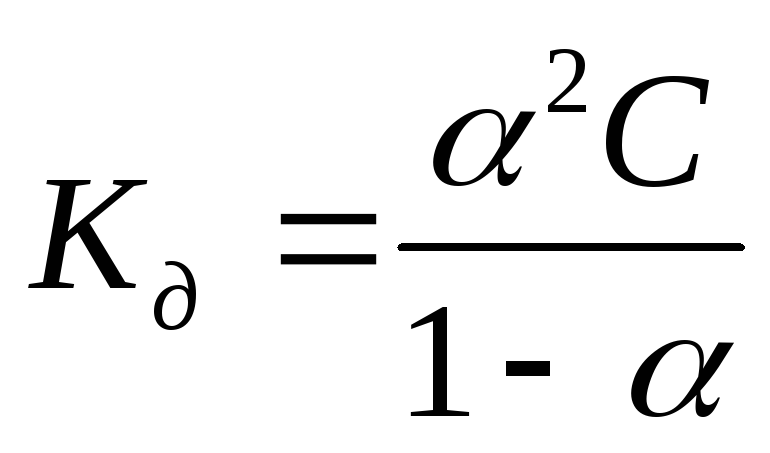 носит название
носит название
|
-
При 250С константа
диссоциации уксусной кислоты равна
1,810-5. Степень
диссоциации кислоты в 1 N водном
растворе равна
|
-
Из приведенных
электролитов выберите самый слабый
|
-
Ионное произведение
воды равно
|
-
Индикаторы –
это
|
-
Фенолфталеин в
щелочной среде имеет цвет
|
-
Окраска лакмуса
в щелочной среде
|
-
Значение рН
щелочного раствора рассчитывают по
формуле
|
-
рН в 0,0001 N растворе
гидроксида калия равен:
|
-
Среда водного
раствора, водородный показатель
которого рН = 13,0
|
-
Диссоциация
ортофосфорной кислоты по второй
ступени описывается уравнением
|
-
В растворе хлорида
цинка среда
|
-
Электролиз - это
|
-
Коррозия - это
|
-
Изменение
температуры кипения раствора
рассчитывается по формуле:
|
-
Восстановителем
является
|
-
Марганец
восстанавливается по схеме Mn+7+5e=Mn+2
|
-
Укажите, какие
из приведенных процессов представляют
собой окисление
|
-
В нейтральной
среде взаимодействие KMnO4 с Na2SO3 приводит
к образованию:
|
-
Из KMnO4 в результате
реакции KMnO4+FeSO4+H2SO4
образуется следующее вещество
|
-
В результате
реакции K2Cr2O7+Na2SO3+H2SO4
образуется следующее вещество
|
-
В результате
реакции Cu+HNO3(k)
образуется следующее вещество
|
-
Наиболее
характерные степени окисления для
железа
|
-
Уравнение Нернста
для электродов I рода
|
-
Царская водка -
это
|
-
Малахит - это
|
-
Горная порода
доломит, химический состав которого
соответствует формуле CaMg(CO3)2, относится
к классу:
|
-
Гидроксосульфат
свинца -это
|
-
Сульфидом Na
является соединение
|
-
Перманганатом
калия является соединение
|
-
Цианидом калия
является соединение
|
-
Ангидридом какой
кислоты является Cl2O7 ?
|
-
Карбонатом Mg
является
|
-
Из перечисленных
соединений кристаллогидратом является
|
-
Эквивалентная
масса едкого натра равна
|
-
Кислотным оксидом
является
|
-
Степень окисления
P в ряду соединений P2O5, P, H3PO4 равна
|
-
Из перечисленных
соединений к кислотам относятся
|
-
Из перечисленных
соединений к солям относятся
|
-
Гидроксохлорид
меди (II) – это
|
-
Эквивалентная
масса кислоты зависит от
|
-
Эквивалентная
масса водорода (г/моль)
|
-
Эквивалентная
масса оксида элемента составляет
27. Чему равна эквивалентная масса
элемента?
|
-
Амфотерным не
является оксид
|
-
Жесткость воды
обусловлена наличием солей
|
-
Параметр,
характеризующий собственный магнитный
момент электрона
|
-
Формулировка
«электрон может вращаться вокруг
ядра только по определенным орбитам»
относится к
|
-
Какая из
перечисленных электронных конфигураций
возможна?
|
-
Среди перечисленных
реакцией гидролиза является
|
-
Кислую реакцию
имеет раствор
|
-
В присутствии
основания лакмус становится
|
-
Щелочную реакцию
имеет раствор
|
-
Среди перечисленных
реакцией нейтрализации является
|
-
Окислительно-восстановительной
реакцией является
|
-
Cо щелочами
реагирует оксид
|
-
При взаимодействии
Са + Н2О→ образуется
|
-
Царская водка –
это
|
-
Формулировка
«энтропия идеального кристалла
чистого вещества при 0 К равна нулю»
относится к
|
-
Энергия Гиббса
– это термодинамический потенциал
в
|
-
Изобарическим
называется процесс, протекающий в
системе при постоянном
|
-
Размерность
энтропии
|
-
Изменение энтропии
для реакции: NH3 (газ.) + HCl(газ.) = NH4Cl
(тв.) равно:
|
-
Неэлектролитами
являются
|
-
Нормальная
концентрация есть отношение
|
-
Моляльная
концентрация есть отношение
|
-
Мольная доля
есть отношение
|
-
Молярная
концентрация есть отношение
|
-
1 М раствор едкого
натра содержит (объем 1 л)
|
-
Осмосом называют
|
-
Раствор содержит
10 г Na2SO3 и 90 г воды. Какова процентная
концентрация раствора?
|
-
К
Игорь
онстанта равновесия химической
реакции: СО2 + С = 2СО имеет вид
|
-
В озможные
степени окисления Сl озможные
степени окисления Сl
|
-
Элемент, имеющий
степень окисления, равной -2:
|
-
Закон Рауля
формулируется следующим образом
|
-
Понижение
температуры замерзания раствора
можно найти как
|
-
Один из
продуктов реакции FeCl3+KJ=
|
-
Ионное произведение
чистой воды при 250 С равно
|
-
Водородный
показатель (рН) - это
|
-
Эквивалентный
объем кислорода составляет
|
-
Эквивалентная
масса металла составляет 12. Чему равна
эквивалентная масса его оксида?
|
-
При взаимодействии
оксида кальция с водой образуется
|
-
К группе галогенов
относится
|
-
Какой из указанных
гидроксидов может образовать основную
соль
|
-
Какая из данных
кислот может образовать кислую соль
|
-
Ангидридом какой
кислоты является Cl2O5
|
-
Сильной кислотой
является
|
-
Хлорат кальция
есть следующая соль
|
-
Царская водка –
это
|
-
В теории Бора
электрон может Вращаться
|
-
Побочное
(орбитальное) число l характеризует
|
-
Главное квантовое
число определяет
|
-
Главное квантовое
число может принимать значения
|
-
Правило Хунда
гласит:
|
-
Магнитное
квантовое число Характеризует
|
-
Спиновое квантовое
число определяет
|
-
К p-элементам
относятся
|
-
Спиновое квантовое
число может принимать значения
|
-
Cтепень окисления
хрома в бихромате аммония равна
|
-
Максимальная
степень окисления марганца равна
|
-
Химическая
кинетика – это наука
|
-
Кинетическое
уравнение химической реакции
записывается в следующем виде:
|
-
Константа скорости
химической реакции зависит от
|
-
По
правилу Вант-Гоффа при повышении
температуры
на
100 скорость реакции увеличивается
|
-
Величина К в
выражении закона действующих масс
называется
|
-
В молекуле Н2
связь:
|
-
Для
реакции: aA+bBcC+dD
закон
действующих масс выражается уравнением:
|
-
Принцип Ле Шателье
заключается в следующем: если на
систему, находящуюся в равновесии,
оказать какое-либо внешнее воздействие,
то равновесие в системе
|
-
В молекуле хлорида
калия связь
|
-
Для
реакции: CaCO3 = CaO + CO2 при
понижении
давления равновесие сместится в
сторону:
|
-
Константа
ионизации воды равна:
|
-
Раствором
называется:
|
-
Молярность
раствора – это число молей растворенного
вещества, приходящееся на
|
-
Единицы измерения
нормальной концентрации -
|
-
Мольная
доля растворенного
вещества
показывает:
|
-
Изменение
температуры кипения раствора
рассчитывается
по формуле:
|
-
Критерием
принципиальной
осуществимости
процесса является
|
-
Электролиз –
это
|
-
При
р, Т = const изменение энергии Гиббса
вычисляется
по
формуле:
|
-
Найдите
формулу комплексного соединения с
химическим
названием: хлорид диакватетраамминоплатины
(IV)?
|
-
Чему
равен заряд комплексного
иона
в соединении – гексацианоферрат
калия (III)?
|
-
Процентная
концентрация нитрата натрия в растворе,
содержащем 25 г нитрата
натрия
и 75 г воды:
|
-
В
растворе содержится 1 кг воды и 56 г
KOH. Моляльная
концентрация
раствора равна
|
-
Присутствие
сульфатов в водном растворе можно
определить
по образованию белого осадка в
присутствии
|
-
Электролитами
называются:
|
-
Для
слабых бинарных электролитов выражение
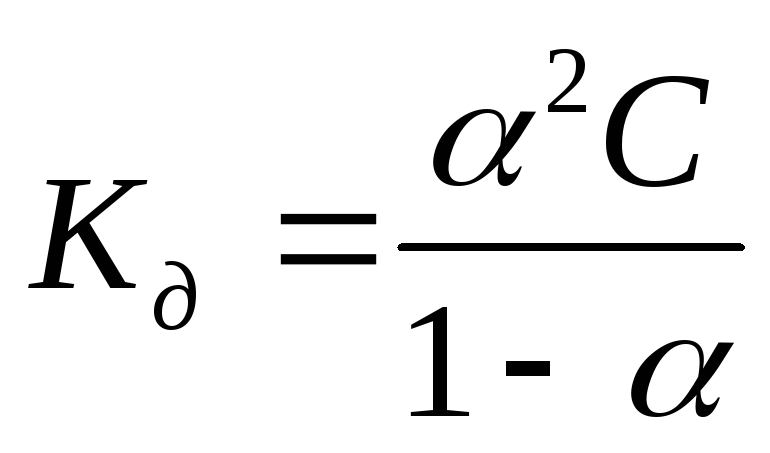 носит название
носит название
|
-
В присутствии
кислоты лакмус становится
|
-
Сильную кислоту
можно отличить от слабой по:
|
-
Значение
электродного
потенциала
рассчитывается по уравнению:
|
-
Тиосульфатом
натрия является соединение
|
-
Перхлоратом
калия является соединение
|
-
Строению атома
какого элемента отвечает электронная
конфигурация 1s22s22p63s23p64s1
|
-
Нашатырный спирт
– это
|
-
Карбонатом
кальция является
|
-
Из перечисленных
соединений кристаллогидратом является
|
-
Аммиаком является
|
-
Степень
окисления S в ряду соединений H2S,
S, SO2, H2SO4
Равна
|
-
Из перечисленных
соединений к оксидам относятся
|
-
Метаалюминат
кальция - это
|
-
Какова
формула
гидроксохлорида
магния?
|
-
Эквивалентный
объем Cl2 составляет (л/моль)
|
-
Эквивалентная
масса металла составляет 21. Чему равна
эквивалентная
масса его оксида?
|
-
Главное квантовое
число определяет
|
-
Магнитное
квантовое число характеризует
|
-
Спиновое квантовое
число определяет
|
-
Принцип Паули:
|
-
Какая
из перечисленных электронных
конфигураций
возможна?
|
-
В молекуле Н2
связь
|
-
Гидролизом
называется
|
-
Соль,
гидролизующаяся
только по аниону
|
-
В
присутствии
кислоты
лакмус становится
|
-
Термодинамика
- это наука, изучающая
|
-
Тепловой
эффект реакции больше 0,
реакция
называется:
|
-
Изохорическим
называется процесс, протекающий в
системе при
-
Постоянном
|
-
Химический
процесс называют
эндотермическим,
если он протекает с
|
-
Закон Гесса
необходим для
|
-
Стандартная
энтальпия (теплота) образования - это
|
-
Электролиты –
это
|
-
Слабые электролиты
– это
|
-
Растворами
называются
|
-
Криоскопическая
константа
необходима для расчета
|
-
Размерность
нормальной
Концентрации
|
-
Размерность
молярной
Концентрации
|
-
Размерность
моляльной
Концентрации
|
-
Размерность
мольной доли
Растворенного
вещества
|
-
20% раствор Na2SO4
содержит
|
-
2
М раствор H2SO4
содержит
(объём 1 л)
|
-
1
N раствор H2SO4
содержит
(объём 1 л)
|
|
Какая масса ( г ) LiBr содержится в
2 л 1
N раствора?
|
-
Объемы
растворов
реагирующих
веществ
|
-
На
нейтрализацию 50 мл 0,2 N раствора
HCl
потребовалось 10 мл раствора NaOH. Какова
CN NaOH?
|
-
Данные
соединения не могут находиться
совместно
в растворе
|
-
Химическая
кинетика
– это наука
|
-
Для
реакции
aA+bBcC+dD закон
действующих масс выражается
уравнением:
|
-
Окислителями
называются
|
-
Восстановителем
является
|
-
Один
из продуктов
реакции:
KMnO4+FeSO4+ +H2O=
|
-
Максимальная
степень окисления селена
|
-
Ионное произведение
воды
|




 оляльная
концентрация есть отношение
оляльная
концентрация есть отношение
 атома никеля число электронов на
внешнем уровне составляет:
атома никеля число электронов на
внешнем уровне составляет: онстанта
равновесия не зависит от
онстанта
равновесия не зависит от емпературный
коэффициент скорости реакции равен
При повышении температуры на 400
скорость реакции увеличится
емпературный
коэффициент скорости реакции равен
При повышении температуры на 400
скорость реакции увеличится онное
произведение воды равно
онное
произведение воды равно олярная
доля это
олярная
доля это

 N раствор H2SO4 содержит (объём 1 л)
N раствор H2SO4 содержит (объём 1 л) правило Клечковского
правило Клечковского озможные
степени окисления Сl
озможные
степени окисления Сl