
отчет по хим.4
.docxМинистерство образования и науки РФ
Национальный минерально-сырьевой университет «Горный»
Отчет
по лабораторной работе
Приготовление раствора и определение его концентрации.
Выполнил: студент группы ГНГ-12 Сляднева Д.А.
Проверил: Луцкий Д.С.
Цель работы: ознакомиться с методами приготовления растворов заданной концентрации и анализом раствора при помощи титрования.
Общие сведения.
Раствором называется гомогенная(однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах
В растворах выделяют растворитель и растворенное вещество. Растворителем называют компонент, который образует непрерывную среду. Остальные компоненты, которые распределены в среде растворителя в виде дискретных частиц, называются растворенными веществами. Состав раствора чаще всего выражается следующими способами:
Массовая доля, или процентное содержание ω.
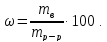
Концентрация, выраженная в граммах
на литр,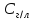
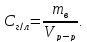
Молярная концентрация, или молярность,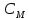
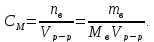
Моляльная концентрация, или моляльность,
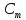

Мольная доля, или мольные проценты,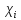
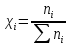
Нормальная концентрация, или
нормальность,
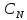
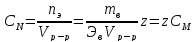
где z-количество обменных эквивалентов растворенного вещества, содержащееся в одном моле.
Прием колличественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации, называют титрованием.Состояние системы, в котором аналитическая реакция прошла полностью в соответствии со стехиометрическим уравнением при отсутствии избытка реагента, называют точкой эквивалентности.
Из определения нормальности концентрации следует, что число эквивалентов вещества в растворе равно произведению нормальности на объём раствора.
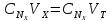
До эквивалентной точки в ходе титрования в растворе присутствует избыток определяемого вещества, а после – избыток титранта. Поэтому в эквивалентной точке свойства раствора резко меняются, в частности, окраска специально подобранных цветных индикаторов, что позволяет определить эквивалентный объем титранта.
Содержание протокола
Расчет необходимого объема серной кислоты.
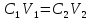


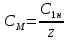
n2=0,4 0,1 =0,04 моль
m2HCl=0,04 36,5=1,46 г
m2,10%=14,6 г
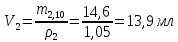
Ответ: 13,9 мл
Ход эксперемента:
-
Приготовление раствора заданной концентрации.
Наливаем в пробирку рассчитанный объем соляной кислоты. Добавляем дистиллированную воду до 100 мл.
-
Отмеряем аликвоту раствора.
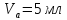
Отмеряем по 5мл в 2 колбы.
-
Титрируем полученный раствор гидроксидом натрия.
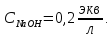
-
Полученные значения эквивалентных объемов щелочи:
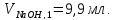

Расчеты практической концентрации раствора:

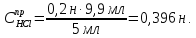
Расчет отклонения от теоритического значения концентрации соляной кислоты.
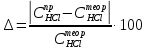
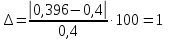
Вывод: ознакомились с методами приготовления растворов заданной концентрации и анализом раствора при помощи титрования.
Санкт-Петербург
2012
