
- •I. Химическое равновесие
- •1.1. Основные понятия
- •1.2. Расчет константы химического равновесия
- •1.3. Расчет равновесных концентраций с использованием константы равновесия
- •II. Смещение химического равновесия. Принцип ле-шателье
- •2.1. Общие понятия
- •2.2. Влияние изменения концентраций на направление смещения равновесия
- •2.3. Влияние изменения давления в системе на смещение равновесия
- •2.4. Влияние изменения объема системы на смещение равновесия
- •2.5. Влияние изменения температуры на смещение равновесия
- •2.6. Расчет новых равновесных концентраций
ИСПОЛЬЗУЕМЫЕ ОБОЗНАЧЕНИЯ
Т – температура, К;
t – температура, 0C;
P – давление, Па;
m(B) – масса вещества с формульной единицей В, г;
M(B) – молярная масса вещества B, г/моль;
n(B) = m(B)/M(B) – количество вещества, моль;
V0(B) – объем газообразного вещества при нормальных условиях, л;
![]() –
молярный объем газообразного вещества
при нормальных условиях, равный 22,4
л/моль;
–
молярный объем газообразного вещества
при нормальных условиях, равный 22,4
л/моль;
с(В) – молярная концентрация вещества В, моль/л;
![]() –
средняя скорость химической реакции,
моль/л∙c;
–
средняя скорость химической реакции,
моль/л∙c;
– истинная скорость химической реакции, моль/л∙с;
– время, с;
Δ = 2 – 1 – время реакции, с;
![]() –константы
скоростей прямой и обратной реакций,
соответственно;
–константы
скоростей прямой и обратной реакций,
соответственно;
– температурный коэффициент скорости реакции;
н.у. – нормальные условия, T=273K, P=101,3·103 Па;
с.у. – стандартные условия, T=298K, P=101,3·103 Па;
I. Химическое равновесие
1.1. Основные понятия
Большинство химических реакций являются обратимыми:
Обратимыми называются химические реакции, которые одновременно протекают и в прямом, и в обратном направлениях.
Уравнение обратимой реакции записывается
AA(г) + BB(г) DD(г) + FF(г) (1)
→ прямое направление реакции;
← обратное направление реакции.
Закон действующих масс для прямого и обратного направлений записывается:
![]() ,
,
![]() .
.
В ходе обратимой химической реакции концентрации реагентов уменьшаются, концентрации продуктов увеличиваются и, соответственно, уменьшается скорость прямой реакции и увеличивается скорость обратной. Наступает момент, когда они становятся равными. Это состояние обратимой реакции называется химическим равновесием.
Химическое равновесие – состояние обратимой реакции, характеризующееся равенством скоростей прямой и обратной реакций при постоянных значениях параметров процесса (температуре, давлении, объеме системы и концентрации веществ).
Кинетическое условие равновесия:
![]() (2)
(2)
Химическое равновесие является динамическим, поскольку и прямая, и обратная реакции в состоянии равновесия продолжают протекать, но с одинаковыми скоростями.
Концентрации участников реакции, которые устанавливаются в момент равновесия, называются равновесными и обозначаются: [A], [B], [F], [D], моль/л.
Скорости прямого и обратного процессов в момент равновесия равны соответственно:
|
|
(3) |
|
|
Равновесные
концентрации связаны с начальными
(исходными) концентрациями веществ (![]() )
соотношениями:
)
соотношениями:
|
для реагентов: |
для продуктов | |
|
|
|
(4) |
Чаще
всего концентрации продуктов реакции
в начальный момент равны нулю:
![]() ;
;![]() ,
в этом случае
,
в этом случае
[D] = c(D),
[F] = c(F).
Изменения
концентраций (![]() )
веществ, участвующих в реакции,
пропорциональны стехиометрическим
коэффициентам.
)
веществ, участвующих в реакции,
пропорциональны стехиометрическим
коэффициентам.
![]() =
const (5)
=
const (5)
![]() реагентов показывает, сколько
прореагировало данного вещества,
реагентов показывает, сколько
прореагировало данного вещества,![]() продуктов – сколько вещества образовалось
к моменту наступления равновесия.
продуктов – сколько вещества образовалось
к моменту наступления равновесия.
1.2. Расчет константы химического равновесия
Количественной характеристикой или законом действующих масс для обратимых химических реакций является константа химического равновесия (Kc).
Для гомогенной химической реакции (1) она запишется:
![]() (6)
(6)
Например, для реакции:
2NO(г) + Cl2(г) NOCl(г),
![]() . (7)
. (7)
В
гетерогенных химических процессах
конденсированные фазы (тв, ж) не учитываются
при записи и расчете![]() .
.
Например, для реакции:
TiO2(тв) + 2C(тв) + 2Cl2(г) TiCl4(г) + 2CO(г)
 . (8)
. (8)
Константа равновесия зависит только от природы веществ и температуры и не зависит от концентрации веществ и присутствия катализатора.
Константа
равновесия указывает на глубину
протекания процесса. Если
![]() ,
это значит, что равновесные концентрации
продуктов реакции F и D больше, чем
равновесные концентрации реагентов A
и B. Если
,
это значит, что равновесные концентрации
продуктов реакции F и D больше, чем
равновесные концентрации реагентов A
и B. Если![]() ,
равновесие устанавливается при больших
концентрациях реагентов A и B и малых
концентрациях продуктов F и D,.
,
равновесие устанавливается при больших
концентрациях реагентов A и B и малых
концентрациях продуктов F и D,.
Расчет
![]() сводится к определению равновесных
концентраций участвующих в реакции
веществ.
сводится к определению равновесных
концентраций участвующих в реакции
веществ.
Пример
1. Рассчитайте
![]() реакции
реакции
2SO2(г) + O2(г) 2SO3(г),
если
исходные концентрации
![]() и
и![]() равны соответственно 0,4 и 0,3 моль/л, а к
моменту равновесия образовалось 0,2
моль/л оксида серы (VI).
равны соответственно 0,4 и 0,3 моль/л, а к
моменту равновесия образовалось 0,2
моль/л оксида серы (VI).
Решение.
Реакция гомогенная, поэтому
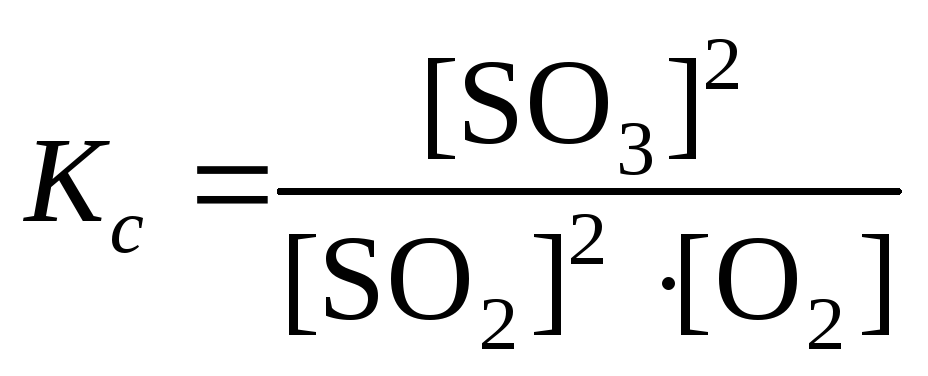 .
.
Для удобства и наглядности внесем условия задачи в таблицу:
Таблица 1
|
|
| ||
|
|
2 |
1 |
2 |
|
|
0,4 |
0,3 |
0 |
|
|
|
|
|
|
|
|
|
|
|
[В], моль/л |
|
|
0,2 |
Далее, по мере расчета определяемых величин будем вносить их значения в таблицу.
В соответствии с (4) запишем выражения равновесных концентраций для всех веществ:
![]()
![]()
![]() =
0,2
=
0,2
![]() ,
т. к. его значение не указано в условии
задачи, т.е. в начальный момент времени
этого вещества не было в системе.
Следовательно [SO3]
= c(SO3)
= 0,2.
,
т. к. его значение не указано в условии
задачи, т.е. в начальный момент времени
этого вещества не было в системе.
Следовательно [SO3]
= c(SO3)
= 0,2.
Находим
![]() реагентов в соответствии с уравнением
(5):
реагентов в соответствии с уравнением
(5):
![]() ,
,
откуда
![]() моль/л,
моль/л,
![]() моль/л.
моль/л.
Рассчитываем равновесные концентрации реагентов:
![]() моль/л,
моль/л,
![]() моль/л.
моль/л.
Результат расчетов представим в виде таблицы.
Рассчитываем константу равновесия
![]() .
.
Таблица 2
|
|
| ||
|
|
2 |
1 |
2 |
|
|
0,4 |
0,3 |
0 |
|
|
0,2 |
0,1 |
0,2 |
|
|
|
|
|
|
[B], моль/л |
0,2 |
0,2 |
0,2 |
Ответ:
![]() .
.
Пример
2. Рассчитайте
![]() реакции 2С(тв)+О2(г)
2СО(г),
если
реакции 2С(тв)+О2(г)
2СО(г),
если
![]() моль/л, а к моменту равновесия прореагировало
27% кислорода.
моль/л, а к моменту равновесия прореагировало
27% кислорода.
Решение.
Реакция
гетерогенная, углерод -
![]() не входит в выражение константы
равновесия:
не входит в выражение константы
равновесия:
![]()
Согласно (4), запишем:
для
реагента
![]() ,
,
для
продукта
![]() ,
т. к.
,
т. к.![]() .
.
![]() -
изменение концентрации
-
изменение концентрации
![]() к моменту наступления равновесия
рассчитываем из отношения:
к моменту наступления равновесия
рассчитываем из отношения:
|
|
– |
100% |
|
|
– |
27% |
![]() моль/л.
моль/л.
![]() рассчитываем,
воспользовавшись соотношением (5):
рассчитываем,
воспользовавшись соотношением (5):
![]() ;
;
![]() моль/л.
моль/л.
Определяем равновесные концентрации:
![]() моль/л,
моль/л,
![]() моль/л.
моль/л.
Исходные данные и результат расчетов сводим в таблицу:
Таблица 3
|
|
| ||
|
|
– |
1 |
2 |
|
|
– |
0,8 |
0 |
|
|
– |
0,216 |
0,432 |
|
|
– |
|
|
|
[B], моль/л |
– |
0,584 |
0,432 |
Вычисляем
![]() :
:
![]()
Ответ:
![]() .
.
Пример 3. В реакторе объемом 5л смешали 8,64 моль азота и 26,13 моль водорода. Рассчитайте константу равновесия реакции:
N2(г) + 3H2(г) 2NH3(г),
если в момент равновесия в реакторе обнаружено 6,912 моль азота.
Решение.
Реакция гомогенная, выражение константы равновесия:

Для
определения
![]() необходимо знать равновесные концентрации
всех веществ:
необходимо знать равновесные концентрации
всех веществ:
для
реагентов:
![]() ;
;
![]() ;
;
для
продукта:
![]() .
.
Рассчитаем
исходные концентрации веществ-участников
реакции. По условию задачи
![]() моль;
моль;![]() моль,
моль,![]() ,
т. к. аммиак не вводили в реактор в
начальный момент:
,
т. к. аммиак не вводили в реактор в
начальный момент:
![]() моль/л;
моль/л;
![]() моль/л;
моль/л;
![]()
Равновесная концентрация азота вычисляется аналогично:
![]() .
.
Из
уравнения
![]() находимс(N2):
находимс(N2):
![]() моль/л.
моль/л.
Используя соотношение (5) запишем:
![]() ,
,
и определяем:
![]() моль/л,
моль/л,
![]() моль/л.
моль/л.
и рассчитываем равновесные концентрации:
![]() моль/л.
моль/л.
![]() моль/л.
моль/л.
Рассчитаем
значение
![]() :
:
![]() .
.
Ответ: Кс= 4,8610-3.
