
4. Физические свойства
Как и алканы, низшие гомологи ряда простейших алкенов при обычных условиях — газы, а начиная с С5— низкокипящие жидкости.
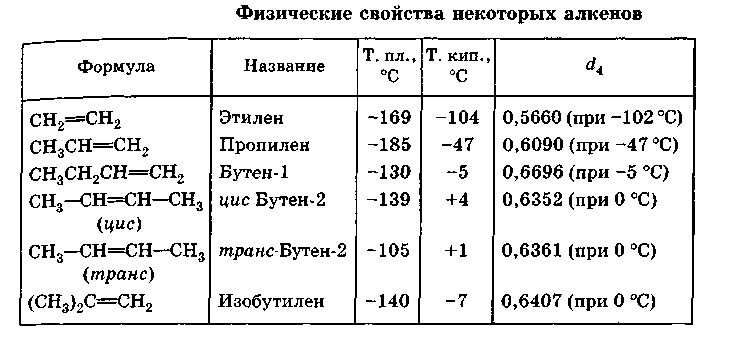
Все алкены, как и алканы, практически нерастворимы в воде и хорошо растворимы в других органических растворителях, за исключением метилового спирта; все они имеют меньшую плотность, чем вода.
5. Химические свойства
При рассмотрении реакционной способности сложных органических соединений действует общий принцип. В большинстве реакций участвует не «инертный» углеводородный радикал, а имеющиеся функциональные группы и их ближайшее окружение. Это естественно, ибо большинство связей менее прочны, чем связи С—С и С—Н, и, кроме того, связи в функциональной группе и вблизи нее наиболее поляризованы.
Естественно ожидать, что реакции алкенов будут проходить по двойной связи, которую тоже можно считать функциональной группой, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов.
Присоединение водорода
Присоединение водорода к алкенам приводит к образованию алканов:
![]()
Присоединение водорода к этиленовым соединениям в отсутствие катализаторов происходит лишь при высоких температурах, при которых часто начинается разложение органических веществ. Значительно легче присоединение водорода идет в присутствии катализаторов. Катализаторами служат металлы платиновой группы в мелкодисперсном состоянии, сама платина и особенно палладий — уже при обычной температуре. Большое практическое значение имело открытие Сабатье, применившего специально приготовленный мелкораздробленный никель при температуре 150—300°С и в многочисленных работах показавшего универсальность этого катализатора для целого ряда реакций восстановления.
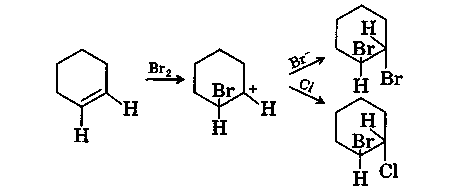
Присоединение галогенов
Галогены присоединяются к алкенам с образованием дигалогенопроизводных, содержащих атомы галогена у соседних атомов углерода:
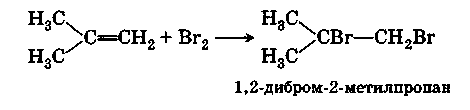
На первой стадии этой реакции происходит взаимодействие между π-электронами двойной связи и электрофильной частицей галогена с образованием π-комплекса (I). Далее π-комплекс перегруппировывается в ониевый (бромониевый) ион (II) с ощеплением аниона галогена, находящийся в равновесии с карбкатионом (III). Затем анион атакует ониевый ион с образованием продукта присоединения (IV):
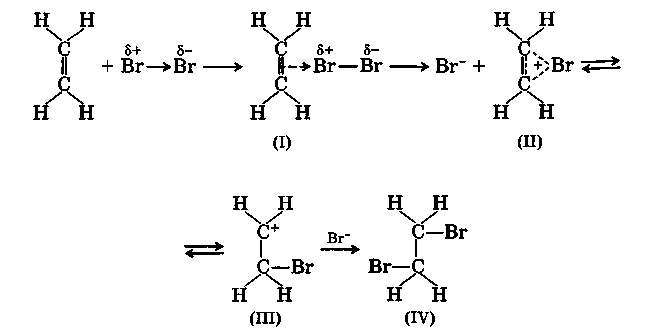
Атака анионом бромониевого иона (II) с образованием дибромида (IV) происходит в транс-положение. Так, в случае присоединения Вг2 к циклопентену образуется только транс-1,2-дибромдикло-пентан:
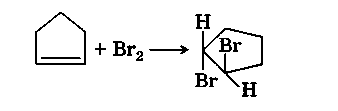
Доказательством двухстадийного присоединения галогена к алкенам является тот факт, что при присоединении Вг2 к циклогексену в присутствии МаС1 образуется не только транс-1,2-дибромциклогексан, но и транс-1-бром-2-хлорциклогексан:
Радикальное галогенирование
В жестких условиях (газовая фаза, 500°С) галогены не присоединяются по двойной связи, а происходит галогенирование α-положения:
![]()
В этом случае реакция идет по радикальному механизму.
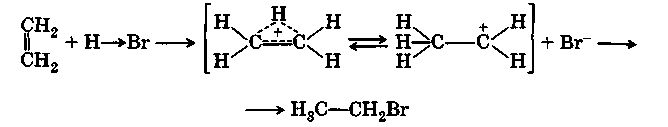
Присоединение галогеноводородов
Галогеноводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):
![]()
Эта реакция, как и присоединение брома к этилену, идет после образования π-комплекса через стадию образования протониевого иона:
В присутствии перекисей бромоводород присоединяется не по правилу Марковникова (эффект Хараша):
![]()
В присутствии перекисей реакция идет не по механизму электрофильного присоединения, как выше, а по радикальному механизму. Первой стадией является атака перекисного радикала на молекулу НВг:
![]()
Возникший радикал брома присоединяется к пропилену с образованием нового радикала:
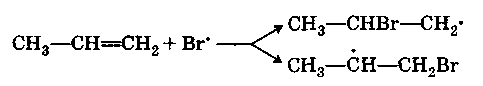
Последний стабилизируется за счет вырывания водорода из новой молекулы НВг с регенерацией нового радикала брома и т. д.:
![]()
И в этом случае направление процесса определяется устойчивостью радикалов бромпропана: образуется преимущественно более устойчивый, приводя к 1-бромпропану.
Присоединение воды и серной кислоты
В присутствии кислот вода присоединяется по двойной связи по правилу Марковникова:
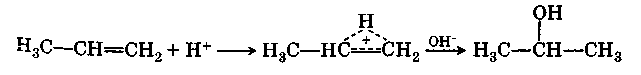
Так же идет реакция и с серной кислотой:
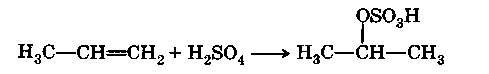
Окисление перманганатом калия в нейтральной или слабощелочной среде (реакция Вагнера)
![]()
На первой стадии по механизму цис-присоединения идет присоединение иона МпО4 к кратной связи с последующим гидролитическим расщеплением неустойчивого продукта присоединения и выделения иона МпО3-
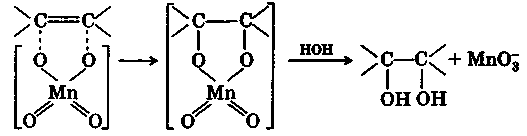
Реакция идет по схеме цис-присоединения:
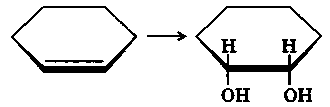
Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С-связи и образованием кислот или кетонов:
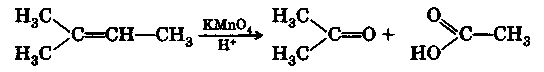
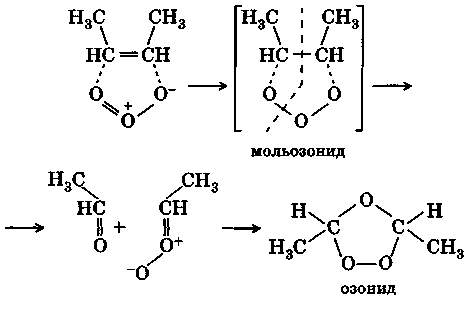
Действие озона на алкены
Эта реакция приводит к кристаллическим сильновзрывчатым озонидам, которые при гидролизе образуют альдегиды или кетоны:
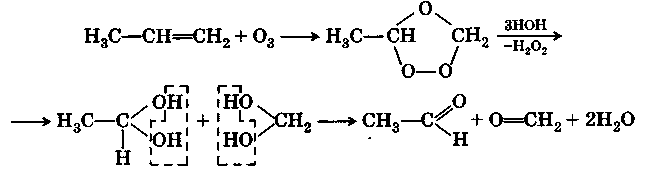
Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
Реакция идет путем цис-циклоприсоединения через стадию неустойчивого мольозонида, который подвергается диссоциации и последующей рекомбинации:
Полимеризация алкенов
Особо важное значение получила полимеризация этилена и пропилена в полимеры с молекулярной массой около 105. До 1953 г. в основном применялась радикальная (инициируемая свободными радикалами) полимеризация, хотя в принципе использовалось и анионное, и катионное инициирование процесса.
После работ Циглера и Натта, которые получили Нобелевскую премию за эти исследования, наиболее широко стала использоваться так называемая координационная полимеризация. Простейший «циглеровский» катализатор этого типа состоит из триэтилалюминия и соединений титана (IV). При этом происходит образование полимеров с высокой степенью стереорегулярности. Например, при полимеризации пропилена образуется изотактический полипропилен — полимер, в котором все боковые СН3-группы занимают одинаковое пространственное положение:
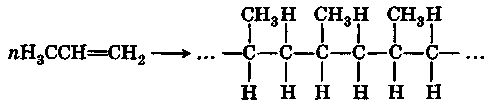
Это придает полимеру большую прочность, и он может даже применяться для изготовления синтетического волокна.
Полиэтилен, получаемый этим способом, представляет собой предельный углеводород с неразветвленной цепью. Он менее эластичен, чем полиэтилен, получаемый при высоких давлениях, но обладает большей твердостью и способен выдерживать воздействие более высоких температур.
Благодаря сочетанию многих ценных свойств полиэтилен имеет очень широкое применение. Он является одним из лучших материалов для изоляции кабелей, для применения в радарной технике, радиотехнике, сельском хозяйстве и др. Из него изготавливают трубы, шланги, сосуды, тару для сельскохозяйственных продуктов и удобрений, пленки различной толщины и многие бытовые предметы. Прочные пленки из полиэтилена начали применяться даже в качестве покрытия дна искусственных каналов для придания им водонепроницаемости.
Теломеризация
Интересен имеющий промышленное применение процесс сополимеризации этилена с тетрахлоридом углерода, названный теломеризацией. Если в смесь этилена с СС14 внести перекись бензоила или другой инициатор, распадающийся с образованием свободных радикалов, происходит следующий процесс:
![]()
Радикалы СС13' инициируют цепную полимеризацию этилена:
![]()
При встрече с другой молекулой СС14 рост цепи прекращается:
![]()
Радикал СС13- дает начало новой цепи.
Образующиеся низкомолекулярные продукты полимеризации, содержащие на концах цепи атомы галогена, называются теломерами. Получены теломеры со значениями п =2,3, 4, ...,15.
При гидролизе продуктов теломеризации образуются ω-хлорзаме-щенные карбоновые кислоты, являющиеся ценными химическими продуктами:
![]()
