
Решение задач на р-ры
.docРешение.
T1 = t1 + 273, T2 = t2 + 273,
где T1 и T2 – температуры, К; t1 и t2 – температуры, °C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.,1
=
с∙R∙T1,
pоcм.,2
=
с∙R∙T2,
откуда pоcм.,2![]() ,
,
где pоcм.,1 и pоcм.,2 – осмотические давления раствора при t1 и t2 °C, кПа; c – молярная концентрация неэлектролита; R – универсальная газовая постоянная.
3. Давление насыщенного пара над раствором неэлектролита А понижено сравнительно с чистой водой на χ %. Найдите соотношение между массой А m1 и массой воды m2 в растворе.
Решение.
Согласно первому закону Рауля для растворов неэлектролитов и определению мольной доли
![]() ,
откуда
,
откуда
![]() ,
,
где
![]() –
относительное понижение давления
насыщенного пара над раствором
сравнительно с чистой водой, доли
единицы; χ
– мольная
доля A,
%; 100 – пересчетный коэффициент от
процентов к долям; n1
и n2
– количества вещества A
и воды, моль.
–
относительное понижение давления
насыщенного пара над раствором
сравнительно с чистой водой, доли
единицы; χ
– мольная
доля A,
%; 100 – пересчетный коэффициент от
процентов к долям; n1
и n2
– количества вещества A
и воды, моль.
![]() ,
,
где
![]() – искомое
отношение масс;
M1
и M2
– молярные
массы А и воды, г/моль.
– искомое
отношение масс;
M1
и M2
– молярные
массы А и воды, г/моль.
4. Для приготовления антифриза на V1 л воды взято V2 л неэлектролита A, плотность которого равна ρ2 г/мл. Криоскопическая константа воды равна Кк K∙кг/моль. Найдите температуру замерзания антифриза.
Решение.
m1 = V1∙ρ1,
где m1 – физическая масса воды, кг; V1 – объем воды, л; ρ1 – плотность воды, кг/л.
m2 =1000∙V2∙ρ2,
где m2 – физическая масса А, г; 1000 мл/л – пересчетный коэффициент; V2 – объем А, л; ρ2 – плотность А, г/мл.
По определению
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг; n – количество вещества A, моль; M – молярная масса A, г/моль.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам = Кк∙cm,
где Тзам – понижение температуры замерзания раствора относительно воды, К; Кк – криоскопическая константа воды, К·кг/моль.
tзам. р-ра = tзам. воды – Тзам,
где tзам. р-ра – искомая температура замерзания антифриза, °C; tзам. воды – температура замерзания воды, °C.
ВАРИАНТ №24
1. Раствор содержит V1 л А (плотность ρ1 г/см3) и V2 л B (плотность ρ2 г/см3). Найдите мольную долю A и моляльную концентрацию B в этом растворе.
Решение.
m1 = 1000∙V1∙ρ1, m2 = 1000∙V2∙ρ2,
где m1 и m2 – физические массы A и B, г; 1000 см3/л – пересчетный коэффициент; V1 и V2 – объемы A и B, л; ρ1 и ρ2 – плотности A и B, г/см3.
n1
![]() ,
n2
,
n2
![]()
где n1 и n2 – количества вещества A и B, моль; M1 и M 2 – молярные массы A и B, г/моль.
По определению
![]() ,
,
где χ – искомая мольная доля A, доли единицы.
По определению
cm
![]() ,
,
где cm – искомая моляльная концентрация B, моль/кг; 1000 г/кг – пересчетный коэффициент.
2. Сколько молекул неэлектролита содержится в V мл его раствора, осмотическое давление которого при t °C равно pоcм. мм рт. ст.?
Решение.
T = t + 273,
где T – температура, К; t – температура,°C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
![]() ,
откуда с
,
откуда с![]() ,
,
где
pоcм.
–
осмотическое давление раствора, мм
рт. ст.;
c
– молярная концентрация A,
моль/л;
R
= 8,31
![]() –
универсальная газовая постоянная;
0,133
–
универсальная газовая постоянная;
0,133![]() –
пересчетный коэффициент.
–
пересчетный коэффициент.
По определению
с![]() ,
откуда
,
откуда
![]() ,
,
где n – количество вещества A, моль; 1000 мл/л – пересчетный коэффициент; V – объем раствора, мл.
N = n∙NA,
где N – искомое число молекул; NA = 6,02∙1023 моль-1 – постоянная Авогадро.
3. Давление насыщенного пара над чистой водой при некоторой температуре равно p0 кПа. Давление насыщенного пара воды над раствором, состоящим из V л воды и m1 г неэлектролита, при той же температуре равно p кПа. Найдите молярную массу неэлектролита.
Решение.
m2 = V·ρ,
где m2 – физическая масса воды, г; V – объем воды, л; ρ – плотность воды, г/л.
![]() ,
,
где n2 – количество вещества воды, моль; M2 – молярная масса воды, г/моль.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
,
где χ – мольная доля неэлектролита, доли единицы; p0 и p – давления насыщенного пара над чистым растворителем и над раствором, кПа.
По определению
![]() ,
откуда
,
откуда
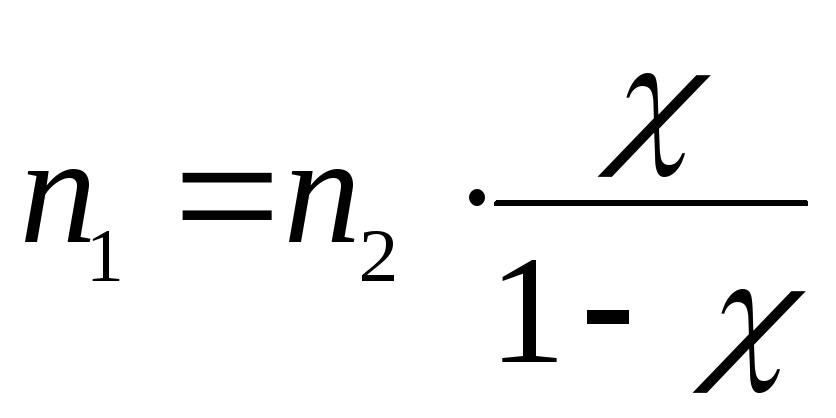 ,
,
где n1 – количество вещества неэлектролита, моль.
![]()
где M1 – искомая молярная масса неэлектролита, г/моль; m1 – физическая масса неэлектролита, г.
4. Pаствор, состоящий из m1 г неэлектролита А и m2 г растворителя, кипит при температуре на tкип °C бóльшей, чем чистый растворитель. Эбулиоскопическая константа растворителя равна Кэ K∙кг/моль. Найдите молекулярную массу А.
Решение.
Ткип = tкип,
где Ткип – повышение температуры кипения раствора относительно растворителя, К; tкип – повышение температуры кипения раствора относительно растворителя, °C.
Согласно второму закону Рауля для растворов неэлектролитов
Ткип
= Кэ∙cm,
откуда
 ,
,
где Кэ – эбулиоскопическая константа, К·кг/моль; cm – моляльная концентрация А, моль/кг.
По определению
cm
![]() ,
откуда
,
откуда
![]()
где n – количество вещества A, моль; 1000 г/кг – пересчетный коэффициент; m2 – физическая масса растворителя, г.
![]() ,
,
где M – молярная масса A, г/моль; m1 – физическая масса А, г.
![]() ,
,
где Mr – искомая молекулярная масса А, а.е.м.
ВАРИАНТ №25
1. В каком массовом соотношении надо смешать ω1%-ный и ω2%-ный растворы А, чтобы приготовить ω3%-ный раствор?
Решение.
По правилу «креста» (ω1 > ω2):
![]() ,
,
где
![]() – искомое
массовое соотношение
первого и
второго растворов, г; ω1,
ω2 и
ω3
–
массовые
доли, %. Иначе говоря, (ω3
–
ω2)
массовых частей первого раствора надо
смешать с (ω1
–
ω3)
массовыми частями второго.
– искомое
массовое соотношение
первого и
второго растворов, г; ω1,
ω2 и
ω3
–
массовые
доли, %. Иначе говоря, (ω3
–
ω2)
массовых частей первого раствора надо
смешать с (ω1
–
ω3)
массовыми частями второго.
2. Oсмотическое давление водного раствора, V мл которого содержат m г неэлектролита A, при t °C равно pоcм. мм рт.ст. Найдите молярную массу неэлектролита.
Решение.
T = t + 273,
где T – температура, К; t – температура, 0С.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
![]() ,
откуда с
,
откуда с![]() ,
,
где
pоcм.
–
осмотическое давление раствора, мм
рт. ст.;
c
– молярная концентрация A,
моль/л;
R
= 8,31
![]() –
универсальная газовая постоянная;
0,133
–
универсальная газовая постоянная;
0,133![]() –
пересчетный коэффициент.
–
пересчетный коэффициент.
По определению
с![]() ,
откуда
,
откуда
![]() ,
,
где n – количество вещества A, моль; 1000 мл/л – пересчетный коэффициент; V – объем раствора, мл; m – физическая масса A, г; M – искомая молярная масса A, г/моль.
3. Давление насыщенного пара над чистым растворителем В при некоторой температуре равно p0 мм рт.ст. Найдите давление насыщенного пара В над раствором, содержащим m1 г неэлектролита А в m2 г В при той же температуре.
Решение.
![]() ,
,
где n1 и n2 – количества вещества А и В, моль; m1 и m2 – физические массы А и B, г; M1 и M2 – молярные массы А и В, г/моль.
По определению
![]() ,
,
где χ – мольная доля A, доли единицы.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
откуда
,
откуда
![]()
где p0 и p – давления насыщенного пара над чистым В и над раствором, мм рт.ст.
4. Определите температуру кипения ω%-ного водного раствора неэлектролита A. Эбулиоскопическая константа воды равна Кэ K∙кг/моль.
Решение.
m1 = ω,
где m1 – физическая масса A в 100 г раствора A, г; ω – массовая доля A, %.
n
![]() ,
,
где n – количество вещества А в 100 г раствора A, моль; M – молярная масса A, г/моль.
![]()
где m – физическая масса воды в 100 г раствора, кг; 1000 г/кг – пересчетный коэффициент.
По определению
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг.
Согласно второму закону Рауля для растворов неэлектролитов
Ткип = Кэ∙cm,
где Ткип – повышение температуры кипения раствора относительно воды, К; Кэ – эбулиоскопическая константа воды, К·кг/моль.
tкип. р-ра = tкип. воды + Ткип,
где tкип. р-ра – искомая температура кипения раствора,°C; tкип. воды – температура кипения воды,°C.
ВАРИАНТ №26
1. В m г ω1%-ного раствора A растворили m2 г того же вещества. Чему стала равна массовая доля A в полученном растворе?
Решение.
По определению
![]() ,
откуда
,
откуда
![]()
где ω1 – массовая доля А в исходном растворе, %; m1 – физическая масса А, г; m – физическая масса исходного раствора, г .
![]() ,
,
где ω2 – искомая массовая доля А в полученном растворе, %.
2. Найдите осмотическое давление раствора (при t °C), в V мл которого содержится N молекул неэлектролита А.
Решение.
T = t + 273,
где T – температура, К; t – температура, °C.
По определению
с![]() ,
,
где c – молярная концентрация A, моль/л; n – количество вещества A, моль; 1000 мл/л – пересчетный коэффициент; V – объем раствора, мл; N – число молекул А, г; NA = 6,02∙1023 моль-1 – постоянная Авогадро.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм. = с∙R∙T,
где
pоcм.
–
искомое осмотическое давление раствора,
кПа; c
– молярная концентрация A,
моль/л;
R
= 8,31
![]() –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
3. Давление насыщенного пара над чистым растворителем при некоторой температуре равно p0 кПа. Какое количество неэлектролита надо растворить в n1 моль растворителя, чтобы получить раствор, давление насыщенного пара над которым было бы на Δp кПа меньше, чем над чистым растворителем при той же температуре?
Решение.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
,
где Δp – понижение давления насыщенного пара над раствором относительно растворителя, кПа; p0 – давление насыщенного пара над чистым растворителем, кПа; χ – мольная доля неэлектролита, доли единицы.
По определению
![]() ,
откуда
,
откуда
![]() ,
,
где n2 – искомое количество вещества неэлектролита, моль; n1 – количество вещества растворителя, моль.
4. Найдите температуру кипения раствора, состоящего из m1 г неэлектролита А и m2 г растворителя. Эбулиоскопическая константа растворителя Кэ K∙кг/моль, а его температура кипения tкип. р-ля °C.
Решение.
![]()
где n1 – количество вещества A, моль; m1 – физическая масса A, г; M1 – молярная масса A, г/моль.
По определению
cm
![]() ,
,
где cm – моляльная концентрация A, моль/кг; 1000 г/кг – пересчетный коэффициент; m2 – физическая масса растворителя, г.
Согласно второму закону Рауля для растворов неэлектролитов
Ткип = Кэ∙cm.
где Ткип – повышение температуры кипения раствора относительно растворителя, К; Кэ – эбулиоскопическая константа растворителя, К·кг/моль.
tкип. р-ра = tкип. р-ля + Ткип,
где tкип. р-ра – искомая температура кипения раствора,°C; tкип. р-ля – температура кипения растворителя,°C.
ВАРИАНТ №27
1. Какая масса растворенного вещества А содержится в V л его водного раствора с массовой долей ω % (плотность раствора ρ г/см3).
Решение.
m = 1000∙V∙ρ,
где m – физическая масса раствора, г; 1000 мл/л – пересчетный коэффициент; V – объем раствора, л; ρ – плотность раствора, г/ см3.
По определению
![]() ,
откуда
,
откуда
![]() ,
,
где ω – массовая доля А, %; m1 – искомая физическая масса А, г.
2. Oсмотическое давление раствора неэлектролита А при t °C равно pоcм. Па. Сколько г A содержится в V л этого раствора?
Решение.
T = t + 273,
где T – температура, К; t – температура, °C.
Согласно закону Вант-Гоффа для растворов неэлектролитов
pоcм.
= 1000∙с∙R∙T,
откуда
![]() ,
,
где
pоcм.
–
осмотическое давление раствора,
Па;
1000 л/м3
– пересчетный
коэффициент; с
– молярная
концентрация A,
моль/л;
R
= 8,31
![]() –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
По определению
![]() ,
откуда n
=
с∙V,
,
откуда n
=
с∙V,
где с – молярная концентрация A, моль/л; n – количество вещества А, моль; V – объем раствора, л.
m = n∙M,
где m – искомая физическая масса А, г; M – молярная масса A, г/моль.
3. Давление насыщенного пара над чистым растворителем В равно p0 мм рт.ст. Давление насыщенного пара В над раствором, состоящим из n1 моль неэлектролита А и m2 г растворителя, равно p мм рт.ст. при той же температуре. Найдите молекулярную массу В.
Решение.
Согласно первому закону Рауля для растворов неэлектролитов
![]() ,
,
где p0 и p – давления насыщенного пара над чистым В и над раствором, мм рт.ст.; χ – мольная доля А, доли единицы.
По определению
![]() ,
откуда
,
откуда
![]() ,
,
где n1 – количество вещества А, моль; n2 – количество вещества В, моль.
![]() ,
,
где M – молярная масса В, г/моль; m2 – физическая масса В, г.
![]() ,
,
где Mr – искомая молекулярная масса А, а.е.м.
4. Раствор, состоящий из m1 г неэлектролита Ax и m2 г растворителя, замерзает при tзам. р-ра °C. Криоскопическая константа растворителя равна Kк K∙кг/моль, а его температура замерзания tзам. р-ля °C. Найдите состав молекулы Ax.
Решение.
Тзам = tзам. р-ля – tзам. р-ра,
где Тзам – понижение температуры замерзания раствора относительно растворителя, К; tзам. р-ля – температура замерзания растворителя, °C; tзам. р-ра – температура замерзания раствора, °C.
Согласно второму закону Рауля для растворов неэлектролитов
Тзам
= Кк∙cm,
откуда
 ,
,
где Кк – криоскопическая константа растворителя, К·кг/моль; cm – моляльная концентрация Ax, моль/кг. .
По определению
cm
![]() ,
откуда
,
откуда
![]() ,
,
где n – количество вещества Ax, моль; 1000 г/кг – пересчетный коэффициент; m2 – физическая масса растворителя, г.
![]() ,
,
где M – молярная масса Ax, г/моль.
![]() ,
,
где x – число атомов А в молекуле Ax; M(А) – молярная масса A, г/моль.
