

Кинетика процессов горения |
Энергия активации
Тепловой эффект реакции

Энергия активации
Согласно молекулярно-кинетической теории химическая реакция представляет собой процесс разрушения старых молекулярных связей вещества и создание новых.
В любом выделенном объёме, имеющем постоянную температуру, отдельные молекулы вещества двигаются с различными скоростями, т.е. имеют разные кинетические энергии. Химическая реакция может протекать только в том случае, если соударение молекул произойдёт с энергией,
достаточной для разрушения старых внутримолекулярных связей.
Многие, даже очень быстрые реакции, при простом соприкосновении реагентов не идут. Например, смесь водорода с кислородом может очень долго находиться при комнатной температуре, не вступая в реакцию друг с другом. Но стоит только поднести к ней горящую спичку, как реакция начинает протекать очень быстро, часто со взрывом (поэтому смесь водорода с кислородом в объемном отношении 2:1 даже называют "гремучим газом").

Вчем же причина?
Как уже отмечалось, не любые соударения молекул или других химических частиц приводят к их взаимодействию, а только эффективные, то есть те соударения частиц, суммарная энергия которых больше какого-то определенного значения.
Эта "пороговая" энергия или минимальная энергия, которую нужно сообщить молекуле, чтобы преодолеть внутримолекулярные силы сцепления, называется энергией активации ЕА данной реакции.
После получения такой энергии внутренние связи в молекуле разрушаются, и она (молекула) становится готовой к образованию нового вещества.
Таким образом, энергию активации можно рассматривать как своего рода энергетический барьер, который
необходимо преодолеть, прежде чем произойдёт реакция.
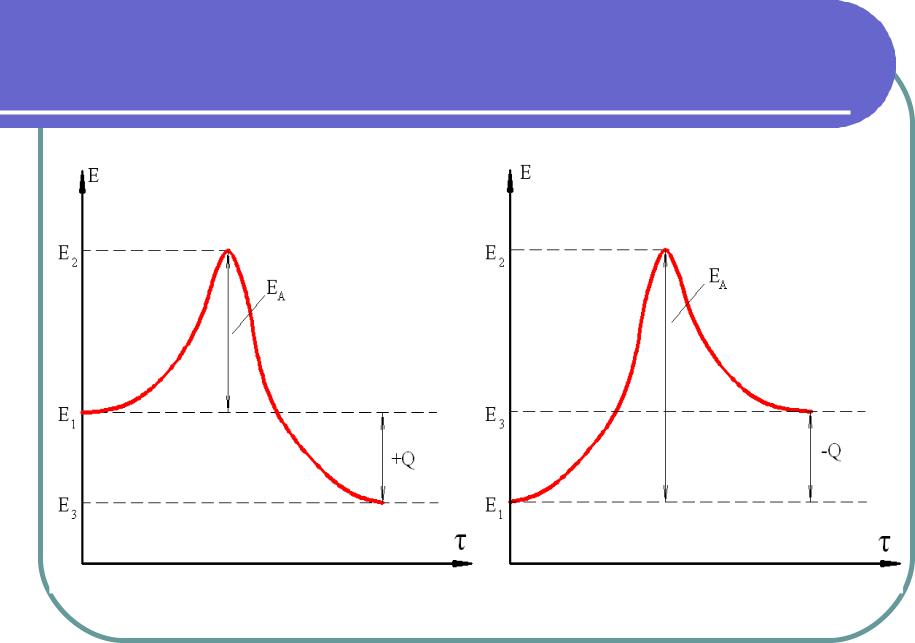
Энергия активации ЕА

Тепловой эффект реакции
В состоянии (1) молекулы исходных веществ имеют запас
внутренней энергии Е1, недостаточный для разрушения внутримолекулярных связей при их столкновении.
Для осуществления прямой реакции к системе необходимо
подвести некоторое количество энергии ЕА. Она и является энергией активации прямой реакции. При этом молекулы переходят в состояние (2) с внутренней энергией E2 = E1 + EA.
В состоянии (2) молекулы при столкновении вступают в
химическую реакцию с образованием продуктов реакции и выделением теплоты. После охлаждения продуктов реакции до начальной температуры (точка 3) внутренняя энергия продуктов сгорания (если речь идёт о реакции горения) будет равна Е3, а количество выделяемой энергии Е2 – E3.
Разность между выделившейся энергией и энергией активации
ЕА, поглощаемой в процессе активизации молекул, представляет собой тепловой эффект реакции Q = E2 – E1.
Если эта разность положительна, т.е. Q > 0 , то реакция
экзотермическая, если – отрицательная, т.е. Q < 0 , то реакция
эндотермическая.

Энергия активации
Очевидно, что если прямая реакция является экзотермической, то обратная будет эндотермической.
Чем выше ЕА, тем труднее осуществить реакцию.
C + О2 = CО2
ЕА = (25,6 – 40) ккал/г-моль = (107000 – 167000) кДж/кмоль
При высоких температурах возможна реакция
восстановления двуокиси углерода у раскалённой поверхности углерода
СО2 + C = 2CО
EА = (32 – 51,4) ккал/г-моль = (134000 – 215000) кДж/кмоль

Энергия активации
Влияние температуры
При повышении температуры увеличивается кинетическая энергия молекул исходных веществ, соответственно уменьшается количество энергии, необходимое для доведения молекул до активного состояния.
Если ЕА невелика, то в исходных веществах всегда найдутся молекулы, которые смогут преодолеть “энергетический барьер” и превратиться в молекулы продуктов реакции.
Если же ЕА велика, то таких молекул в реакторе может и не оказаться.
Таким образом, скорость реакции при прочих равных условиях тем больше, чем меньше ее энергия активации.

Катализаторы
На практике часто встречаются случаи, когда необходимо осуществить реакцию, энергия активации которой очень велика.
Скорость такой реакции, естественно, очень мала или практически равна нулю.
Если при этом сильно нагреть реакционную смесь нельзя (например, исходное вещество при
таком нагревании разлагается, или равновесие смещается в сторону исходного вещества), то для
получения нужного вещества приходится идти "обходным путем", применяя катализаторы.

