
Заочная форма обучения. Курс - Металлургия цветных металлов
Краткий конспект
Подготовка сырья к металлургическому производству
Металлургия меди
Металлургия цинка
Металлургия алюминия
Все металлы делят на две группы: черные и цветные.
К группе черных металлов относят железо, а также марганец (Mn), ванадий (V) и хром (Cr).
Все остальные металлы составляют группу цветных.
В свою очередь цветные металлы подразделяются на следующие подгруппы по физико-химическим свойствам:
а) тяжелые цветные металлы (плотность больше 5 г/см3): Cu(медь), Ni (никель), Pb (свинец), Sn(олово), Zn(цинк), Cd(кадмий),Co (кобальт), As (мышьяк), Sb ( сурьма);
б) легкие цветные металлы (плотность до 5 г/см3): Al (алюминий), Mg (магний), Na (натрий), а также Be (бериллий),Li (литий), Ba( барий), Ca (кальций), Sr (стронций), K( калий), Ti (титан), Zr(цирконий);
в) благородные металлы: Au (золото), Ag (серебро), Pt платина), Os(осьмий), Ir (иридий), Rh (родий),Ru (рутений), Pd ( палладий);
г) редкие металлы, которые подразделяются на:
тугоплавкие (температура плавления более 1873 К): Hf ( гафний), Nb( ниобий), Ta (тантал), Mo (молибден), W( вольфрам), Re( рений);
рассеянные: Ga (галлий), Tl (таллий), Ge (германий), Se( селен), Te ( теллур),In ( индий), Rb(рубидий), Cs (цезий);
редкоземельные: Sc (скандий), Y(иттрий), La (лантан) и лантаноиды (14 элементов от церия до лютеция);
радиоактивные: Ra (радий), Ac (актиний), актиноиды (торий, протактиний, уран и заурановые элементы), полоний.
Следует иметь в виду, что редкие металлы не обязательно содержатся в земной коре в малых количествах. Металлы этой подгруппы получили название «редкие» главным образом потому, что они рассеяны в большом количестве других пород. Отсюда невелика концентрация этих металлов в рудах, а месторождения руд редких металлов имеют небольшие размеры (запасы).
Исходным сырьём для производства абсолютного большинства металлов являются минеральные образования, добываемые из земной коры, - руды.
Рудой называется горная порода, содержащая металл в такой форме и в таком количестве, что его экономически выгодно извлекать на данном уровне развития техники.
Руда любого металла состоит обычно из двух основных частей: рудного минерала, представляющего химическое соединение металла с другим (другими) элементом, механически перемешанного с соединениями, не содержащими данного металла - пустой породой.
руда = рудный минерал + пустая порода.
Все рудные минералы (более 3000) по вещественному составу подразделяются на :
I группа самородные (золото, платина, S, углерод)
II группа сульфидные – это минералы, в состав которых входит сера.
III группа несульфидные (окисленные), которые подразделяются на:
окислы (Fe3O4 – магнетит, SiO2 – кварц, SnO3 – касситерит)
силикаты (цирконий ZrSiO4)
карбонаты (РbСО3 – церрусит)
IV группа смешанные
Таким образом, npoцecc получения металла из руды включает две последовательные операции:
а) отделение рудного минерала от пустой породы – это достигается в процессе обогащения на обогатительных фабриках;
б) отделение металла от элемента, с которым он образует химическое соединение – это происходит в пиро- или гидрометаллургических процессах на металлургических предприятиях.
Характеристика руд цветных металлов
1. Руды цветных металлов являются комплексным сырьем. В рудах цветных металлов, наряду с основными металлами (медью, свинцом, цинком, никелем, кобальтом, молибденом, вольфрамом, висмутом), присутствуют золото, серебро, кадмий, индий, селен, теллур, рений, таллий, галлий, редкие земли, сера, барит, флюорит, кварц и другие элементы и минералы. Основная масса (80–85 %) цветных металлов в рудах представлена сульфидными минералами. Благородные металлы и примеси присутствуют в рудах главным образом в виде изоморфных примесей и тонкодисперсных включений в минералы основных и сопутствующих полезных компонентов. Несульфидные минералы представлены оксидами, силикатами, карбонатами, фосфатами и другими породными минералами в различном их соотношении.
2. Низкое содержание цветных металлов в рудах. Среднее содержание меди в медно-порфировых рудах в настоящее время составляет около 1 %, в медистых песчаниках – 2 %, в медно-колчеданных рудах – 1,4 %. В этих же пределах изменяются средние содержания свинца, никеля и
цинка. Содержания сопутствующих металлов при этом оцениваются обычно десятыми, сотыми и тысячными долями процента. Постоянный рост производства и потребления основных цветных металлов (меди, свинца, цинка, никеля) сопровождается непрерывным снижением их содержания в перерабатываемых рудах. Например, среднее содержание меди в медных рудах за последние 90 лет уменьшилось в 10 раз и составляет в настоящее время около 1,3 %.
3. Руды цветных металлов весьма разнообразны и изменчивы по химическому и минеральному составу, характеру вкрапленности и степени окисленности, крепости, дробимости, измельчаемости, обогатимости. Различные сочетания свойств руд создают большое многообразие их типов и разновидностей, отличающихся между собой важными технологическими свойствами по отношению к процессам дробления, измельчения, обогащения и др.
4. Руды цветных металлов отличаются сложными горно-геологическими условиями залегания. Месторождения цветных металлов обычно отличаются сравнительно небольшими запасами, сложностью и разобщенностью рудных тел, весьма крепкими рудами и вмещающими породами, предопределяющими большую трудоемкость при их разработке.
5. Руды ЦМ отличает тонкая дисперсная связь ценных компонентов с вмещающими горными породами и между собой. Как правило, руды ЦМ требуют хорошего измельчения, чтобы разрушить эти связи.
Цель подготовки руд к металлургическому переделу
Перерабатываемые в металлургическом переделе руды должны иметь:
высокое содержание металла (или, что то же самое, минимальное содержание пустой породы);
оптимальный состав пустой породы;
минимальное содержание вредных примесей;
требуемый для данной технологии гранулометрический состав руды;
максимальную однородность химического и гранулометрического составов рудного материала.
Добытые из недр земли руды, как правило, не отвечают этим требованиям и нуждаются в предварительной обработке, представляющей часто целый комплекс специальных операций.
Обогащением руды называется комплекс процессов, с помощью которых от руды существующими физическими и физико-химическими методами отделяют минералы пустой породы.
В результате обогащения происходит:
1. концентрация ценного компонента в десятки, сотни раз;
2. с помощью обогащения удаляются вредные примеси из концентратов, что облегчает металлургический или другой последующий передел;
3. сокращаются затраты на перевозки материала потребителю (за счет сокращения общей массы продукта);
4. переработка обогащенного материала производится с большим эффектом (увеличивается производительность последующего передела, уменьшается расход топлива и электроэнергии, снижаются потери ценного компонента с отходами производства, повышается извлечение).
Продуктами обогащения являются:
концентрат - материал, содержащий полезного минерала больше, чем его было в исходной руде. При обогащении многокомпонентных полезных ископаемых получают 2 и более концентратов. Концентраты должны удовлетворять ГОСТу или техническим условиям.
хвосты - материал, состоящий в основном из пустой породы и содержащий небольшое количество полезного минерала. Это отход обогащения. Но отвальные хвосты удается получить не всегда. Если хвосты содержат много полезного минерала, их подвергают повторному обогащению один или несколько раз, в результате чего получают отвальные хвосты и продукт, обогащенный полезным минералом. Это продукты более бедные, чем основные концентраты. Они занимают по содержанию полезного элемента промежуточное положение между концентратом и хвостами – и называются промежуточными продуктами (промпродукты), которые подвергаются дополнительному обогащению.
Обогатительная фабрика – это промежуточное звено между рудником и металлургическим заводом. Мощность фабрики определяется обычно количеством переработанной руды и бывает различна - от десятков тыс. т до нескольких млн. т в год.
Руда различной крупности (D = 1500-2000 мм – характерна для открытых горных работ, D = 500-600 мм – характерна для подземных горных работ), поступающая с рудника, на обогатительной фабрике проходит различные процессы, которые по своему назначению можно разделить на:
- подготовительные;
- собственно обогатительные;
- вспомогательные.
Подготовительные процессы включают, прежде всего, операции уменьшения размеров кусков руды: дробление и измельчение и связанные с ними грохочение и классификацию. Конечная крупность измельчения определяется крупностью вкрапленности минералов, которые надо раскрыть. Именно это позволяет выделить их в самостоятельный продукт. В зависимости от технологии конечная крупность минеральных частиц может достигать от 2-3 мм до 40 микрон. Операции грохочения и классификации позволяют отделить крупные куски минералов от мелких.
К собственно обогатительным процессам относятся процессы разделения рудных минералов и пустой породы и выделения их в отдельные продукты. Основаны эти процессы на различных физических свойствах рудных минералов и минералов пустой породы – цвете, блеске, магнитных свойствах, электропроводности, плотности, смачиваемости и т.д. К этим процессам относятся гравитационное обогащение, флотация, магнитная и электрическая сепарация и другие процессы. Задача основных процессов обогащения − разделить полезный минерал и пустую породу. Это и является обогатительным процессом.
Основные группы обогатительных процессов:
Гравитационные методы обогащения. Это разделение минеральных частиц, как правило, в потоке воды, основанное на различной плотности минералов. Этот метод является основным для обогащения золотосодержащих, платиновых, вольфрамовых и оловянных руд.
Флотация – разделение минеральных частиц, основанное на их различной смачиваемости водой. Это основной метод при обогащении медных, цинковых, свинцовых, молибденовых, никелевых руд.
Магнитное обогащение – разделение минеральных частиц в магнитном поле, основанное на различных магнитных свойствах минералов. Это основной метод при обогащении железных руд и руд редких металлов.
Электрическое обогащение – основано на разной электропроводности минеральных частиц.
Радиометрическое обогащение – основано на различной радиоактивности разделяемых минералов - естественной или наведенной.
Вспомогательные процессы. Поскольку большая часть основных методов проводится в воде, продукты, получаемые в результате, содержат много влаги - до 80%. Требования пирометаллургического производства – от 5 до 10% влажности, поэтому на обогатительных фабриках товарная продукция подвергается обезвоживанию с помощью трех последовательно идущих операций:
Сгущение
Фильтрация
Сушка
Совокупность и последовательность операций, которым подвергается руда при обогащении, путь движения руды и продуктов обогащения от одной операции к другой называются технологической схемой обогащения.
Итак, в результате обогащения руды получаем продукт, поступающий на металлургическое производство – концентрат. Концентрат содержит металла гораздо больше (в десятки раз), чем исходная руда, что позволяет его перерабатывать с большей эффективностью.
Основные понятия и определения металлургических процессов
Методы получения металлов из руд (концентратов) можно разделить на пирометаллургические и гидрометаллургические.
Пирометаллургические процессы - это химические процессы, протекающие в металлургических агрегатах при высоких (700-2000°С) температурах. Это различные виды плавок и обжига.
Принцип гидрометаллургического способа переработки руд заключается в следующем: извлекаемый металл переводится в раствор, раствор отделяется от твердого остатка (пустой породы), а затем металл выделяется из раствора в форме элемента или химического соединения. Это процессы выщелачивания, сорбции, экстракции, цементации и т.д.
В металлургическую переработку, как правило, поступает не один металлосодержащий материал (напр., концентрат), а смесь разных сортов рудного сырья с флюсами и оборотами. Смесь поступающих в переработку материалов (без топлива) называется шихтой. Общие требования к качеству металлургических шихт сводятся к следующим:
Постоянство химического состава
Однородность по химическому, минералогическому и гранулометрическому составу,
Оптимальная крупность компонентов шихты,
Оптимальная влажность.
Кроме рудного сырья в металлургии широко используют другие полезные ископаемые, в первую очередь – флюсы и топливо.
Флюсами называются минеральные добавки, используемые в пирометаллургических процессах для корректирования состава получающихся шлаков. Как правило, в качестве флюсов используют кварц и известняк.
Кварц является кислым флюсом, состоящим в основном из кремнезема SiO2. Кроме SiO2 в кварце могут присутствовать в небольших количествах другие оксиды, например CaO, Al2O3, Fe2O3 и другие. Содержание SiO2 в кварцитах может меняться в широких пределах – от 60 до 95 %. Чем чище используемый кварц, тем меньше его расход, выход отвальных шлаков и потери ценных металлов.
Известняк, состоящий в основном из CaCO3, относится к основным флюсам. При нагревании до температур выше 900-1000 С, он разлагается по реакции
CaCO3 -> CaO+CO2.
Образующийся при разложении известняка оксид кальция и является флюсующим реагентом. Содержание СаО в чистом СаСО3 равно 56%. На практике используют известняки, содержащие 45-52% СаО, остальное приходится на долю примесных оксидов: MgO, SiO2, Fe2O3 и другие. Известняк в больших количествах обычно применяют при переработке шихт с повышенным содержанием кремнезема.
Расходование больших количеств топлива в металлургических процессах обусловлено широким применением процессов, проводимых при высоких температурах.
Под топливом понимают вещества, имеющие в своём составе горючие компоненты, при химическом взаимодействии которых с кислородом выделяется большое количество тепла.
Топливом для металлургических печей, как правило, служат искусственно приготовленные виды топлив: кокс, мазут, коксовый и доменный газ - они лишены многих недостатков, присущих естественным видам топлив. В металлургической промышленности используют все виды топлива – твердое, жидкое и газообразное.
Кокс – наиболее широко используется как твердое топливо в металлургических (особенно шахтных и доменных) печах. Это продукт сухой перегонки без доступа воздуха специальных сортов каменного угля (т.н. «коксующиеся угли») при высоких температурах 1100-1200 С. Процесс идет 12-15 ч и из 1 т угольной шихты получается 700-750 кг кокса. Кокс содержит порядка 86-88 % углерода, 9-12 % золы, 0,5-2% серы, 0,8-1,5 % летучих веществ. Серьезные требования предъявляются к прочности кокса.
Мазут – жидкое топливо. Это остаток после крекинга (перегонки нефти). Он состоит из тяжелых фракций углеводородов. Содержание углерода в нем 83-85%, 10-11 % водорода. Остальное – зола, влага, сера. Сложность использования мазута в качестве топлива – необходимость его предварительного подогрева до 70-90 С для снижения вязкости. Только тогда возможно его распыление или сжигание.
Газообразные виды топлива – природный газ, доменный и коксовый газ и их смеси.
Горение топлива осуществляется за счет кислорода дутья: воздуха (21% кислорода), смеси воздуха с кислородом (обогащенное дутье) или технологического кислорода (95-98% кислорода). Эффективность сжигания топлива снижается при высокой его влажности и большом содержании золы. Влага требует затрат тепла на испарение и нагрев ее паров до температур горения, а зола ухудшает качество топлива и условия его сжигания. Для получения высоких температур в металлургии стремятся использовать топливо с высокой теплотворной способностью и низким содержанием золы.
Этим требованиям в наибольшей степени удовлетворяет природный газ (теплота сгорания 35000-37700 кДж/кг), мазут, кокс (26000-32000 кДж/кг) и высококалорийный каменный уголь (21000-29000 кДж/кг).
Продукты пирометаллургических процессов
Основными продуктами пирометаллургических процессов являются штейн, шлак и газ.
Шлаки представляют собой сложный сплав оксидов. Они формируются из оксидов пустой породы исходного сырья и специально вводимых флюсов, и служат средой для концентрирования компонентов пустой породы и их отделения от ценных металлов. Роль шлаков в пирометаллургических процессах очень велика.
В шлаковых расплавах протекают важнейшие физико-химические превращения. Вследствие обычно низкого содержания ценных компонентов в исходном сырье и высокого содержания в нем пустой породы, пирометаллургия характеризуется высоким выходом шлаков – 70-250% от массы концентрата. Выход шлака тем выше, чем беднее перерабатываемое сырье и чем больше расход флюсов. По этой причине свойства шлака фактически определяют все основные показатели металлургического производства – удельную производительность металлургических агрегатов, расход топлива или электроэнергии, эксплуатационные затраты и, в конечном итоге, себестоимость (экономику) передела.
Жидкие шлаки, контактирующие в ходе процесса со штейнами или черновыми металлами, всегда содержат некоторое количество извлекаемых металлов. Хотя содержание меди, никеля и других сопутствующих металлов в шлаках относительно невелико (0,1-1,5%), из-за большого выхода шлаков абсолютные потери ценных компонентов значительны. Если принять во внимание исключительно высокие затраты на добычу рудного сырья, достигающие в цветной металлургии 60-70% от общих затрат, вполне понятной становится острота проблемы снижения потерь металлов с отвальными шлаками.
Состав шлаков и температура плавления. Важнейшими оксидами, составляющими основу шлаков являются SiO2, FeO+Fe3O4, CaO, MgO, Al2O3. В жидких шлаках растворяется значительное количество сульфидов, главным образом – FeS. В связи с этим в шлаках часто содержится 2 и более процента серы. Каждый из составляющих шлак оксидов имеет свою температуру плавления. Поэтому промышленные шлаки, имеющие сложный многокомпонентный состав, в большинстве случаев плавятся в интервале температур 1050 С-1150 С. Плотность шлаков возрастает с увеличением в содержания в шлаках более тяжелых компонентов (FeO и Fe3O4) и снижается при добавке более легких (SiO2, CaO, MgO и др.) Плотность шлаков, образующихся при плавке медного и никелевого сырья на штейн составляет 2800-3700 кг/м3. С повышением температуры плотность шлаковых расплавов прямо пропорционально понижается. В среднем рост температуры на 100 С снижает плотность шлака на 200-300 кг/м3.
Отвальные шлаки должны содержать не более 0,1-0,5% меди либо никеля. Если содержание металла выше, шлаки называются оборотными и поступают обратно в процесс.
Штейн представляет собой сплав сульфидов тяжелых цветных металлов с сульфидом железа, содержащий так же некоторое количество растворенных оксидов, главным образом – оксидов железа. В большинстве случаев (кроме чисто никелевых штейнов), штейн содержит так же благородные металлы, которые с высокой полнотой коллектируются в штейновых расплавах.
При проведении плавки в восстановительных условиях получаются металлизированные штейны, содержащие, кроме сульфидов, растворенные в них металлы. В практике цветной металлургии получают медные, медно-никелевые, никелевые и полиметаллические штейны. Они образуются в жидком состоянии и практически не смешиваются с жидкими шлаками, что позволяет отделять их друг от друга отстаиванием. Для успешного разделения штейнов и шлаков необходимо, чтобы разность их плотностей была не менее 1г/см3. Чем она будет больше, тем быстрее идет отстаивание. Медный штейн представляет собой расплав, состоящий в основном из сульфидов меди и железа (Cu2S, FeS) с небольшим содержанием сульфидов других металлов, магнетита (Fe3O4) и других примесей.
Большинство пирометаллургических процессов характеризуется образованием больших количеств газов и пылей. Эти два продукта удаляются из печи совместно. Пыли и газы пирометаллургических технологий имеют, как правило, большую материальную ценность, но служат источником загрязнения окружающей среды. Поэтому их улавливание, использование и обезвреживание являются важнейшими проблемами современного металлургического производства. Отходящие металлургические газы делятся на технологические – образующиеся за счет протекания химических реакций и топочные, являющиеся продуктами сжигания топлива. Состав и количество отходящих газов полностью определяется типом перерабатываемого сырья и видом применяемого металлургического процесса. Основными компонентами технологических газов являются SO2, CO2, CO и пары воды. В отдельных металлургических процессах могут выделятся газообразный хлор, мышьяковистые и другие химические соединения. При сжигании топлива преимущественно образуется СО2, СО и Н2О. Кроме того, в отходящих газах обязательно присутствуют азот и свободный кислород, поступающие в избытке с дутьем и за счет подсоса воздуха. В большинстве случаев, отходящие газы покидают металлургический агрегат нагретыми до температуры 800-1300 градусов и более.
Пыли, образующиеся в металлургических процессах, условно можно классифицировать на грубые и тонкие. Образование грубых пылей связано с выносом газовым потоком мелких частиц перерабатываемой шихты, или продукта металлургической переработки (напр., при обжиге). Крупность и количество этих пылей определяется скоростью газового потока и крупностью перерабатываемого материала. Размер пылей – от 3-10 мкм до нескольких миллиметров. Химический состав грубых пылей обычно идентичен составу исходного материала, из которого они образовались. Их обычно возвращают в оборот или объединяют с продуктами данного процесса.
Тонкие пыли образуются преимущественно за счет улетучивания (возгонки) легколетучих компонентов (металлов или химических соединений). Пары, получающиеся при этом, уносятся газовым потоком и при последующем охлаждении газов конденсируются с образованием твердых частиц или жидких капель. Размер частиц тонких пылей, называемых возгонами, в момент образования составляет десятые и сотые доли микрометра. По химическому составу возгоны резко отличаются от исходного материала, и обогащены летучими компонентами – цинком, кадмием, свинцом, германием, индием и другими редкими рассеянными элементами. Они являются очень ценным сырьем для извлечения этих элементов и подвергаются самостоятельной дальнейшей переработке.
Очистка отходящих газов от пыли необходима и для предотвращения загрязнения окружающей среды и для сокращения потерь ценных компонентов сырья. Основой законодательства об охране атмосферного воздуха являются предельно допустимые концентрации вредных веществ (ПДК). ПДК количественно характеризует такое содержание вредных веществ в атмосферном воздухе, при котором на человека и окружающую среду не оказывается ни прямого, ни косвенного воздействия. Под прямым воздействием имеется в виду временное раздражающее действие на организм, вызывающее кашель, головную боль, неприятный запах и т.п. Косвенное воздействие – это такие изменения в окружающей среде, которые, не оказывая вредного влияния на организм, ухудшают обычные условия обитания – например, увеличивают число туманных дней в году, поражают зеленые насаждения и т.п.
Выбор метода очистки газов от пыли определяется свойствами очищаемого газа и пыли. Наиболее широко применяются следующие методы:
1.Осаждение частиц под действием силы тяжести
2.Очистка от пыли под действием центробежной силы, возникающей при изменении направления газового потока
3.Фильтрация
4.Мокрое пылеулавливание
5.Электрическая очистка газов.
ПРОЦЕССЫ И АППАРАТЫ ГИДРОМЕТАЛЛУРГИИ
Принцип гидрометаллургического способа переработки руд заключается в переводе в раствор извлекаемого металла, с последующим выделением его из раствора в чистом виде или в виде химического соединения. Пустая порода при этом остается в твердом остатке (нерастворившейся части).
Главные достоинства, благодаря которым гидрометаллургические методы получения металлов получают все более широкое распространение, заключаются
- в возможности избирательного извлечения металлов из бедных и труднообогатимых руд (иногда непосредственно из рудного тела - подземное выщелачивание меди, урана) с минимальными теплоэнергетическими затратами - при невысоких температурах (до 300°С);
- в отсутствии загрязнения атмосферы вредными газовыми выбросами;
- в более благоприятных санитарно-гигиенических условиях труда обслуживающего персонала по сравнению с пирометаллургической технологией,
- в более высоком уровне механизации и автоматизации.
Основными недостатками гидрометаллургических процессов являются:
- громоздкость технологии в целом в связи с большим объемом растворов и большим количеством и разнообразием применяемой аппаратуры
- высокие капитальные затраты на строительство гидрометаллургических цехов и заводов. Этот недостаток частично устраняется в районах с теплым или жарким климатом, когда установки можно располагать под открытым небом или в зданиях легкого типа,
- необходимостью обезвреживания больших объемов сточных вод.
Основными этапами гидрометаллургической технологии являются:
подготовка рудного сырья к переделу. На этом этапе происходит механическая обработка материала – дробление и измельчение с целью раскрытия ценных минералов и создания большей удельной поверхности выщелачивания твердой фазы. Если руду можно обогатить – руда направляется, например, на флотацию.
Затем производится изменение химического состава исходного материала с целью перевода малорастворимых соединений в растворимые. Эти операции называют разложением или вскрытием рудного материала. К ним относятся:
- окислительный обжиг сульфидного сырья (перевод сульфидов в оксиды при Т=1100-1400К: MeS+1,5O2=MeO+SO2) - используют в производстве меди, цинка
- сульфатизирующий обжиг (Т=880-900К: MeS+2O2=MeSO4) - используют в производстве меди, кобальта
- хлорирующий обжиг (Т=1100-1400К: MeS+2O2+2NaCl=MeCl2+Na2SO4) – для сырья с невысоким содержанием ценных компонентов,
- восстановительный обжиг (MeO+восстановитель(С,Н2,SO2)=Me+ВO) - используют в производстве никеля из окисл.руд, кобальта, редкозем.металлов
- спекание с солями или щелочными реагентами (содой, известью, хлоридами и т.д.) – в производстве молибдена, вольфрама, ванадия, алюминия.
2) перевод в раствор извлекаемого металла – выщелачивание. Выщелачивание – это перевод металла из рудного материала (или продукта, полученного в результате подготовительных операций) в раствор.
разделение раствора и твердого остатка. Эта стадия включает в себя операции сгущения, фильтрации и промывки твердой фазы.
химическая очистка раствора от нежелательных примесей и повышение концентрации раствора. Стадия включает операции очистки растворов различными методами – осаждением малорастворимых соединений, удаление примесей сорбцией с помощью ионообменных смол, экстракцией. Затем идут операции концентрирования раствора по извлекаемому компоненту выпаркой, ионным обменом или экстракцией органическими растворителями.
выделение металла из раствора. На этой стадии извлекаемый металл выделяется из раствора, полученного после выщелачивания, с помощью различных методов: осаждения малорастворимых соединений, восстановления газообразными реагентами, цементацией , электролизом и др.
Наиболее важными, из приведенных выше операций гидрометаллургического передела, являются выщелачивание и выделение из раствора целевого металла.
Процессы выщелачивания классифицируются по:
- типу растворителя (щелочное (растворитель - водные растворы щелочей: NaOH; NH4OH), кислотное (растворитель - водные растворы минеральных кислот: H2S04; НС1; HNO3), солевое (растворитель - водные растворы минеральных солей : Na2C03 и др.), нейтральное (Н2О) )
- способу осуществления (периодическое, непрерывное, одно-многостадийное, прямоточное и противоточное),
- окислительно-восстановительным условиям среды (окислительное, восстановительное, нейтральное),
- аппаратурному оформлению (кучное, подземное выщелачивание, перколяционное (просачиванием), агитационное),
- величине давления (при атмосферном или избыточном (автоклавное) давлении),
- использованию подготовительных операций (прямое или с предварительной подготовкой).
Характеристика растворителей
Выбор растворителя во многом определяет показатели и экономичность процесса выщелачивания. При этом учитывают:
- химический, минералогический и фазовый состав сырья,
- агрессивность растворителя по отношению к материалам используемой аппаратуры,
- селективность воздействия на извлекаемый металл,
- возможность регенерации на стадии осаждения металлов,
- токсичность, доступность, стоимость.
Вода является наиболее доступным, дешевым и безопасным растворителем. Вода применяется для выщелачивания огарков сульфатизирующего и хлорирующего обжигов.
Водные растворы солей. В процессах выщелачивания применяют следующие растворы солей – FeCl3, Fe2(SO4)3 , NaCl, NaCN и др. Соли являются достаточно эффективными растворителями, особенно при Т>100 С, но они дороги, получаемые растворы загрязнены балластными солями, что осложняет регенерацию растворителя и извлечение ценного компонента.
Кислоты. В гидрометаллургии наиболее часто используют серную кислоту Н2SO4. Серная кислота обладает высокой вскрывающей способностью, оказывает сравнительно слабое коррозионное воздействие на гидрометаллургическую аппаратуру, она доступна и отличается низкой стоимостью (техническая кислота стоит около 10 000-15 000 руб/т). При последующем электрохимическом или автоклавном осаждении металлов из сульфатных растворов удается обеспечить регенерацию кислоты. Серная кислота применяется при выщелачивании окисленных и смешанных медных руд, уранового сырья, окисленных никелевых руд и т.д.
Азотная НNО3 и соляная НCl кислоты более дороги, обеспечивают меньшую селективность, более агрессивны к материалам используемой аппаратуры.
Плавиковая кислота HF имеет ограниченное применение ввиду высокой стоимости (150 000-200 000 руб/т), токсичности, повышенной коррозионной активности. Ее используют для вскрытия особо упорного редкометалльного сырья.
«Царская водка» (смесь 3-4 частей НCl и 1 части НNО3) применяется для выщелачивания платиновых руд и при рафинировании золота и серебра.
Щелочи. Наиболее часто используемые реагенты – каустическая сода (техническое название NaОН), водный раствор аммиака (NН4ОН) и др. Щелочи обладают высокой избирательностью при выщелачивании металлов, низкой коррозионной активностью, особенно эффективны при переработке сырья с повышенным содержанием основных пород. Каустическая сода применяется при переработке бокситов (процесс Байера), вольфрамосодержащих руд и концентратов. Раствор аммиака является высокоселективным реагентом при переработке сырья, содержащего Cu, Zn, Ni, Co, Cd, Ag в металлической, оксидной и сульфатной формах.
Щелочные реагенты дороги, регенерация их очень сложна, возникают проблемы в цикле обезвоживания из-за повышенной вязкости жидкой фазы. Аммиак отличается повышенной токсичностью и летучестью, способностью к образованию взрыво- и пожароопасных смесей с кислородом, поэтому его применение требует герметичной и более дорогой аппаратуры и хорошей системы утилизации газовых потоков.
Эффективность выщелачивания оценивается:
- извлечением – степенью перехода извлекаемого элемента в раствор по отношению к его содержанию в исходном сырье, %.
- скоростью процесса (масса извлекаемого элемента в единицу времени возрастает с увеличением температуры, концентрацией реагентов, интенсивностью перемешивания, удельной поверхности сырья),
- селективностью – степенью извлечения ценного элемента по отношению к сопутствующим примесям: чем меньше скорость и извлечение, тем выше селективность,
- удельным расходом реагента – расходом химиката на массовую единицу извлекаемого металла. Расход реагента растет с увеличением температуры, дисперсности сырья, продолжительностью выщелачивания (из-за развития побочных реагентопотребляющих процессов).
Выбор параметров выщелачивания определяется экономическими расчетами, как правило, на компромиссной основе, т.к.:
- чем больше извлечение, тем меньше скорость процесса, следовательно, дольше пребывание пульпы в реакторе, что требует больших объемов оборудования и капитальных затрат,
- чем больше тонина помола сырья, тем больше степень извлечения и скорость процесса, но больше затраты на доизмельчение и хуже разделение пульпы и затруднена фильтрация,
- чем выше температура и концентрация растворителя, тем больше извлечение и скорость процесса, но выше затраты на энергетику, хуже селективность процесса, сложнее перерабатывать полученные растворы и подбирать материал для изготовления реакторов.
Главной задачей технологов является подбор такого растворителя и таких условий выщелачивания (температуры, концентрации реагентов), при которых извлекаемый металл растворялся бы с максимальной полнотой и скоростью, а пустая порода и сопутствующие элементы либо вообще не растворялись, либо степень их перехода в раствор была бы невелика.
Металлургия меди
Общие сведения о меди
Медь – элемент VIII группы в Периодической системе, атомный номер – 29, атомная масса – 63,546. Медь имеет два валентных электрона и образует два ряда химических соединений – одновалентной и двухвалентной меди. Медь имеет розово-красный цвет и известна с глубокой древности, так как часто находится в свободном состоянии в виде самородной меди. Основные соединения меди - с серой и кислородом.
Плотность меди – 8,96 г/см3, температура плавления – 1083oС, температура кипения – 2600oС. ( Упругость паров меди при температуре плавления равна 0,012мм рт.ст., следовательно). Медь практически нелетуча при температурах металлургических процессов. (Теплоемкость меди при 20oС равна 385,48 Дж/(кг*К), теплопроводность – 394,279 Вт/(м*К), удельное сопротивление – 1,68*10-8 Ом*м). Наиболее ценным свойством меди является высокая электропроводность. Медь прекрасно проводит тепло, хотя хуже золота и серебра. Медь диамагнитна.
Химическая активность меди невелика. Медь при температуре менее 185oС с сухим воздухом и кислородом не взаимодействует. В присутствии влаги и CO2 на поверхности меди образуется зеленая пленка основного карбоната. При нагревании меди на воздухе идет ее поверхностное окисление; ниже 375oС образуется CuO, а при 375 - 1100oС – двухслойная окалина: в поверхностном слое CuO, а во внутреннем – Cu2O. Взаимодействие меди с кислородом в присутствии влаги отмечается уже при комнатной температуре. При низких температурах (100oС) на поверхности меди образуется пленка оксида меди (II) черного цвета. При высоких температурах скорость окисления меди значительно возрастает, и на поверхности образуется пленка оксида меди (I) красного цвета.
4Cu + O2 = 2Cu2O (выше 200o С при недостатке кислорода)
2Cu + O2 = 2CuO (400-500o С при избытке кислорода)
Медь – слабый восстановитель, не реагирует с водой, разбавленной хлороводородной кислотой. Переводится в раствор кислотами-неокислителями, или гидратом аммиака в присутствии О2, цианидом калия.
Окисляется концентрированными серной и азотной кислотами (царской водкой), кислородом, галогенами, халькогенами, оксидами неметаллов.
Cu + H2SO4 (конц., хол.) = CuO + SO2 + H2O
Cu + 2H2SO4 (конц., гор.) = CuSO4 + SO2 + 2H2O

2Cu + 2H2SO4 (разб.) + O2 (воздух) 2CuSO 4 + 2H2O
Медные минералы
В природе медь встречается в виде химических соединений (минералов) и в виде самородной металлической меди. Из 170 известных медьсодержащих минералов 17 используются в промышленных масштабах: самородная медь, борнит (Cu5FeS4 - пестрая медная руда), халькопирит (CuFeS2 - медный колчедан), халькозин (Cu2S - медный блеск), ковеллин (CuS), бурнонит (CuPbSbS3), блеклые руды, теннантит (Cu12As4S13), куприт (Cu2O), тенорит (CuO), малахит (Cu[CO3](OH)2), азурит (Cu3[CO3](OH)2) и др.
Из сульфидных медных минералов наиболее распространенными в природе являются халькопирит, или медный колчедан CuFeS2, халькозин(Cu2S) и ковеллин (CuS). Из окисленных медных минералов промышленное значение имеют малахит (CuCO3*Cu(OH)2) и азурит (2CuCO3*Cu(OH)2).
Медь занимает третье место в мире по объемам производства и потребления (после железа и алюминия). К основным производителям меди традиционно относятся Чили, Япония, Китай, Канада, Германия, Австралия, Польша и Россия, на долю которых приходится 63% мирового производства металла. На долю России приходится 5% производства рафинированной меди в мире.
Доля России в мировом потреблении меди достигла 4 %. Рынок потребления меди в России определяется спросом со стороны двух наиболее емких направлений (примерно в равном соотношении) – электротехнической промышленности (для производства кабельных изделий) и предприятий по обработке цветных металлов(для выпуска медного, латунного и бронзового проката, а так же фольги, порошка и бронзового литья). В производстве кабельной продукции используется более 45% меди.
Способы получения меди.
В металлургии известны два основных способа получения меди: пирометаллургический (плавка) и гидрометаллургический (выщелачивание). Сульфидные руды обогащают методом флотации и полученный концентрат подвергают пирометаллургической переработке, а окисленные руды перерабатывают гидрометаллургическим способом (кучное и подземное выщелачивание).
выплавка штейна (химическое обогащение).
Наиболее целесообразным способом освободится от основного количества пустой породы оказалась плавка медных концентратов с получением 2-х расплавов – штейна, содержащего сульфиды меди и железа (Cu2S, FeS) и шлака, состоящего из оксидов SiO2, Al2O3, CaO. Благодаря существенному различию по плотности (у штейна 4,8-5,3, а у шлака – около 2,8-3,2 г/см3), происходит практически полное разделение штейна и шлака. Возможность концентрации меди в штейне обусловливается следующими обстоятельствами:
Медь из всех тяжелых металлов, за исключением марганца, обладает наибольшим сродством к сере. В следствие этого, она в первую очередь связывает серу, независимо от того, в каких соединениях медь находится в руде, при этом образуется химическое соединение Cu2S, устойчивое при высоких температурах.
Железо, обладая большим сродством к кислороду, чем медь, легко окисляется и шлакуется кремнекислотой.
Оставшаяся после связывания всей меди сера соединяется с железом, с которым образует FeS – соединение, устойчивое при высоких температурах.
Cu2S и FeS легко растворяются одно в другом в любых пропорциях, образуя штейн.
Штейн почти не растворяется в силикатных шлаках, что дает возможность разделить отстаиванием расплавленный штейн и шлак.
Для получения хороших результатов плавки “на штейн” требуется определенное содержание в рудном материале серы, соответствующее примерно стехиометрическому соотношению в молекулах Cu2S и FeS. Медные концентраты, в которых концентрация серы превышает оптимальную, перед плавкой подвергаются окислительному обжигу для удаления избытка серы.
Обжиг - это пирометаллургический процесс, проводимый в интервале температур 600-1200оС с целью изменения химического и фазового состава перерабатываемого сырья. В металлургии меди наибольшее распространение получили окислительный и сульфатизирующий виды обжига.
Цель окислительного обжига – частичное удаление из обжигаемых материалов серы и перевод сульфидов железа в легкошлакуемые при последующей плавке оксиды. Предварительный обжиг высокосернистых руд и концентратов позволяет получать при последующей плавке относительно более богатый по содержанию меди штейн.
Сульфатизирующий обжиг применяют в гидрометаллургии меди для перевода извлекаемых металлов в водорастворимые сульфаты, а железа – в нерастворимые в воде оксиды. В общем виде окисление сульфидов при обжиге может быть выражено следующими основными реакциями:
2MeS+3O2->2MeO+2SO2
MeS+2O2->MeSO4
MeS+O2->Me+SO2
Обжиг медных руд и концентратов осуществляется в кипящем слое. Преимущество обжига в кипящем слое заключается в простоте конструкции печей, высокой производительности, возможности эффективного использования отходящих газов для производства серной кислоты, возможности полной автоматизации и механизации процесса.
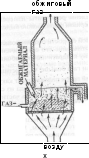 Принцип
обжига в кипящем слое состоит в следующем:
если через слой сыпучего материала
продувать снизу какой-либо газ, этот
слой при определенных параметрах дутья
будет разрыхляться до такого состояния,
что приобретает основные свойства
жидкости – подвижность, способность
перемешиваться, принимать форму сосуда
в который она помещена.
Принцип
обжига в кипящем слое состоит в следующем:
если через слой сыпучего материала
продувать снизу какой-либо газ, этот
слой при определенных параметрах дутья
будет разрыхляться до такого состояния,
что приобретает основные свойства
жидкости – подвижность, способность
перемешиваться, принимать форму сосуда
в который она помещена.
схема однокамерной печи кипящего слоя
продукт обжига
Такое состояние сыпучего материала называется псевдожидким. Оно наступает при определенной критической скорости восходящего газового потока, при которой подъемная сила газа будет равна общей массе сыпучего материала. Критическую скорость газа чаще всего определяют опытным путем, но ее можно рассчитать.
Для кипящего слоя характерно постоянство температуры во всех его точках – как и в кипящих жидкостях – что объясняется непрерывным интенсивным движением частиц во всех направлениях. Кипящий слой так же отличается интенсивным теплообменом. Теплопередача в кипящем слое в 4 раза больше чем в неподвижном слое, и в 13 раз больше чем в свободном потоке газа.
Состав огарка обжиговой печи в среднем следующий,%: 17-20 Cu, 25-36 Fe, 16-18 S, 3-4 Al2O3, 14-15 SiO2. Огарок направляют в процесс плавки на штейн, совместно с циклонной пылью, содержащей 10% меди и 16% серы, и пылью электрофильтров (8% меди, 12% серы).
Существенным недостатком обжига в кипящем слое является высокий вынос материала из агрегата. В зависимости от удельной производительности печи, а следовательно и от скорости движения газов, вынос пыли может достигать 85-90% от массы шихты, поэтому печи кипящего слоя оборудуют мощной системой пылеулавливания(циклоны, электрофильтры). Уносятся в первую очередь наиболее мелкие, хорошо обожженные частицы, поэтому пыль является готовым продуктом и объединяется с огарком.
Для получения штейна из медного концентрата используют следующие процессы:
1.Взвешенная плавка Оутокумпу
2.Кислородно-факельная плавка
3.Плавка в жидкой ванне (другое название – процесс Ванюкова)
4.Процессы Аусмелт-Айзасмелт
5.Процесс Норанда-Эль Тениенте
6.Процесс Мицубиси
7.Отражательная плавка
8.Шахтная плавка
В настоящее время в России применяют шахтную плавку, отражательную плавку, плавку в жидкой ванне (ПЖВ) и процесс Аусмелт.
Сущность основных химических процессов, протекающих в плавильном агрегате (при Т=1400 С), можно представить следующим образом:
Оксид СиО превращается в Си2О частично в результате диссоциации (Тразл=1000С), частично в результате восстановления:
6CuO + FeS = 3Cu2O +FeO + SO2
Из-за большего сродства к сере у меди, чем у железа происходит сульфатизация меди:
Cu2O + FeS = Cu2S + FeO
В итоге практически вся медь (99%) концентрируется в штейне.
Одновременно образуется второй расплав – шлак, состоящий в основном из силикатов железа.
3Fe3O4 + FeS + 5SiO2 = 5(Fe2SiO4) + SO2
Количества SiO2 из пустой породы концентрата не хватает для осуществления реакции в полном объеме. Недостающее количество SiO2 вводят в шихту в виде кварцита.
Шахтная плавка.
Шахтная печь представляет собой агрегат с вертикальным рабочим пространством, в который сверху загружают шихту и топливо, а снизу через специальные отверстия (фурмы) вдувают воздух. Зона наиболее высоких температур в шахтной печи располагается вблизи фурм и называется фокусом печи. Шихта, по мере расплавления опускается вниз, а на ее место загружают новые порции. Жидкие продукты плавки (штейн и шлак) непрерывно стекают во внутренний горн печи и далее выпускаются в отстойный горн. Печные газы имеют встречное (противоточное) шихте движение и удаляются в газоход через колошниковые устройства.
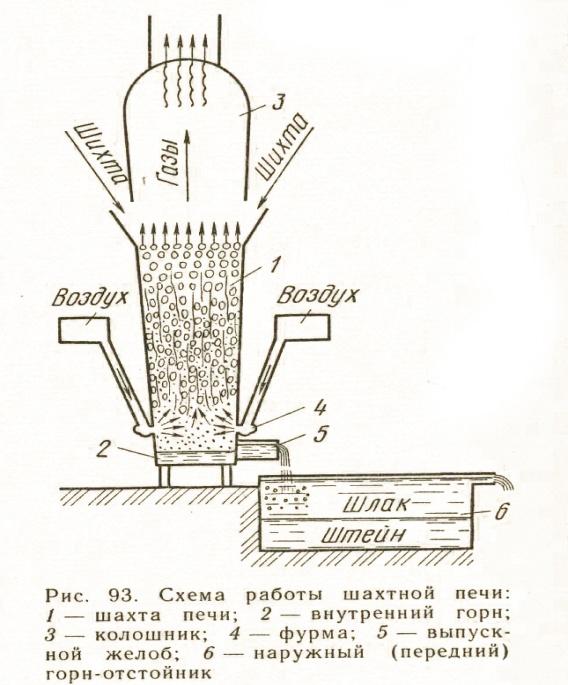
Шахтная плавка характеризуется следующими особенностями:
В шахтных печах можно перерабатывать только кусковый материал. Практикой установлено, что лучшие результаты шахтной плавки получаются при крупности кусков шихты 50-100мм. Допускается загрузка кусков меньших размеров, но не менее 10-20 мм. Для плавки в шахтных печах более мелких материалов(флотационных концентратов или рудной мелочи) их необходимо предварительно окусковывать агломерацией или брикетированием.
Углеродистым топливом при шахтной плавке может служить только металлургический кокс, являющийся наиболее дорогим и дефицитным видом топлива.
Химические превращения при шахтной плавке распределяются следующим образом: в верхней части шахты развиваются главным образом эндотермические реакции; в нижней – экзотермические(реакции горения и окисления, шлакообразования и др.).
Высота шахтных печей медной плавки от пода до колошника, при высоте столба шихты 4-5 м, составляет 6-8 м. Длина – от 4 до 15 м. Шахта печи собрана из отдельных кессонов, связанных между собой болтами. Кессоны представляют собой коробки, сваренные из котельного железа. Толщина внутренней стенки кессона – 10-20, наружной – 8-10 мм. Толщина слоя циркулирующей в кессоне воды составляет 100-120 мм. Температура поступающей в кессоны воды обычно составляет 35-45С, а отводится с температурой 45-55С. Под и стенки внутреннего горна изготовлены из огнеупорного кирпича.
Штейн шахтной плавки содержит 30-40% меди, 23-25% серы, 2-4% цинка, 0,5-1% свинца, 5% кислорода, 20-25% железа.
Плавка в жидкой ванне (ПЖВ).
ПЖВ – автогенный процесс плавки сульфидных медных и медно-цинковых концентратов. Процесс плавки разрабатывался под руководством проф.А.В. Ванюкова. Соответственно, агрегат стали называть печь Ванюкова. Для осуществления процесса плавки предложено использовать частично кессонированную печь шахтного типа. Длина печи составляет от 10 до 30 м и более, ширина печи составляет 2,5 – 3 м. Высота шахты – 6-6,5 м.
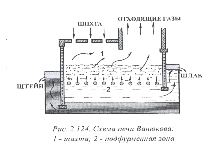
Отличительной особенностью конструкции печи является высокое расположение дутьевых фурм над подом (1,5-2м). Содержание кислорода в дутье составляет 40-90%.
В печи можно плавить как мелкие материалы, так и кусковую шихту. Шлак и штейн выпускаются раздельно из нижней части ванны с помощью сифонов. Характерной особенностью плавки в жидкой ванне, отличающей ее от всех других процессов, является то, что плавление и окисление сульфидов осуществляется в ванне шлака, а не штейна, и шлак движется в печи не в горизонтальном направлении, как это имеет место во всех известных плавки, а в вертикальном – сверху вниз. Горизонтальной плоскостью по осям фурм расплав печи делится на две зоны – верхнюю, надфурменную, барботируемую, и нижнюю, подфурменную, где расплав находится в относительно спокойном состоянии.
В надфурменной зоне осуществляется плавление, растворение тугоплавких составляющих шихты, окисление сульфидов и укрупнение мелких сульфидных частиц. Крупные капли сульфидов быстро оседают в слое шлака, многократно промывая шлак за время его движения сверху вниз в подфурменной зоне.
Высокая степень использования кислорода обеспечивает простое управление составом штейна и соотношением количеств подаваемого через фурмы кислорода и загружаемых за то же время концентратов. Состав штейна можно регулировать в широком диапазоне вплоть до получения черновой меди. Потери меди со шлаком начинают резко возрастать, когда ее содержание в штейне превысит 60%, поэтому при плавке на штейн увеличивать содержание меди в штейне свыше 50-55% не целесообразно.
При получении же черновой меди в технологическую схему должна обязательно включаться операция обеднения шлаков. Из-за малого уноса шихтовых материалов возгоны характеризуются высоким содержанием ценных летучих компонентов: свинец, рений, германий, мышьяк, сурьма, селен, таллий, причем переход их в возгоны тем выше, чем богаче получаются штейны. Благородные металлы практически полностью переходят в штейн. Выпуск штейна и шлака из печи ведется непрерывно через сифоны. Уровень штейна в печи регулируют таким образом, чтобы он перекрывал переток в штейновый сифон на 100-150мм.
Штейн из печи непрерывно выпускают в миксер, откуда, по мере необходимости, его передают ковшами на конвертирование. Шлак поступает в небольшой отстойник, необходимое время отстаивания – 30-60 минут.
Показатели процесса:
Содержание меди в штейне 45-55%
SiO2 в шлаке 30-32%
Меди в шлаке 0,5-1,6%
SO2 в газах 20-40%
Содержание кислорода в дутье 60-90%
Пылевынос менее 1%
Расход условного топлива до 2%.
Отражательная плавка медных концентратов.
Сущность отражательной плавки сульфидных концентратов на штейн заключается в том, что шихта плавится за счет тепла от сжигания углеродистого топлива в газовом пространстве над ванной расплавов в печи с горизонтально расположенным рабочим пространством.
Шихту в печь загружают на ванну, или на откосы вдоль боковых стен печи. Раскаленные топочные газы, проходя над поверхностью ванны и шихты, нагревают их, а так же стены и свод и покидают печь, имея еще сравнительно высокую температуру (выше температуры плавления шлака). Нагреваясь постепенно до высокой температуры, шихта плавится. Металлы, обладающие высоким сродством к кислороду, при этом концентрируются в оксидном расплаве - шлаке. Медь, никель, благородные металлы и часть железа и серы переходят в сульфидную фазу – штейн. Обладая ничтожной взаимной растворимостью и различной плотностью, продукты плавки при отстаивании разделяются на два слоя. Таким образом, происходит перевод основной массы пустой породы в шлак и концентрация ценных компонентов в штейне.
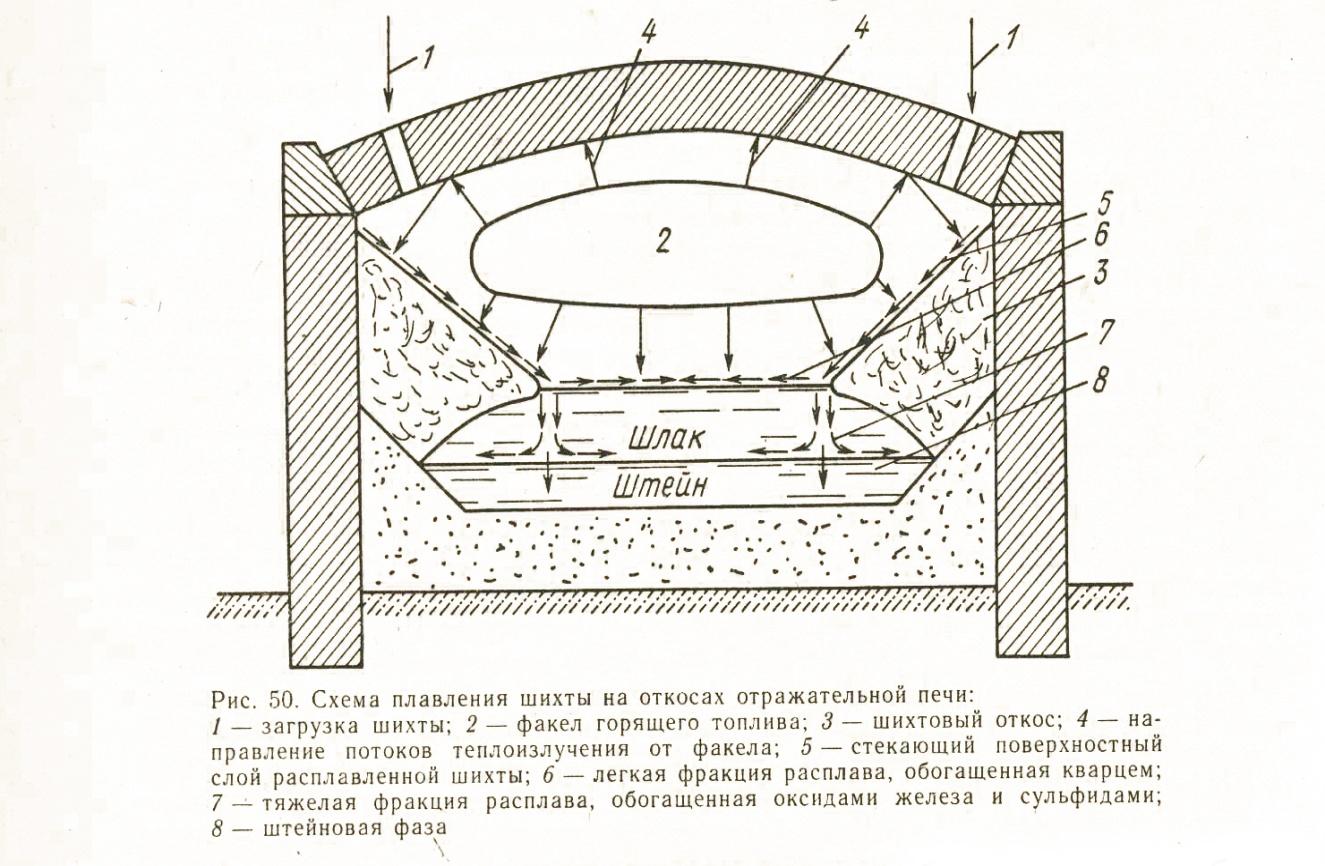
Современные отражательные печи, как правило, имеют длину 30-33 метра, ширину 8-10 метров и площадь пода 240-300 м2, в таких печах плавят в сутки 1000-1500 тонн твердой шихты.
Для отопления отражательной печи используют угли (в виде угольной пыли), жидкое топливо и природный газ. Газ или угольную пыль сжигают при помощи горелок, а мазут – с помощью форсунок. Воздух для вдувания и сжигания топлива обогащают кислородом до содержания 23-28%, и иногда подогревают до 200-400С.
Наиболее распространенной реакцией является реакция взаимодействия закиси меди с сернистым железом:
Cu2O+FeS->Cu2S+FeO
Медные штейны отражательной плавки содержат от 17 до 63% меди, что связано с большими колебаниями содержания меди в исходных концентратах. В зависимости от состава перерабатываемого сырья штейны могут содержать до 5% цинка, до 2% свинца, 1,5-2,5% никеля, благородные металлы, редкие и рассеянные элементы. Содержание золота в штейнах может достигать тысячных долей процента. Содержание серы – 24-27%. Содержание меди в отвальных шлаках отражательных печей составляет 0,3-0,6%. Отходящие газы отражательных печей обычно содержат менее 1-1,5% SO2. Запыленность отходящих газов отражательных печей при плавке сырой шихты составляет 5-10%, а при плавке огарков – 15-30 г/м3. Потери меди и других ценных компонентов при отражательной плавки происходят с неуловленной пылью, капельками штейна, удерживаемыми на поверхности шлакового расплава, и с отвальными шлаками. Из перечисленных выше причин потерь металлов, наибольшая доля приходится на потерю с отвальными шлаками, причем медь теряется как в форме растворенных соединений с металлами, так и в виде тонкой механической взвеси сульфидов.
Процесс плавки медных концентратов в барботируемой ванне с погружной фурмой ( фирм Аусмелт, Айзасмелт)
Отличительной особенностью процесса Аусмелт является применение фурмы с воздушным охлаждением. Диаметр фурмы 600 мм, высота 13 м.
Медный концентрат и флюсы непрерывно загружают через отверстие в своде печи в штейно-шлаковую ванну, в которую через фурму подается воздушно-кислородная смесь, воздух, природный газ или пылевидный уголь для отопления печи. Диаметр печи 5 м, высота 11-12 м. Корпус печи оборудован водяным охлаждением снаружи, медными кессонами внутри, футерованными огнеупорным кирпичом. Штейно-щлаковый расплав через узел выпуска массы передается в отстойник – электропечь, в поворотный миксер, или отражательную печь. Выпуск расплава из печи происходит постоянно, из отстойника – периодически. В отстойнике происходит разделение штейна и шлака и предварительное обеднение шлака. Содержание меди в штейне – 40-80%, в шлаке 0,9-2%.
Штейн поступает на конвертирование, а шлак – либо на флотацию, либо в отвал. Газ с содержанием SO2 28-60% после очистки передается на производство серной кислоты.
 Схема
печи Аусмелт
Схема
печи Аусмелт
Электроплавка медных концентратов.
По физическому характеру исходных материалов и химизму процесса плавка медных концентратов в электрических печах аналогична плавке в отражательных печах, хотя условия нагрева материала в этих агрегатах совершенно различны. В отражательной печи шихта нагревается с поверхности за счет тепла печных газов и отраженного тепла стенок и свода печи. В электрической печи материалы нагреваются изнутри за счет тепла, выделяемого при прохождении тока через слой образующегося при плавке шихты шлака и газовый слой между шлаком и погруженными в него электродами.
Основное преимущество электроплавки заключается в концентрации тепла и быстром достижении высокой температуры, что обеспечивает большую гибкость и оперативность процесса, наряду с его высокой тепловой эффективностью.
Электропечь для плавки сульфидных материалов представляет собой тепловую ванну, состоящую из двух расплавленных слоев – штейна и шлака, и погруженных частично в шлаковый расплав шихтовых куч (откосов) твердой шихты. Плавление шихты в печи происходит за счет электроэнергии, преобразуемой в теплоту. Такая печь называется руднотермической.

Руднотермическая печь работает на трехфазном переменном токе. Электрический ток напряжением до 750-800В и силой до 30 кА подводится к печи при помощи 3 или 6 угольных (графитовых) электродов, погруженных в слой шлака. Преобразование электроэнергии в теплоту в руднотермической печи происходит частично в газовой фазе (через электрические микродуги) и частично в жидкой фазе (через сопротивление расплавов).
На современных печах общая глубина ванны достигает 2,3-2,7 метра, в т.ч. шлаковой – 1,5-1,9 м. Более горячий шлак вблизи электрода поднимается вверх и растекается по поверхности ванны. Постепенно охлаждаясь он опускается вниз в межэлектродном пространстве и вновь нагреваясь у электрода поднимается вверх. Скорость циркуляции шлака может достигать 2 м/мин. Циркуляция шлака оказывает определяющее влияние на процессы массообмена, теплообмена, и процессы связанные с плавлением шихты. Тепловой КПД электроплавки составляет 70% . Газы состоят из SO2 и CO2 Извлечение меди в штейн при электроплавке составляет 95-98,5%. Содержание меди в штейне колеблется от 34 до 50%. В шлаке – от 0,5 до 0,9%. Расход электроэнергии на 1 тонну шихты – 350 - 500 кВт\ч.
Конвертирование.
Целью дальнейшей переработки медного штейна является получение черновой меди. В ней будут концентрироваться так же практически все золото и серебро, и, частично, редкие элементы. Эта задача решается путем окисления железа и серы продувкой через слой расплавленного штейна воздуха или дутья, обогащенного кислородом. Такой процесс получил название “конвертирование”. Продувка штейна сопровождается переводом оксидов железа в шлак, а SO2 в газы. Вследствие экзотермичности реакции окисления сульфида и шлакообразования, процесс конвертирования не требует затрат постороннего источника теплоты и является типичным автогенным процессом.
Медные штейны в основном состоят из сульфидов меди(Cu2S) и железа(FeS). Содержание меди в них, в зависимости от состава перерабатываемого сырья и применяемого вида плавки, колеблется от 10-12 до 70% и более.
Процесс конвертирования медных штейнов протекает в два периода: в 1-ом периоде практически полностью окисляется сульфид железа:
2FeS + 3O2 = 2FeO + 2SO2
т.е. железо и связанная с ним сера; во втором получается черновая медь за счет окисления полусернистой (Сu2S) меди.
Для практического осуществления процесса конвертирования медных штейнов почти повсеместно используют горизонтальные конвертеры.
Конвертер представляет собой цилиндрический поворотный аппарат периодического действия. Он имеет сварной кожух из стальных листов толщиной 20-40 мм, диаметром 3-5 и длиной до 10 м, футированный хромомагнезитовым кирпичом. Конвертер опирается на 4 пары роликов. Благодаря этому, он может поворачиваться вокруг своей горизонтальной оси. В верхней части конвертера имеется горловина, через которую заливают жидкий штейн, загружают холодные материалы, отводят газы и сливают конвертерный шлак и черновую медь.
Для подачи дутья в штейновый расплав, на одной из сторон конвертера по образующей установлены фурмы. Воздух в конвертер подается под избыточным давлением 0,1-0,16 мПа.
Чтобы фурмы не заливались расплавом, скорость истечения воздуха из сопла должна составлять 120-150 м\с.
В современной практике медной промышленности используют горизонтальные конвертеры вместимостью по меди от 40 до 180 тонн. На них установлено от 32 до 62 фурм диаметром 38-52 мм. Конвертеры – аппараты периодического действия. Процесс конвертирования начинается с заливки в конвертер нескольких ковшей жидкого штейна. Расплав при этом должен занимать несколько менее половины объема конвертера. Транспортируют штейн ковшами с помощью мостового крана. После приема штейна, конвертер ставят в рабочее положение и фурмы погружаются в расплав на 300-500 мм. Перед погружением фурм в расплав включают воздух.
Периодичность является одним из самых главных недостатков процесса конвертирования. Она приводит к большим затратам времени на зарядку конвертера, слив конвертерного шлака и черновой меди.
В первый период конвертирования проходит постепенное накопление в конвертере обогащенной медью сульфидной массы. В связи с этим, после каждой заливки штейна и его частичной продувки из конвертера сливают шлак и заливают дополнительную порцию штейна. Затем вновь проводят продувку. Эти операции в течение 1го периода проводят несколько раз, пока в конвертере не накопится достаточное количество богатой массы.
Выделяющейся при окислении сульфидов теплоты вполне достаточно не только для покрытия всех тепловых потерь, но и для существенного перегрева расплава. Во избежание чрезмерного перегрева расплава в конвертер загружают холодные присадки (дробленый оборотный шлак, корки). Конвертерные шлаки содержат 1,5-8% меди и отправляются на дальнейшую переработку.
Химизм второго периода конвертирования, имеющего своей целью получение черновой меди, может быть выражен реакциями:
2Cu2S+3O2 -> 2Cu2O+SO2
Cu2S+2Cu2O -> 6Cu+SO2
Конвертирование во втором периоде протекает при температуре около 1250С. Благородные металлы в медных штейнах в первом периоде концентрируются в белом штейне, и далее полностью остаются в черновой меди. Цинк, частый компонент медных штейнов, при конвертировании окисляется практически полностью и распределяется между шлаком и пылью. Переход цинка в пыль достигает 15-20%.
Свинец при конвертировании удаляется из меди почти полностью и улетучивается с конвертерными газами. Некоторая часть свинца переходит в шлак.
Второй период конвертирования проводится без загрузки каких либо материалов при подаче только воздуха. Готовность меди определяют пробой. Конечными продуктами процесса являются: черновая медь, конвертерный шлак и запыленные газы.
Черновая медь в зависимости от марки (от МЧ1 до МЧ6) должна содержать медь+серебро+золото от 96,0% (МЧ6) до 99,4%(МЧ1). Конвертерные шлаки содержат, %: 1-2% меди, 20-28% SiO2, 50-55% Fe, небольшое количество CaO, MgO, Al2O3. Железо в шлаках присутствует в форме FeO и Fe3O4(содержание магнетита от 10 до 28-30%). Извлечение меди в черновую медь составляет 87-92%, в конвертерный шлак 3-6%, в обороты 4-6%, потери – 0,5-0,8%.
Огневое рафинирование.
Черновая медь обычно содержит 97,5-99% меди, 0,03-0,35 серы, 0,01-0,1 железа, 0,1-0,5 никеля, 0,05-0,26 свинца, 0,03-0,3 мышьяка, 0,03-0,2 сурьмы, до 0,03 цинка, 30-40 г/т золота, 20-3000 г/т серебра и т.д.
Для непосредственного технического применения черновая медь непригодна, и поэтому ее обязательно подвергают рафинированию с целью очистки от вредных примесей и попутного извлечения благородных металлов. Состав и качество товарной меди, получаемой после рафинирования, должны отвечать требованиям ГОСТа.
Высшая марка рафинированной меди (М00) должна содержать не менее 99,99% меди. При этом в ней регламентируется максимальное содержание 10 примесей (Bi, As, Sb, Fe, Ni, Pb, Sn, S, O, Zn), которое суммарно не должно превышать 0,01%.
Огневое (окислительное) рафинирование черновой меди основано на различиях в сродстве к кислороду меди и ее примесей. Огневое рафинирование проводят с целью удаления части примесей, обладающих, по сравнению с медью, повышенным сродством к кислороду. Такие примеси в отличие от благородных металлов, которые в этой стадии рафинирования практически не удаляются, часто называют неблагородными. В результате огневого рафинирования содержание меди в анодах повышается до 99,5-99,8%.
Процесс огневого рафинирования состоит из следующих основных операций:
- Загрузка
- расплавление твердой меди и разогрев расплава
- окисление примесей
- съем шлака
- раскисление (дразнение) меди
- разливка меди в аноды.
Продолжительность процесса рафинирования зависит от многих факторов (состава черновой меди, вместимости печи, тепловой нагрузки, производительности загрузочных и разливочных устройств) и колеблется от 12 до 32 часов. Процесс окисления ведут при 1150-1170оС. Кроме черновой меди, в шихту анодных печей входят оборотные материалы: анодный брак, бракованные изложницы, анодные остатки и т.д.
Химические основы огневого рафинирования.
Стадия окисления начинается с продувания ванны расплава воздухом или воздухом, обогащенным кислородом. При этом медь постепенно насыщается кислородом и происходит окисление примесей.
С расчетом сродства к кислороду первыми должны были бы окисляться неблагородные примеси, но из-за их низкой концентрации в расплаве происходит прежде всего окисление меди:
4Cuж+O2=2Cu2Oтв
За счет растворения Cu2O, расплавленная медь постепенно насыщается кислородом.
Остаточное содержание примесей определяется равновесием реакций:
Cu2O+Me <-> MeO+2Cu
Легко и с большой полнотой удаляются железо, цинк, алюминий. Для их удаления даже не нужно глубокого насыщения меди кислородом.
Значительные трудности возникают при удалении никеля. Одна из причин этого явления – сравнительно небольшое различие в сродстве к кислороду меди и никеля. Рафинирование меди от никеля способствует получению ферритных шлаков, для чего в рафинировочную печь на стадии окисления необходимо вводить оксид железа Fe2O3.
В результате протекания реакции:
2Ni+O2+2Fe2O3=2(NiO*Fe2O3) образуется нерастворимый в жидкой меди феррит никеля.
Наиболее трудноудаляемыми огневым способом примесями являются мышьяк и сурьма. Отделение их при рафинировании происходит за счет испарения летучих низших оксидов As2O3 и Sb2O3. При этом, в начальной стадии окисления эти оксиды удаляются достаточно интенсивно.
С определенными трудностями сталкиваются при удалении свинца. Свинец, по сравнению с медью, обладает несколько большим сродством к кислороду, но это различие не слишком велико. Кроме этого, образующийся оксид свинца обладает большей плотностью чем медь и не всплывает на поверхность расплава.
Для устранения этих трудностей применяют кварцевый флюс. Образующийся глет в этом случае вступает во взаимодействие с SiО2, образуя силикат: PbO+SiO2=PbSiO3,
который всплывает в шлаке вследствие меньшей плотности силиката по сравнению с глетом и шлаком.
Таким образом, конечный результат окислительной операции огневого рафинирования меди можно охарактеризовать следующим образом: железо, цинк, свинец и алюминий удаляются почти полностью. Никель, мышьяк и сурьма при высоком их содержании в черновой меди удаляются лишь частично, а при низком содержании – почти полностью остаются в меди. Частично удаляется сера. Золото, серебро, металлы платиновой группы практически полностью сохраняются в меди, так же как висмут, селен и теллур.
Прежде, чем преступить к следующей операции, с поверхности ванны удаляют шлак, иначе присутствующие в шлаке оксиды восстановятся и примеси снова растворятся в металлической меди. Выход шлака составляет 1,2-4% от массы меди. Обычно рафинировочные шлаки содержат, %: 35-40 Cu, 6-10 Pb, 5-6 Sn, 1,7-2,5 Zn, 0,3-0,35 Ni, 11-13SiO2, 10-16 FeO, 1-2 Al2O3, 0,5-1,5 CaO. Съем шлака с поверхности ванны стационарных печей производят с помощью деревянных гребков, что предотвращает загрязнение меди железом. Рафинировочные шлаки перерабатывают в качестве оборотных материалов в конвертерах при конвертировании медных штейнов.
По окончании окислительной продувки меди и съема шлака, приступают к восстановлению Cu2O (раскислению меди) и удалению растворенных газов. Эта операция слагается из двух последовательно проводимых стадий – дразнения на плотность и дразнения на ковкость. Основная цель дразнения на плотность – удаление из меди серы и растворенных газов. Для этого в печи создают нейтральную либо слабоокислительную атмосферу и снижают температуру до 1120-1130 градусов. Расплавленную медь перемешивают газом, что создает благоприятные условия для протекания реакции:
Cu2S+2Cu2O=6Cu+SO2.
Для продувки меди используют природный газ, продукты перегонки нефти и т.п. При обработке расплавленной меди восстановительными газами уже на стадии дразнения на плотность начинается восстановление Cu2O. По завершении операции дразнения на плотность, приступают к операции дразнения на ковкость. Цель этой операции – восстановление практически всего оставшегося Cu2O до металла. Процесс ведут в сильно восстановительной атмосфере при загрузке восстановителя на поверхность ванны. В качестве восстановителя используют древесину (бревна), древесный уголь, нефтяной кокс, конверсированный газ и мазут:
Cu2О+Н2=2Cu+Н2O
Cu2О+СO=2Cu+СO2.
Вся операция дразнения на плотность и ковкость продолжается 2,5-3,5 часа. Разливка меди в аноды является завершающей стадией огневого рафинирования меди. Масса отливаемых анодов на отечественных заводов составляет 175-275, а на зарубежных – 275-375 кг. Одним из важных требований, предъявляемых к процессу разливки меди, является получение анодов точно заданной массы с ровной поверхностью, т.к. значительное отклонение в массе анодов и их грубо-шероховатая и волнистая поверхность ухудшают показатели электролиза и увеличивают выход анодных остатков(скрапа). Готовые аноды после отбраковки отправляются в цех электролитического рафинирования.
Степень удаления примесей при огневом рафинировании в зависимости от их содержания в черновой меди и особенностей технологии, выражается следующими цифрами, %: 90-99 Zn, Fe, S; 80-90 Pb; 70-90 Sn; 20-70 Ni, Sb, As; до 5 Se, Te, Bi.
Электролитическое рафинирование меди.
Анодная медь является сложным многокомпонентным сплавом. Обычно она содержит, %: 99,5-99,8 меди, до 0,015 серы, столько же железа, до 0,5 никеля, до 0,05 свинца, до 0,01 висмута, до 0,2 мышьяка, до 0,06 селена+теллура, до 0,03(300г/т) золота и до 0,5(5000 г/т) серебра. Электролитическое рафинирование меди преследует две цели:
Получение меди высокой чистоты (99,90-99,99% меди)
Извлечение попутно с рафинированием благородных металлов и других ценных компонентов (селен, теллур, никель, висмут и др.)
Чем выше в исходной меди содержание благородных металлов, тем ниже будет себестоимость электролитной меди.
Электролитическое рафинирование меди основано на различии ее электрохимических свойств и содержащихся в ней примесей. Медь – это электроположительный металл, ее нормальный потенциал +0,34В.
Для осуществления электролитического рафинирования меди аноды, отлитые после огневого рафинирования, помещают в электролизные ванны, заполненные сернокислым электролитом
Между анодами в ваннах располагаются тонкие медные листы – катодные основы. При включении ванн в сеть постоянного тока происходит электрохимическое растворение меди на аноде, перенос катионов через электролит и осаждение ее на катоде.
Примеси меди при этом в основном распределяются между шламом(твердым осадком на дне ванн) и электролитом. В результате электролитического рафинирования получают:
- Катодную медь
- Шлам, содержащий благородные металлы, селен, теллур
- Загрязненный электролит, часть которого используют для получения медного и никелевого купороса.
Кроме того, вследствие неполного электрохимического растворения анодов, получают анодные остатки (анодный скрап).
Анодный процесс : Cu - 2e = Cu2+
Катодный процесс: Cu2+ + 2e = Cu
Электроположительный потенциал меди позволяет выделить медь на катоде из кислых растворов без опасения выделения водорода. Введение в электролит наряду с медным купоросом свободной серной кислоты существенно повышает электропроводность раствора.
Промышленные электролиты обычно содержат 30-50 г/л Cu2+ и 120-170 г/л свободной серной кислоты. Для улучшения качества катодной поверхности, в электролиты вводят разнообразные поверхностноактивные (коллоидные) добавки – клей (чаще столярный), желатин, сульфидный щелок, тиомочевину и так далее. Добавки непрерывно вводят в циркулирующий электролит, обычно применяя одновременно две добавки. На одну тонну катодной меди расходуют 15-40 г клея, 15-20 г желатина, 20-60 г сульфидных щелоков или 60-100 г тиомочевины.
Температура электролита составляет 55-65С. Основными требованиями, предъявляемыми к электролиту, является его высокая электропроводность и чистота, однако реальные электролиты, помимо сульфата меди, серной кислоты, воды и необходимых добавок обязательно содержат растворенные примеси, содержавшиеся до этого в анодной меди.
Примеси, более электроотрицательные чем медь (никель, железо, цинк и др.) практически полностью переходят в электролит. Исключение составляет только никель, около 5% которого осаждается в шлам. Более электроположительные по сравнению с медью примеси (благородные металлы) переходят в шлам. Золото на 99,5% от его содержания в анодах, а серебро – на 98.
Основными характеристиками, определяющими параметры и показатели электролиза меди являются:
- Плотность тока
- Выход металла по току
- Напряжение на ванне
- Удельный расход электроэнергии.
Плотность тока выражается в амперах на единицу поверхности электрода (D=I/S). Единицы измерения – А/м2 катода.
По закону Фарадея, на каждый А*ч электричества осаждается 1 электрохимический эквивалент металла. Для меди он равен 1,1857 г/А*ч. Следовательно, с увеличением плотности тока производительность процесса электролиза растет. Чаще всего заводы работают при плотности тока 240-300 А/м2, но можно довести плотность тока до 500 А/м2.
Степень использования тока на основной электрохимический процесс называется выходом металла по току. Выход по току может быть выражен в долях единиц или в процентах. На величину потерь тока влияют: утечки тока, возникающие в результате заземления в цепи, утечки тока через циркуляционные трубопроводы электролита, короткие замыкания между электродами, побочные химические и электрические процессы, нагревание электролита и контактов.
С этой целью введено понятие коэффициента использования тока или, как принято в заводской практике, “выход по току”, который рассчитывается как отношение фактически полученного количества меди к теоретически возможному при данных условиях электролиза (сила тока, продолжительность электролиза)
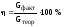
Напряжение на ванне составляет от 0,35 до 0,46 В.
Удельный расход электроэнергии – 280-370кВт*час/тонну меди
В настоящее время для электролиза меди в основном используются цельнолитые железобетонные ванны ящичного типа. Внутри электролизные ванны облицовывают винипластом. Ванны установлены на столбах с изоляторами из стекла, фарфора или текстолита на высоте 4-5м от 0 отметки. Под ваннами расположены насосы, трубопроводы и сборники электролита. Для спуска шлама и раствора в днищах имеется отверстие с пробкой. Если стоков не делают, ванны разгружают с помощью насосов.
Электролизные ванны объединяют в блоки по 5-20 штук, а блоки – в серии. В электрическую схему питания постоянным током ванны в блоках и блоки в сериях включены последовательно, а электроды в отдельных ваннах – параллельно. Эта система включения ванн и электродов получила название мультипль. Аноды отливают с ушками, которыми они опираются на токоподводящие шины и борта ванн.
Средняя толщина анода 35-45 мм, масса – до 350кг. Для обеспечения равномерного растворения анодов по высоте электролита, их отливают клиновидной формы с утолщением кверху. Катодные основы изготавливают из медных листов, размер катодной основы превышает размер анода по длине на 25-50 мм, по ширине на 50-60 мм. Катодные основы подвешивают в ваннах на медных трубчатых штангах. Расстояние от боковых кромок катодов до стенок ванн около 300 мм, до днища ванны 400-600 мм, число анодов, завешиваемых в одну ванну, на разных заводах колеблется от 29 до 48 штук. Число катодов в ванне всегда на 1 больше числа анодов, что обеспечивает равномерное растворение всех анодов, включая крайние. Расстояние между осями одноименных электродов – около 110мм, соответственно, между анодом и катодом – примерно 35-40 мм.
Электролит обычно подают в нижнюю зону ванны, а отводят сверху. В зависимости от применяемой плотности тока и массы анодов, каждую партию катодов наращивают в течение 6-10 суток. За это время катоды достигают толщины 8-10 мм. Срок срабатывания анодов соответствует 2-3 заменам катодов и достигает 30 суток. Загрузку в ванны анодов осуществляют мостовым краном. Извлеченные из ванн катоды направляют на промывку от электролита, загрязняющего их серой. Промывку ведут последовательно оборотными растворами и чистой горячей водой. Отмытые катоды переплавляют с получением слитков для волочения проволоки (вайербарсы) или медной катанки. Отработанные аноды(анодные остатки) переплавляют в анодных печах.
Выгрузку анодного шлама и полный слив электролита осуществляют периодически после полного срабатывания нескольких партий анодов(в зависимости от выхода шлама). Для выпуска шлама две соседние ванны выключают(шунтируют) наложением специальных медных шунт. После этого, из ванны извлекают электроды, сливают электролит и на дне остается слой сгущенного шлама. Его сливают и смывают в специальные емкости. После разгрузки ванны ее зачищают от обвалившихся кусочков меди, уплотнившегося шлама, и промывают. Шлам пропускают через рокот для отделения крупной фракции меди, после чего фильтруют и направляют на специальную переработку.
Технико-экономические показатели процесса:
Содержание меди в анодах, % 99-99,8
Масса анодов, кг 175-350
Время растворения анодов, сутки 18-27
Выход анодных остатков, % 17-20
Время наращивания катодов, сутки 6-9
Масса катода, кг 70-140
Выход шлама, % 0,8 – 8,5
Состав электролита, г/л Cu2+ 50, H2SO4 125-230, коллоидные добавки 30-300
Температура электролита, С 55-65
Скорость циркуляции, л/мин 6-15
Катодная плотность тока А/м2 180-300
Напряжение на ванне, В 0,25-0,4
Расход электроэнергии кВт*ч/т кат меди 230-350
Переработка электролитного шлама.
Состав шлама зависит от состава перерабатываемого сырья. Содержание в шламах основных компонентов следующее, %: 10-75 меди, 0,05-4 золота, 5-55 серебра, 2-13 селена, 0,3-15 теллура, 0,5-12 свинца, 0,2-30 сурьмы, 0,1-5 мышьяка.
Технологические схемы переработки шламов очень разнообразны и сложны. Обычно начинают с операции обезмеживания. Крупную фракцию меди отделяют путем грохочения, затем оставшуюся медь растворяют в серной кислоте при температуре 80С и продувании воздуха в качестве окислителя. По окончании процесса, пульпу фильтруют, и отправляют на извлечение селена и теллура. Извлечение селена в раствор основано на образовании растворимого в воде селената натрия. С этой целью к шламу добавляют соду в растворе, пульпу помещают на противни и прокаливают в муфельных печах при 600-650С для образования водрастворимого селената натрия по реакции:
SeO2+Na2CO3+3/2O2 -> Na2SeO4+CO2
Образовавшийся спек выщелачивают горячей водой, полученные растворы упаривают. Селенат натрия далее восстанавливают до селенита соляной кислотой, а из раствора осаждают селен сернистым ангидридом по реакции:
Na2SeO3+2SO2+H2O -> Na2SO4+H2SO4+Se
Кек после выщелачивания селена обрабатывают серной кислотой для растворения теллура. Полученный раствор теллуровой кислоты H2TeO4 подвергают такой же обработке, как и селенат натрия, и получают черновой теллур.
Плавку шлама на золотосеребряный сплав проводят в сильной окислительной атмосфере. Для полного окисления и перевода неблагородных примесей в первичный силикатный шлак в шихту добавляют окислитель – селитру(NaNO2). Затем, очищенный от примесей золотосеребряный сплав(сплав Доре) направляют на аффинаж – процесс разделения и рафинирования золота и серебра.
Металлургия цинка
Цинк – тяжелый цветной металл синевато-белого цвета. Плотность твердого цинка составляет 7,14 г/см3, жидкого – 6,7 г/см3. Температура плавления 419,4С. Кипения – 906С. Упругость паров цинка чрезвычайно высока — он начинает заметно улетучиваться уже при 500—600 °С. Этим цинк значительно отличается от других тяжелых цветных металлов.
В обычных условиях цинк хрупкий и твердый металл. Высокую пластичность цинк приобретает при нагреве до 100—150 °С. При этих температурах он вытягивается в тонкие ленты и даже в проволоку. При нагреве выше 200 °С цинк вновь становится хрупким и его легко можно истолочь в порошок. Валентность цинка +2.
Цинк имеет высокое сродство к кислороду. Однако при нормальных условиях он отличается высокой коррозионной стойкостью. Сухой воздух при комнатной температуре на цинк не действует, но при наличии в воздухе паров воды и углекислого газа металл покрывается тонкой и очень плотной пленкой состава ZnСОз-Zn(ОН)2, которая практически полностью прекращает процесс дальнейшего окисления. Это свойство цинка широко используется в технике для нанесения антикоррозионных покрытий (цинкование) главным образом на железные изделия (например, при изготовлении кровельного железа).
Продукт окисления цинка ZnО трудно восстановимый оксид: его восстановление до металла возможно при температурах выше 1000 °С в атмосфере, практически полностью состоящей из СО . Оксид цинка плавится при температуре около 2000 °С.
В разбавленных кислотах цинк растворяется с выделением водорода и образованием соответствующих солей. Щелочи растворяют цинк с образованием цинкатов.
Цинк
— типичный электроотрицательный металл
(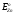 = —0,763 В). Он вытесняет медь, никель,
кобальт, свинец, олово и благородные
металлы из растворов. Это свойство
цинка широко используют в металлургической
практике для цементационного выделения
ряда металлов из растворов.
= —0,763 В). Он вытесняет медь, никель,
кобальт, свинец, олово и благородные
металлы из растворов. Это свойство
цинка широко используют в металлургической
практике для цементационного выделения
ряда металлов из растворов.
С другими металлами цинк образует ряд промышленно важных сплавов — литейные сплавы, латуни, бронзы и др. Хорошие литейные свойства сплавов на основе цинка позволяют методами литья под давлением получать изделия сложнейших форм с хорошими механическими характеристиками и качественной поверхностью. Такие изделия широко используют во многих отраслях промышленности, и спрос на них непрерывно растет.
Окись цинка — белый порошок — находит применение в производстве красителей (цинковых белил), как наполнитель некоторых сортов резины, а также при изготовлении ряда медикаментов и парфюмерных изделий.
Цинк обычно не образует самостоятельных руд, а входит в состав полиметаллических свинцово-цинковых или медно-свинцово-цинковых руд. В этих рудах, наряду со сфалеритом, присутствуют сульфиды свинца, меди, кадмия, марганца, серебра, мышьяка, сурьмы, кобальта. В сфалерите часто в виде примесей содержатся редкие элементы – индий, таллий, галлий и германий, а так же золото в количестве от тысячных до сотых долей процента.
В полиметаллических свинец-цинксодержащих рудах содержание отдельных компонентов характеризуется следующими цифрами, %: 0,3–4 Pb; 0,5–10 Zn; 0,2–2,9 Cu; 8–25 Fe; 7–30 S; 0,2–0,3 г/т Au; 5–100 г/т Ag
В сульфидных рудах цинк обычно находится в виде
- сфалерита (ZnS, 67,1% Zn) - основной минерал цинка
– вюртцита (кристаллическая модификация сульфида цинка ZnS, 67,1% Zn).
- марматита (nZnS*m FeS).
Свинец в сульфидных цинковых рудах представлен в виде галенита PbS.
В окисленных зонах месторождений цинксодержащих руд, цинк присутствует в виде следующих минералов: цинкита (ZnO), франклинита (ZnMnO*Fe2O3), виллемита (2ZnO*SiO2), гидроцинкитов (3Zn(OH)2*2ZnCO3), смитсонита (ZnCO3).
Сульфидныеруды перед металлургической переработкой успешно подвергаются обогащению флотацией с получением цинкового, свинцового и других концентратов. Селективная флотация полиметаллических руд обеспечивает получение высококачественных цинковых концентратов, которые кроме основных составляющих содержат незначительное количество золота, серебро (75-100г/т), индий, ртуть, галлий, таллий. Таким образом, цинковые концентраты представляют собой комплексное сырье. Отечественные предприятия к настоящему времени освоили извлечение из них 11-17 элементов.
Основным сырьем для производства цинка являются цинковые концентраты ( а не окисленные руды), имеющие в среднем следующий химический состав, %: Zn 45-60; Cd 0,1-0,5; Pb 0,1-3,0; Cu 0,2-3,0; Fe 5-13; S 29-35; SiO20,4-4.
Для извлечения цинка из концентратов применяют два способа:
- пирометаллургический (дистилляционный),
- гидрометаллургический (электролитический).
Пирометаллургическое производство цинка
Достоинствами пирометаллургической схемы получения цинка являются:
- ее малостадийность,
- сравнительно высокое прямое извлечение цинка в металл (93 %),
- использование высокопроизводительного оборудования непрерывного действия,
- возможность перерабатывать низкокачественное сырье с высоким содержанием железа, мышьяка, сурьмы и кремнезема.
Недостатки этой схемы:
- большой расход кокса (до 25 % от массы агломерата),
- большой расход электроэнергии при использовании электропечей (3 000 кВт·ч/т цинка),
- малая комплексность использования сырья,
- получение цинка низших марок, требующего рафинирования.
Эта технология обычно применяется для переработки бедных цинковых концентратов с высоким содержанием примесей железа, мышьяка, сурьмы, кремнезема и с невысоким содержанием редких металлов (кадмия, индия, таллия и других), а также при небольшом объёме производства и при потребности в цинке низших марок.
Пирометаллургический способ основан на использовании высокой летучести цинка в металлическом состоянии при 1000-1200оС. Т.к. температура кипения цинка 906оС, он отделяется в парообразном состоянии, возгоняется и затем конденсируется. Большинство сопутствующих металлов, в условиях восстановления и возгонки цинка, остаются в твердой фазе. Для процесса характерна высокая избирательность.
Для практической реализации процесса дистилляции необходимо предварительно перевести сульфид цинка (в виде которого содержится цинк в цинковых сульфидных концентратах) в наиболее легковосстановимую форму – оксид цинка ZnO. Это достигается путем окислительного обжига сульфидных цинковых концентратов.
Назначение обжига перед дистилляцией:
Возможно более полное удаление серы из цинковых концентратов. Перевод цинка и других металлов в оксиды.
Предварительная отгонка из концентрата летучих соединений свинца, кадмия, мышьяка, сурьмы и некоторых рассеянных элементов.
Окускование мелкого материала шихты с получением кусков пористой структуры.
Получение концентрированных по SO2 газов, пригодных для получения серной кислоты.
Выполнение указанных условий достигается в ходе окислительно-спекающего обжига, который, чаще всего проводят в две стадии:
- окислительный обжиг на порошок в печах кипящего слоя,
- и окислительно-спекающий обжиг на агломерационных машинах.
В ходе окислительного обжига происходит окисление сульфида цинка кислородом воздуха. Это экзотермические реакции, идущие с выделением тепла:
ZnS + 1,5O2 -> ZnO + SO2 + 890 кДж Т=800 С – основная реакция
ZnS + 2О2 -> ZnSO4 +775 кДж Т= 600-700 С
(Первая реакция наиболее интенсивно протекает при температуре свыше 800С, вторая – при 600-700С). Чтобы окислительный обжиг сульфидных концентратов происходил до образования оксидов (максимальной десульфуризации) необходимо поддерживать температуру не ниже 900 С. Температуру регулируют скоростью загрузки материала и часто водяными холодильниками, установленными в корпусе печи в области кипящего слоя.
Материалы, подаваемые в печь КС, могут иметь высокую влажность и даже подаваться в печь в виде пульпы.
При обжиге в кипящем слое цинковых концентратов образуется большое количество пыли. Грубую пыль (до 40% от массы огарка) улавливают в циклонах, а тонкую (до 5%) – в электрофильтрах. Тонкую пыль, в которую переходит большое количество редких и рассеянных элементов, либо перерабатывают самостоятельно, либо объединяют с грубой пылью и огарком. В огарке содержится 55-65 % цинка и до 2,5% серы ( в концентрате, подаваемом в печь КС, серы около 29-30%).
В настоящее время на цинковых заводах работают печи кипящего слоя с высотой 7-12 м, диаметром 5-7 м, площадью пода от 21-35 до 72-123 м2. В них можно обжигать 100-800 т концентрата в сутки, т.е. от 5 до 10-20 т/(м2сут). На многих заводах используют избыточное тепло кипящего слоя и тепло отходящих газов для производства пара.
Полученный огарок поступает на агломерацию.
Агломерация придает шихте необходимые физические свойства (кусковатость, пористость, механическую прочность), но на спекательных машинах недостаточна степень десульфуризации, чтобы в один прием обжечь сульфидный концентрат, поэтому все-таки наиболее эффективен двухстадийный обжиг, когда в первой стадии проводят обжиг на порошок, а во второй стадии – агломерируют огарок окислительного обжига на спекательных машинах.
Спекание огарка достигается в результате образования сравнительно легкоплавких силикатов железа, свинца и цинка, при этом происходит выгорание остатка серы и отгонка кадмия, германия, индия, галлия. При температуре агломерирующего обжига практически все железо окисляется до магнетита Fe3O4, поэтому ферритов тяжелых цветных металлов образуется мало. Применять флюсы для снижения тугоплавкости и увеличения доли связующих компонентов в агломерате нецелесообразно, т.к. это ухудшает условия дистилляции. Полученный агломерат почти не содержит сульфатной серы.
Шихту перед агломерацией увлажняют до влажности 6-10% для улучшения газопроницаемости. Пылевынос при агломерации 3-4%, пыль содержит до 25-35% свинца и до 1,5% кадмия. Ее не возвращают на обжиг, а перерабатывают отдельно для извлечения свинца и кадмия.
Агломерирующий обжиг полученного огарка ведут на прямолинейных спекательных машинах при температурах в зоне горения и спекания до 1200-1400 С. Потребности тепла обеспечиваются как за счет реакций окисления сульфидов, так и за счет ввода в шихту необходимого количества коксика.
Дистилляция цинка
Полученный агломерат направляют на дистилляцию. Процесс идет в одном из следующих агрегатов:
– электропечи (процесс называется электротермия)
- шахтной печи (при Империал-смелтинг процессе - ISP).
- в вертикальных ретортах (дистилляция).
Возгонка цинка включает следующие основные физико-химические процессы:
- восстановление оксида цинка до металла,
- испарение (возгонка) металлического цинка,
- конденсация паров металлического цинка.
В качестве восстановителя в шихту вводят кокс. Непосредственный контакт твердого углерода с оксидом цинка сильно затруднен, взаимодействие может происходить только в местах касания углерода с окисленными соединениями цинка, поэтому процесс восстановления цинка твердым углеродом идет по реакции:
2ZnO + C <-> 2Zn + CO2
ZnO + C <-> Zn + CO
Этот процесс имеет второстепенное значение. Основной процесс восстановления оксидов металлов при дистилляции развивается по реакции:
ZnO + CO <-> Znгаз + СО2
Цинк сразу же испаряется и переходит в газовую фазу в виде пара. При температуре свыше 900-1000оС, создаются благоприятные условия для восстановления и возгонки цинка. Образовавшаяся парогазовая смесь проходит в конденсатор, где быстро охлаждается на поверхности быстроразбрызгиваемого металлического цинка (электротермия) или свинца (ИС процесс).
Дистилляция в шахтных печах
Около трети производимого пирометаллургическим способом цинка приходится на дистилляционную плавку в шахтных печах («Империал Смелтинг – процесс»). Особенность процесса – совместная переработка цинковых и свинцовых концентратов или свинцово-цинкового коллективного концентрата с отношением Zn:Pb = 2:1.
Широкое распространение способ получил благодаря следующим достоинствам:
1) большой производительности агрегата по цинку (до 200 т/сут) и по свинцу (до 100 т/сут);
2) возможности переработки коллективных концентратов;
3) высокому извлечению цинка и свинца;
4) высокой производительности труда.
Загружаемая в печь шихта состоит из агломерата и кокса. Кокс предварительно подогревают до 800 °С, агломерат грузят холодным. Агломерат и кокс реагируют с горячим дутьем, поступающим в печь через фурмы, в результате чего образуются свинец и шлак, которые собираются в горне печи, откуда их периодически выпускают в отстойник для разделения по плотности. Цинк возгоняется – переходит в газовую фазу.
Плавку ведут на шлак состава, %: 32 СаО, 25 SiO2, 20 FeO и 11 Аl2О3, имеющий температуру плавления 1 250 °С. Шлак содержит 3–4 % Zn и 0,5–0,8 % Рb. Его гранулируют и отправляют в отвал.
Свинец стекает в горн печи и выпускается через сифон, его отправляют на рафинировочный завод.
Печные газы с температурой 950–1 000 °С, содержащие 3,9 % Zn, 11,3 % СО2 и 18 % СО, направляют в конденсаторы. В виде жидкого цинка конденсируется 87 % металла из парогазовой смеси.
Переработка этим способом чисто цинковых концентратов представляет известную трудность, т.к. получение достаточно прочного и крупного агломерата из чисто цинкового концентрата – задача весьма сложная. Присутствие в шихте свинца облегчает задачу получения прочного агломерата, а возможность попутного его извлечения при дистилляции цинка позволяет успешно применять этот процесс к свинцово-цинковой шихте.
К недостаткам процесса следует отнести низкое качество получаемого цинка, большой расход кокса, жесткие требования к качеству кокса и агломерата.
Электротермическая дистилляция цинка
Электротермическая дистилляция цинка основана на использовании электроэнергии для нагрева шихты. Известны два способа электротермической дистилляции цинка: в шахтных электропечах с твердой шихтой и в рудно-термических печах с расплавлением шихты и попутным получением шлака и чугуна.
Электротермические способы дистилляции цинка в определенной степени перспективны для дальнейшего применения благодаря возможности переработки низкосортного сырья, содержащего много железа, кремнезема и других примесей. Они дают хорошие показатели по извлечению и комплексности использования полиметаллического сырья.
В дуговой электропечи на подине образуется жидкая ванна из чугуна и покрывающего его шлака. Электропечь оснащена 3 электродами. Концы электродов опущены в шлак. Т=1300-135 С.
При электротермии в шахтных печах не получают жидких продуктов плавки. Цинк возгоняется в газовую фазу и улавливается в конденсаторе металлическим цинком. Все прочие компоненты шихты остаются в твердом остатке (раймовке) и постоянно выгружаются из печи. Такая шахтная печь обогревается электрическим током. Ток в шахтной печи проходит сквозь слой шихты с коксом, между кусками кокса возникают многочисленные электрические дуги, нагревающие шихту до 1200 С (Т кипения цинка 906 С). Извлечение цинка в возгоны – 95%.
Пары цинка поступают в конденсатор. В конденсаторе (обогреваемом электричеством) находится жидкий свинец (ИС-процесс) или цинк. Жидкий металл разбрызгивают в конденсаторе с помощью вращения мешалки из графита или стали. Мешалка частично погружается в жидкий металл, вращается, брызги металла захватывают пары цинка. Если используется жидкий цинк, то по мере накопления в конденсаторе, металл просто сливают. Если же цинк улавливают свинцом, то свинцово-цинковый сплав непрерывно перекачивают в ликвационную печь, где он расслаивается: верхний слой – цинк+1,5% свинца – идет на дальнейшую очистку, нижний слой – свинец+2,3% цинка- возвращается в конденсатор для улавливания нового цинка.
Дистилляция в вертикальных ретортах.
Реторта выполняется из карборунда (SiC), который обладает высокой механической прочностью и теплопроводностью. Дистилляция в вертикальных ретортах – непрерывный процесс. Высота реторты – 10-12 м. Реторты имеют прямоугольное сечение. Обогреваются снаружи топочными газами. Газ, обогревающий реторту, сжигается в камерах, расположенных по обеим сторонам реторты. Высота обогреваемой части около 7,5 м. В зоне высоких температур, расположенной в обогреваемой части реторты, происходит восстановление цинка и его испарение. Нижняя часть реторты представляет собой железный короб с гидрозатвором.
Шихта загружается в виде брикетов. Брикетируют ее на валковом прессе с добавкой связующего (например, каменноугольной смолы). Раймовка (твердый остаток после дистилляции), выгружаемая из нижней части реторты, сохраняет в основном, первоначальную форму брикетов.
Полнота конденсации цинка в конденсаторе - до 85%. Газы, выходящие из конденсатора, идут в скруббер, где остатки цинка улавливаются в виде тонкой пыли.
Суточная производительность одной реторты 5-7 тонн цинка. Число реторт на заводах – 20-25 и более.
Брикетированный материал (агломерат + 30%восстановителя(кокс) + 10-15% оборотов) загружают в реторту сверху, через герметизирующее устройство, а раймовку выгружают снизу шнековым транспортером с водяным затвором. Это обеспечивает постоянный сход шихты. Ретортные газы, содержащие пары цинка (Т=950-1000 С) отводят через наклонный газоход в конденсатор. В конденсаторе идет разбрызгивание жидкого цинка, что улучшает конденсацию паров.
Процесс дистилляции цинка в вертикальных ретортах хорошо механизирован.
После возгонки цинка получают 3 продукта:
- черновой цинк, содержащий 98-99% цинка, до 2% свинца, 0,05-0,1 % железа и 0,004-0,02% кадмия. По составу он удовлетворяет только самым низшим маркам Ц3 и Ц4. Черновой цинк рафинируют.
- пуссьеру – это тонкая пыль, выносимая из агрегата. Пуссьера представляет собой тонкий серый порошок с размерами частиц в несколько микронов. Несмотря на то, что основная масса кадмия переходит в цинк, в пуссьере концентрация кадмия высока – до 2,3%. Кроме того, пуссьера состоит из 60-70% металлического цинка и примерно 13-15% цинка в виде карбонатов и оксидов. Еще одна составляющая пуссьеры – сажа (твердый углерод), летучие примеси и т.д. Пуссьеру направляют на извлечение кадмия.
- Раймовку – твердый остаток от дистилляции цинка. Ее сортируют по крупности – крупная (более 19 мм) бедна по цинку и идет в отвал, средняя богата коксом и является оборотом, мелкая богата цинком и тоже идет в оборот.
Распределение цинка по продуктам дистилляции:
Черновой цинк 82,4%
Пуссьера 4,8%
Раймовка 11,3%
Потери с газами 1,1%.
Цинк, полученный дистилляцией, называют черновым (или сырым), т.к. общее содержание примесей в нем достигает 3–4 %. В дистилляционном цинке, независимо от способа его получения может быть до 3 % Pb, до 0,3 % Fe, до 0,5 % Cd, а также медь, мышьяк, сурьма и другие примеси.
Поэтому дистилляционный цинк (кроме цинка, полученного в ретортах – в нем содержание цинка до 99,8%) не удовлетворяет даже марке Ц3 (98,7% цинка), который, как и металл марки Ц4 (97,5%) требуется в небольших количествах ( для производства оцинкованной стали). Поэтому цинк, получаемый пирометаллургическим способом, приходится рафинировать. Электролитическое рафинирование не нашло в данном случае применения, т.к. расход электроэнергии высок и цинк получился бы дороже получаемого гидрометаллургическим способом. Поэтому применяют 2 метода рафинирования: ликвация и ректификация .
Ликвационное рафинирование (другое название – рафинирование отстаиванием) основано на изменении растворимости металлов-примесей в расплавленном цинке при охлаждении расплава, с последующим выделением металлов-примесей в отдельную металлическую фазу и разделением фаз по плотности.
Ликвацией рафинируют цинк от свинца и железа. Свинец ограниченно растворим в цинке. С понижением температуры до затвердевания происходит уменьшение взаимной растворимости цинка и свинца. На практике ликвацию проводят при 430–440 °С. Этой температуре соответствует содержание свинца в цинке около 1 %. Железо с цинком образует ряд химических соединений (FeZn3 и FeZn7) и твердых растворов, которые при охлаждении кристаллизуются, образуя пропитанную цинком губчатую массу железистого цинка (гартцинка).
В жидкой ванне при ликвации обычно образуется три слоя: жидкий сплав свинца с цинком, содержащий 5–6 % Zn (нижний); кашеобразный слой железистого цинка FeZn7 – носит название «твердый цинк» (средний); жидкий рафинированный цинк (верхний). Кроме того, на поверхность жидкого цинка всплывают оксиды цинка – дроссы.
Ликвацию проводят в отражательных печах с восстановительной атмосферой, чтобы не окислить цинк. Расход топлива составляет около 10 % от массы чернового цинка. Полученный после рафинирования ликвацией цинк содержит 0,8–1,2 % Pb и 0,03–0,04 % Fe. По мере накопления железистый цинк удаляют из печи шумовкой, а свинец с донной части ванны вычерпывают через трубу, вставляемую через свод в ванну печи. В процессе ликвационной плавки 90 % цинка переходит в частично рафинированный металл, 1,5 % – в цинковистый свинец, 5 % — в железистый цинк, 2 % – в дроссы, 1,5 % – в угар. Цинковистый свинец направляют на свинцовые заводы, где его обычно загружают в рафинировочные котлы на стадии обессеребрения свинца. Дроссы, удаляемые с поверхности ванны, возвращают в шихту дистилляционных печей. Железистый цинк (4–5 % Fe и 94 % Zn) также возвращают на дистилляцию.
Верхний слой цинка (после съема дроссов) выпускают из печи через отверстие в торцевой стенке и разливают в изложницы, а в печь вновь добавляют порцию чернового цинка.
С целью получения чистого цинка высоких марок применяют последовательно ликвацию и ректификацию.
Ректификация позволяет получить цинк чистотой 99,996 %, а также свинец и кадмий в отдельных продуктах. Этот передел сравнительно дорогой и применяют его не часто. Ректификацией называют непрерывный противоточный процесс разделения двух компонентов, в котором операции дистилляции и конденсации фаз многократно повторяются. Процесс применяется с 1936 года, ректификация позволила устранить один из существенных недостатков пирометаллургии цинка – получение загрязненного металла.
Ректификация позволяет разделить компоненты с близкими температурами кипения и получить чистые металлы. Температура кипения компонентов чернового цинка следующая, °С: 906 – Zn;767 – Cd; 1 745 – Pb; 2 543 – Cu; 2 870 – Fe. Ректификацией легко отделить цинк от меди и железа, но разделить цинк, кадмий и свинец – значительно труднее. При ректификации используют известное явление: содержание низкокипящего компонента в парах кипящей жидкости всегда выше, чем в равновесной с ним жидкой фазе (закон Д.П. Коновалова).
Процесс осуществляют в ректификационных колоннах, которые собирают из 40–50 тарелок. Каждая тарелка представляет собой плоский сосуд с отверстием в дне, что позволяет парам металлов при нагревании подниматься вверх по колонне, а жидкой фазе переливаться вниз, попадая на нижележащую тарелку.
Гидрометаллургия цинка
Гидрометаллургический способ получения цинка заключается в выщелачивании цинка из обожженного концентрата серной кислотой. Основная масса пустой породы остается при этом в нерастворимом остатке, называемом цинковым кеком.
Широкое распространение гидрометаллургический способ производства цинка получил благодаря тому, что:
- он обеспечивает более высокое (по сравнению с пирометаллург.способом) извлечение цинка и сопутствующих элементов,
- достигается более высокая комплексность использования сырья,
- получается цинк более высокого качества,
- способ имеет высокую механизацию трудоемких процессов.
Сульфид цинка ZnS практически нерастворим в разбавленных кислотах. Выщелачивание его в концентрированной серной кислоте (60-65% H2SO4) возможно при 150-170 С, но сложно в аппаратурном оформлении. Поэтому, перед выщелачиванием цинковые сульфидные концентраты подвергают окислительному обжигу, продукты которого хорошо растворимы в разбавленных растворах серной кислоты при низких температурах. Очень важно, чтобы продукт обжига был порошкообразным. Чем мельче порошок, тем выше скорость его выщелачивания. Обжиг следует вести в основном с получением оксида цинка ZnO и некоторого количества сульфата цинка ZnSO4.
ZnS + 1,5O2 -> ZnO + SO2 + 890 кДж
ZnS + 2О2 -> ZnSO4 +775 кДж
Образование сульфата цинка при обжиге выгодно тем, что на его растворение при выщелачивании не затрачивается серная кислота. Но сульфата не должно быть слишком много, его количество должно соответствовать потерям серной кислоты при последующем электролизе полученных растворов.
Аппаратурное оформление и химизм обжига в печи КС аналогичны обжигу при пирометаллургической технологии.
Выщелачивание обожженного концентрата.
Назначение операции выщелачивания огарка – растворить как можно полнее соединения цинка, содержащиеся в огарке.
Огарок содержит 55-65% цинка и до 2% серы.
Растворение происходит в сернокислых растворах. Выбор серной кислоты как растворителя обусловлен хорошей растворимостью в ней ZnO, условиями последующей операции электролитического восстановления цинка, а так же наличием на цинковом заводе в достаточном количестве серной кислоты, получаемой при электролизе и производимой на месте из обжиговых газов.
Оксид цинка хорошо растворим в слабых растворах серной кислоты:
ZnO + H2SO4 -> ZnSO4 + H2O – основная реакция выщелачивания
В мировой и отечественной практике применяют в основном два способа выщелачивания:
- непрерывное,
- и периодическое.
Каждый из них может осуществляться с разным числом стадий выщелачивания: от одной до трех. Кроме того, способы выщелачивания могут отличаться приемами подачи огарка в растворитель (прямое или обратное) и концентрацией кислоты на первой и второй стадиях.
Непрерывный способ выщелачивания позволяет с высокой эффективностью использовать гидрометаллургическое оборудование, так как при этом исключаются простои на заполнение и опорожнение аппаратуры, можно осуществить полную автоматизацию управления технологическим режимом, максимально сохранить тепло экзотермических реакций для последующих производственных операций. Однако этим способом можно успешно перерабатывать только высокосортное сырье стабильного состава. Переработка сырья низкого качества и переменного состава приводит зачастую к серьезным нарушениям технологического процесса. Непрерывный процесс выщелачивания требует также большого объема циркулирующих растворов для выщелачивания огарка.
При непрерывном процессе выщелачивания огарок и кислый раствор поступают на выщелачивание непрерывно в заданном массовом или объемном соотношении. При этом пульпа проходит серию последовательно установленных чанов с пневматическим или механическим перемешиванием.
Периодическое выщелачивание по сравнению с непрерывным отличается меньшей производительностью на единицу производственной площади, большей стоимостью и сложностью оборудования, требует непрерывного наблюдения за ходом процесса.
Периодический процесс характеризуется прежде всего прерывистым проведением операции выщелачивания и порционной дозировкой цинксодержащего материала и серной кислоты. В качестве оборудования для периодического процесса обычно используют чаны с механическим и реже с пневматическим перемешиванием. Каждая операция выщелачивания состоит из загрузки в чан очередной порции серной кислоты (отработанного электролита), оборотных растворов, обожженного концентрата, перемешивания их в течение определенного времени и выгрузки готовой пульпы в аппараты для отстаивания или фильтрации. Периодическое выщелачивание особенно пригодно для переработки низкосортного и сложного по составу сырья, так как оно обеспечивает возможность более жесткого контроля хода процесса и качества готовой пульпы.
Выбор той или иной схемы выщелачивания зависит от качества перерабатываемого сырья. При большом масштабе производства, устойчивом составе сырья и высоком его качестве более рационально непрерывное выщелачивание. Периодическое выщелачивание как более гибкий процесс целесообразно использовать при переработке сырья с повышенным содержанием примесей.
