
Непрерывное двухстадийное выщелачивание
Процесс ведут в чанах с воздушным перемешиванием (пачуках). Это обеспечивает более полное выщелачивание цинка и использование кислоты. Две стадии процесса – нейтральное и кислое выщелачивание.
Нейтральная стадия. Продолжительность нейтрального выщелачивания - 30-40 мин. Конечная цель нейтрального выщелачивания – получить цинксодержащий раствор, очищенный от гидролизующихся примесей. Как правило, в нейтральной стадии выщелачивании из огарка в раствор переводится не более 30–40 % Zn. Остальной цинк выщелачивается в кислой стадии. Выщелачивание на нейтральной стадии ведут растворами, полученными в кислой стадии выщелачивания. Основная цель этого цикла – нейтрализовать оставшуюся кислоту и довести растворы до рН, равного 5,2 – 5,5, т.е. создать условия для процессов очистки растворов. Раствор, полученный после нейтрального выщелачивания, содержит 100-110 г/л цинка и 1-5 г/л H2SO4.
Кислая стадия. Назначение этой стадии - перевести максимальное количество цинка в раствор из кека нейтральной стадии при минимальном извлечении примесей. Эта основная стадия в схеме непрерывного выщелачивания, именно в ней производится подготовка раствора к последующей очистке. При кислом выщелачивании используют отработанный электролит - относительно концентрированный раствор серной кислоты (около 100 г/л H2SO4) . Кислое выщелачивание заканчивается при достижении концентрации серной кислоты 2-3 г/дм3 и затем этот раствор идет в нейтральную ветвь схемы выщелачивания. Продолжительность кислой стадии выщелачивания – 45-50 мин.
Раствор, получаемый в процессе выщелачивания, содержит значительное количество примесей. Вместе с цинком в раствор переходят медь, кадмий, кобальт, никель, мышьяк, сурьма, железо, индий, германий и др. Такой раствор не пригоден для выделения из него цинка методом электролиза, и его подвергают очистке.
Твердый остаток – цинковый кек, в который переходят компоненты пустой породы, свинец, благородные и часть редких металлов, содержит некоторое количество цинка, в основном в виде сульфида и феррита. Выход кека составляет 20–30 % от массы огарка. Он содержит, %: 16–22 Zn; 2–5 Pb; 1–3 Cu; 0,1–0,3 Cd; а также In, Te, Tl, Ga, Ag, Au. Цинковые кеки перерабатываются пирометаллургическими или гидрометаллургическими методами с целью доизвлечения цинка и других ценных
Переработка кека от выщелачивания цинка
После выщелачивания цинкового огарка и фильтрации получают раствор, содержащий сульфат цинка, и твердый остаток от выщелачивания – кек.
Цинковый кек (полученный на стадии кислого выщелачивания) содержит около 20% цинка, индий, кадмий, свинец, медь. Для извлечения этих металлов его смешивают с коксовой мелочью и нагревают до 1250-1350 °С во вращающейся трубчатой печи – вельц-печи. Продуктами вельцевания являются вельц-окись, которая возгоняется, охлаждается и улавливается рукавными фильтрами, и медистый клинкер. В вельц-окиси содержится около 75% оксида цинка, оксиды кадмия, индия и свинца. Медистый клинкер содержит 3-4% меди и 30-35% железа. Вельц-окись направляется на выщелачивание, а клинкер отгружается на медные предприятия.
Выщелачивание вельц-окиси ведут отдельно от растворения цинкового огарка для извлечения индия и свинца в товарную продукцию. На первой стадии выщелачивания при конечном рН=3,8-4,6 в раствор переходят только цинк и кадмий. Этот раствор объединяется с раствором после выщелачивания цинкового огарка. На второй стадии выщелачивания при конечной кислотности 35-55 г/л серной кислоты в раствор переходит индий. Этот раствор направляется на извлечение индия. Остаток после выщелачивания – свинцовый кек, довыщелачивается для снижения потерь цинка и отгружается на свинцовые предприятия.
Очистка растворов.
Полученные после нейтральной стадии выщелачивания растворы содержат около 110 г/л цинка и различные примеси. Основными примесями цинковых растворов являются: Fe, Al, As, Sb, Cd, Ge, Cu, Co и кремниевая кислота (Н2SiO3). Для процесса электролиза растворы необходимо очистить от этих примесей.
Очистку растворов от примесей с помощью последовательных операций:
- гидролиза,
- цементации,
-добавкой химических реагентов, образующих с примесями труднорастворимые соединения.
Гидролитическое осаждение примесей происходит в конце стадии нейтрального выщелачивания и заканчивается при сгущении нейтральной пульпы - на этой стадии снижается кислотность раствора (рН<7 – кислая среда, рН=7 – нейтральная, рН>7 – щелочная), повышается рН раствора (рН – водородный показатель.[H+]=10-pH или pH= -lg[H+]) идет гидролиз. Гидролизом (т.е. осаждением в виде нерастворимого гидрооксида) можно выделить железо, мышьяк, сурьму, алюминий и частично медь. Осаждение железа протекает при окислении закисленного железа двуокисью марганца и кислородом воздуха и последующем гидролизе рН =5-5,5:
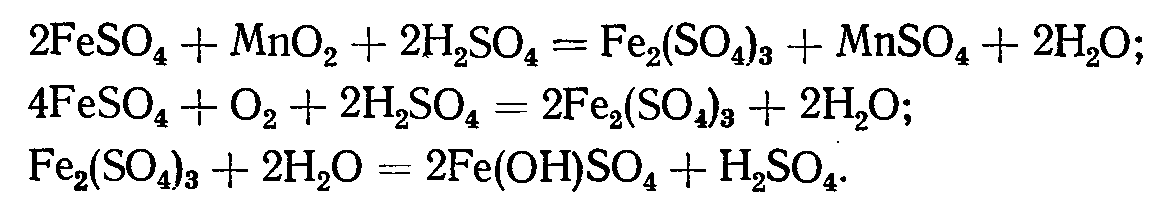
Одновременно с железом происходит гидролитическое осаждение мышьяка и сурьмы благодаря образованию труднорастворимых примесей арсената и антимоната железа (FeAsO4 и FeSbO4). Алюминий также достаточно полно гидролизуется при рН = 3,1-4. Гидролиз меди на стадии нейтрального выщелачивания проходит частично. Также не полностью удаляется германий.
Цементация - процесс вытеснения из раствора одного металла другим, более электроотрицательным.
Zn + МеSO4 →ZnSO4 + Me
Здесь Ме – медь, кадмий, никель.
Цементационную очистку растворов от меди и кадмия ведут в чанах с механическим перемешиванием в одну, две или три стадии.
Содержание вредных для электролиза примесей снижается до 0,3-0,4 мг/л и менее. Очищенный цинковый раствор с содержанием цинка 130-150 г/л направляется на охлаждение и удаление из раствора гипса и, далее, на электролиз цинка. Из осадков I стадии цементационной очистки извлекают кадмий.
Химическая очистка электролита от примесей проводят для выделения кобальта в самостоятельный кобальтовый кек. Химическое выделение кобальта, как правило, проводят с помощью ксантогената натрия, кобальт при этом осаждается в виде труднорастворимого соединения – ксантогената кобальта Co(C2*H2OCS2)3.
Очищенный от примесей нейтральный раствор сульфата цинка, поступающий на электролиз, должен содержать: 120-160 г/л Zn, и не более мг/л 0,2 Cu, 40 Fe, 3 Со, 2 никеля, 3 Cd, по 0,01 As, Sb и германия, 150 хлора.
Электролиз цинка из растворов
Электролизу подвергается раствор сульфата цинка, полученный при выщелачивании и прошедший очистку от примесей. Его состав неодинаков на разных заводах , г/л: 120 – 180 Zn; 2 – 10 Mn; 0,05 – 0,2 As; 0,01 – 0,015 Sb; 0,1 – 2,0 Cd; 0,2 – 5,0 Fe; 0,1 – 4,0 Co; 20 – 300 Cl; 20 – 50 F; 0,01 – 0,5 Ni; 0,05 – 0,12 Cu; 0,05 – 0,1 Ge.
Основные компоненты раствора – ионы Zn2+, SO4- , Н+, ОН-
Цинк – один из наиболее электроотрицательных тяжелых металлов. Его стандартный потенциал равен –0,76 В. В силу этого электроосаждение цинка из кислых растворов – один из самых неустойчивых электрохимических процессов.
На катоде идет реакция восстановления ионов Zn2+ из раствора до металлического состояния: Zn2+ + 2е → Zn0 Е= -0,76 В
На аноде электрическая энергия расходуется на разложение воды с образованием газообразного кислорода: Н2О – 2е → 0,5О2 + 2Н+
Теоретически при электролизе на катоде в первую очередь должны разряжаться ионы водорода (Е=0,0 В). Однако на катоде при повышенной плотности тока, высокой чистоте электролита, низкой его температуре и добавке в электролит поверхностно-активных веществ создается перенапряжение водорода. На перенапряжение водорода влияют материал катода, плотность тока, состав и температура электролита, состояние поверхности осажденного цинка:
- с повышением температуры электролита перенапряжение водорода снижается и это приводит к понижению выхода по току цинка.- электролит охлаждают
- в кислых растворах перенапряжение водорода снижается с повышением концентрации кислоты – концентрацию поддерживают на опред.уровне,
- катоды для электролиза цинка изготавливают из алюминия, т.к. на нем водород выделяется с большим перенапряжением (∆φH0 = 1,1 В).
В результате этого потенциал, при котором происходит разряд ионов водорода Н+, становится более электроотрицательным - близким или даже меньшим, чем надо для разряда ионов Zn2+. И на катоде осаждается цинк.
Электролитическое выделение цинка сопровождается накоплением в электролите серной кислоты, которая выделяется в соответствии с реакцией
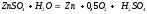 ,
,
На каждый грамм осаждённого цинка в растворе образуется приблизительно 1,5 г серной кислоты. Поэтому в электролите цинковых ванн всегда присутствует серная кислота. В определённом приближении, состав электролита в ванне можно считать следующим, г/л: 100 – 170 H2SO4 и 45 – 60 Zn.
Основными показателями электролиза являются:
- выход цинка по току, т.е. КПД использования тока, %;
- удельный расход электроэнергии, кВт·ч/ т катодного цинка;
- качество катодного цинка.
Выход по току при электроосаждении цинка зависит от концентрации цинка и серной кислоты в электролите, плотности тока, температуры, загрязненности электролита примесями и состояния катодной поверхности. Он составляет 88-92%.
Затраты на электроэнергию составляют значительную долю себестоимости электролиза. Эффективность использования электроэнергии в процессе электролитического осаждения цинка оценивают по удельному расходу электроэнергии на 1 т катодного цинка. Оптимальные значения плотности тока при электролизе цинковых растворов равны 450–700 A/м2, расход электроэнергии составляет 3000–3300 кВт·ч/т (для меди – 230-350 кВт*ч/т). Расход электроэнергии при электролизе цинка высок еще и потому, что здесь работа электрического тока затрачивается не только на перенос ионов через электролит, но и на хим.реакцию
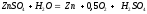 .
.
Качество катодного осадка зависит от плотности тока, чистоты электролита, содержания в нем цинка и серной кислоты, температуры, продолжительности наращивания осадка на катоде. Положительное влияние на структуру катодного осадка оказывает желатин и столярный клей. Добавка к электролиту этих веществ приводит к образованию на катоде гладкого мелкокристаллического осадка с весьма высокими антикоррозийными свойствами.
При очистке нейтральных растворов не удается полностью удалить примеси, и они могут существенно влиять на показатели электролиза. По своему электрохимическому поведению в процессе электролиза примеси в цинковом растворе можно разделить на 4 группы:
- катионы металлов, более электроположительные, чем цинк,
- катионы металлов, более электроотрицательные, чем цинк
- анионы,
- органические примеси.
Ванны для электролиза цинка изготовляют в основном из железобетона. Внутренние стенки ванны футеруют рольным свинцом, полихлорвинилом или листовым винипластом. Из винипласта делают также и обортовку ванн и сливные пробки. Винипластовая футеровка, в отличие от свинца, исключает возможность замыкания на корпус, но трудоемкость изготовления и растрескивание при эксплуатации снижают ее достоинства. Лучше себя зарекомендовала футеровка из полихлорвинила.
Ванны располагают в здании цеха рядами по 20–30 ванн. Между рядами ванн имеются проходы для обслуживания.
Корпус ванны устанавливают на железобетонную раму, стоящую на столбах высотой 2 м. Ванна опирается на четыре изолятора из стекла или фарфора. Для отвода раствора ванны снабжены сливными носиками, изготовленными из винипласта или свинца. Днище ванны имеет отверстие для аварийного стока электролита и смыва шлама. Ванна рассчитана на силу тока 15–20 кА. Число катодов и анодов зависит от размера ванны и от расстояния между электродами. Катодов на 1 меньше, чем анодов (при электролизе меди наоборот). Обычная практика – 28-32 катода и 29-33 анода. Расстояние между осями одноименных электродов на отечественных заводах принято 58–60 мм, на большинстве зарубежных заводов 70–80 мм.
Аноды отливают из свинца чистотой 99,99 % с добавкой 1 % серебра для придания анодам механической прочности и химической устойчивости. Поверхность анода выполняют гладкой или рифленой. Анодные штанги делают из медной освинцованной шины и приваривают к анодному полотну.
Катоды изготовляют из холоднокатаного алюминиевого листа толщиной 3–4 мм, т.к. на нем водород выделяется с большим перенапряжением (∆ЕH0 = 1,1 В).
На показатели электролиза существенно влияет состав электролита: содержание в электролите кислоты, цинка и примесей. Повышение кислотности электролита уменьшает напряжение на ваннах (растёт электропроводность электролита), улучшает качество катодного цинка (подавляется дендритообразование и образуются осадки более плотные и гладкие); уменьшает циркуляцию цинка с отработанным электролитом.
Один раз в 48 часов (иногда – в 24 ч) катоды вынимают из ванны и отправляют на сдирку катодного цинка с алюминиевых матриц. Шлам, получающийся при электролизе, состоит из MnO2(70%), 10-14% Pb и 2% Zn. Он образуется при анодном окислении солей марганца и соединений свинца. Шлам образуется на аноде, откуда его периодически счищают. Шлам идет на стадию нейтрального выщелачивания для окисления железа.
Катодный осадок цинка, в отличие от других металлов (медь, никель), не является конечным товарным продуктом цинкового завода. Катодные листы, имеющие развитую поверхность, на воздухе окисляются и, кроме того, они не удобны при хранении. Поэтому их переплавляют в индукционных печах с добавкой флюса – хлористого аммония (NH4Cl 0,5–0,6 % от массы цинка).
Хлористый аммоний разрушает оксидную пленку на поверхности катодных листов и способствует слиянию корольков расплавленного металла. Впоследствии при плавке аммиак улетучивается с газами.
Производительность индукционных печей емкостью 20 т составляет 100–120 т/сут. Разливку металла проводят на карусельных или прямолинейных разливочных машинах.
Цинк металлический изготавливается в виде чушек массой 22-24 кг, и в зависимости от химического состава различают следующие марки (чаще всего марка цинка определяется содержанием в нем свинца
Металлургия алюминия
Алюминий относится к группе легких металлов. По цвету чистый алюминий напоминает серебро. Плавится алюминий легко – при 660°С, зато кипит лишь при 2452° С. Чистый алюминий – довольно мягкий металл – почти втрое мягче меди, поэтому даже сравнительно толстые алюминиевые пластинки и стержни легко согнуть, но когда алюминий образует сплавы (их известно огромное множество), его твердость может возрасти в десятки раз. Алюминий – один из самых распространённых металлов в природе: его доля в земной коре составляет до 8,8%. Но в чистом (самородном) виде А1 никогда не встречается из-за своей высокой химической активности.
Свойства алюминия:
Малая плотность - 2,7 г/см3. А1 – легкий металл (плотность менее 5 г/см3)
Высокое химическое сродство к кислороду. При восстановлении оксида алюминия углеродом восстанавливаются примеси, а сам металл остается в оксидной форме. Для восстановления самого металла требуются высокие температуры и, в идеале, вакуум.
Все легкие металлы обладают высокой электропроводностью и теплопроводностью. По электропроводности алюминий – на 4-м месте, уступая лишь серебру (оно на первом месте), меди и золоту, что при дешевизне алюминия имеет огромное практическое значение. В таком же порядке изменяется и теплопроводность металлов.
Производство алюминия очень энергоемкое. Так, например, для получения 1 тонны меди расходуется около 3000 кВт/ч электроэнергии; для получения одной тонны алюминия необходимо затратить от 14 до 17 тысяч кВт/ч.
А1 обладает отрицательным электрохимическим потенциалом разряда ионов на катоде (-1,67 В). Это приводит к тому, что алюминий, как и все легкие металлы, невозможно получать электролизом водных растворов (на катоде будет восстанавливаться только водород – будет идти процесс разложения воды), а только электролизом расплавов либо органических растворов.
Руды всех легких металлов, в том числе и алюминия, содержат в себе много химических элементов, что требует их комплексного использования.
Алюминий является амфотерным элементом – его соединения могут проявлять как кислотные, так и основные свойства; он реагирует с соляной и серной кислотами, а вот с азотной кислотой и с органическими кислотами – не реагирует. Он очень хорошо реагирует со щелочами. Хим. активность алюминия весьма высока. Алюминий обладает большим химическим сродством к кислороду. Поэтому на воздухе он теряет свой блеск, покрываясь тонкой, но очень прочной, сплошной, беспористой пленкой оксида алюминия. Эта пленка защищает алюминий от дальнейшего окисления и придает металлу большую коррозионную стойкость.
Рудная база алюминиевой промышленности
По распространенности в земной коре алюминий занимает третье место. Из 1500 известных минералов на долю алюминиевых приходится 250, в числе которых примерно 100 относятся к алюмосиликатам. Из-за малой концентрации алюминия большинство этих минералов непригодно для рентабельной переработки.
Все алюминиевые минералы можно разделить на следующие группы:
Оксиды – Al2O3 в чистом или загрязненном виде. Различают несколько модификаций оксида алюминия, но наиболее широко применяются альфа-Al2O3 (корунд, самый твердый минерал из присутствующих в природе – в чистом виде он присутствует в драгоценных минералах – сапфир, рубин и т.д.) и гамма-Al2O3.
Гидроксиды – а) гиббсит Al(OH)3, б) байерит Al(OH)3, в) бемит AlOOH, г) диаспор AlOOH
Алюмосиликаты – Нефелин (Na, K)2O*Al2O3*2SiO2
Шпинели – МеО*Al2O3
Гидроалюмосиликаты – продукты разложения алюмосиликатов. Представитель этой группы – каолинит Al2O3*2SiO2*2H2O
Сульфаты – представителем сульфатов является алунит Na(K2SO4)*Al2(SO4)3*4Al(OH)3
Галлоиды – представителем является криолит Na3AlF6 (3NaF*AlF3)
Требования к алюминиевому сырью.
Горная порода может служить алюминиевым сырьем, если она удовлетворяет следующим требованиям:
Содержит большое количество глинозема Al2O3.
Извлечение глинозема из этой породы не представляет больших трудностей.
Месторождение должно быть большим и компактным.
Всем этим требованиям удовлетворяют две основные породы – бокситы и нефелины. И, частично, еще две - алуниты и гидроалюмосиликаты (глины).
Боксит.
Основным рудным сырьем для производства алюминия являются бокситы. Боксит – это горная порода, состоящая в основном из гидроксида алюминия, оксидов и гидроксидов железа, а также из кварца, двуокиси титана, и примеси минералов многих других элементов. В мире на сегодняшний день около 95% глинозема получают именно из бокситов.
Средний химический состав бокситов:
Al2O3 30-80%; Fe2O3 < 50%; SiO2 < 20%; TiO2 < 10%; CaO < 5%.
О качестве бокситов судят по содержанию глинозема Al2O3 и кремнезема SiO2. Чем больше глинозема и меньше кремнезема, тем лучше боксит. Для этого служит важнейшая характеристика бокситов - кремневый модуль - соотношение Al2O3/SiO2; чем он выше – тем выше качество боксита. Для богатых руд он равен 10-15, для бедных 3-4. Практикой установлено, что различные по качеству бокситы целесообразно перерабатывать разными методами.
Минералогический состав бокситов.
В состав бокситов входит до 100 минералов, содержащих свыше 40 химических элементов. Основные элементы:
1-й и основной минерал – это глинозем (Al2O3). В бокситах глинозем в основном находится в гидроксидах. В зависимости от того, в какой форме находится глинозем в боксите, различают 4 группы бокситов:
Корундовые бокситы Al2O3
Гиббситовые бокситы - Al(OH)3
Диаспор-бемитовые бокситы – в виде AlOOH
Смешанные бокситы – гиббсит-бемитовые бокситы – в виде смеси Al(OH)3 и AlOOH
Самым легковскрываемым бокситом является гиббситовый. Самым трудновскрываемым – диаспор-бемитовый.
2-й основной минерал - кремнезем – SiO2.
3-я группа минералов - железосодержащие минералы. Оксиды, гидроксиды железа, карбонаты железа, силикаты железа (шамуазит – 4FeO*Al2O3*3SiO2*4H2O), сульфиды и сульфаты железа.
4-й – диоксид титана, TiO2. В чистом виде – минералы анатаз, брукит, рутил.
5 – минералы, содержащие углекислоту. Кальцит – CaCO3.
6 – органические вещества
7 – минералы серы
8 – минералы фосфора
9 – минералы, содержащие щелочь
10 – малые примеси (Mo, Ni, Cr, Zn, Cu, W, Ga, Sc)
Нефелин. (Na,K)2O*Al2O3*2SiO2*2H2O
Нефелин – это высококремнистое сырье. Нефелин экономически выгодно перерабатывать лишь комплексно, так как содержание глинозема в нем не очень высокое – до 28%, кроме того, для того чтобы переработать нефелины методом спекания, они должны содержать не более 5% Fe2O3. Поэтому эти руды необходимо обогащать. Для обогащения могут быть использованы методы магнитной сепарации и флотации. Разработана технологическая схема, позволяющая получать из нефелина глинозем Al2O3, соду Na2CO3, поташ K2CO3, цемент, редкие металлы.
Алунит. (Na,K)2SO4*Al2(SO4)3*4Al(OH)3
Это комплексное сырье. Разработана схема получения из него глинозема, сульфатов натрия и калия, серной кислоты, редких металлов и элементарной серы. Эти руды перед металлургической переработкой обогащают флотацией.
Каолин Al2O3*2Н2O*2SiO2
Каолин – это белая огнеупорная глина, содержащая небольшое количество примесей. Это сырье является низкокачественным, несмотря на то, что содержание Al2O3 около 37%. Но при этом содержание SiO2 - до 60%. Т.е. это очень высококремнистое сырье Для производства глинозема пригодны лучшие сорта каолина, содержащие 36-39% Al2O3.
Производство алюминия складывается из двух процессов:
1. Производство глинозема A12О3 из бокситов или нефелинов,
2. Производство алюминия из глинозема.
К этим двум основным процессам непосредственно примыкают еще два процесса: производство криолита (3NaF*A1F3) и фтористых солей, в расплаве которых идет электролиз алюминия, и производство угольных изделий . Эти продукты изготавливаются по довольно сложным технологиям, поэтому современная алюминиевая промышленность включает в себя, по существу, 4 производства: глинозема, криолита, электродов и производство алюминия из глинозема.
Производство глинозема по способу Байера
Из богатых бокситов глинозем извлекают по способу Байера - мокрым щелочным способом (гидрохимическим). Этот способ является в настоящее время преобладающим в мировой алюминиевой промышленности. В основу способа Байера легли два сделанных им важных открытия:
- он установил, что растворы алюмината натрия (NaAlO2) при введении в них как затравки свежеосажденного гидроксида алюминия (Al(OH)3), разлагаются с выделением гидроксида алюминия (Al(OH)3),
- оставшийся от разложения раствор после его упарки может вновь растворять глинозем, имеющийся в бокситах, если такое растворение проводить путем интенсивного перемешивания в закрытых сосудах при температуре 160-170 С (в автоклавах).
Эти два процесса – непосредственное выщелачивание глинозема из боксита щелочными растворами с получением алюминатного раствора и самопроизвольное разложение алюминатного раствора с выделением гидрооксида алюминия – и составляют сущность способа Байера.
Цель переработки сырья – перевести глинозем в раствор, а примеси оставить в осадке.
Подготовка боксита к выщелачиванию
В зависимости от минералогического состава и физико-химических свойств боксита подготовка боксита на различных заводах может быть различной и включать такие процессы, как обогащение, дробление, тонкое измельчение (сухой или мокрый размол), сушка, иногда обжиг.
Один из видов обогащения боксита – мойка его проточной водой, освобождающая боксит от примесей глины, песка и т.д. Процесс этот выполняют на месте добычи боксита (на руднике) и применяют по отношению к глинистым бокситам.
Когда боксит прибывает на глиноземный комбинат, его дробят. Дробление обычно проводят в две или три стадии. Сначала боксит попадает на крупное дробление в молотковых дробилках до крупности 60-85 мм. Далее боксит идет на среднее дробление в конусные дробилки, куда подают известь в количестве от 3 до 5 % от массы боксита для интенсификации последующего процесса выщелачивания бокситов. Крупность после среднего дробления – 25-30 мм. Затем шихта (боксит+известь) поступает в шаровые мельницы, куда подается так же каустик (Na2Ok) и часть оборотного раствора. Отношение Ж:Т в мельнице держат на уровне 0,8. Это сделано для того, чтобы повысить коэффициент измельчения шихты. Шихта измельчается не только шарами мельницы, но и сама по себе - в результате ударов кусков боксита друг о друга.
После мельницы пульпа поступает в классификатор, где происходит разделение мелкой и крупной фракции, сюда же добавляют остатки каустика и оборотного раствора для получения соотношения Ж:Т= 6,5.
Пески оседают в корыто классификатора, а тонкая фракция уносится в мешалку сырой пульпы. Пески отправляются на вторую стадию размола.
В мешалках пульпа выдерживается в течение 4-6 часов, где она усредняется и частично обескремниевается:
SiO2+2NaOH = Na2SiO3 р-р + H2O
Подготовленный подобным образом боксит в виде пульпы идет на выщелачивание.
Выщелачивание боксита
Процесс выщелачивания боксита заключается в обработке измельченной руды растворами едкого натра или оборотными растворами при повышенном давлении и температуре (в автоклавах). Цель выщелачивания– перевести глинозем боксита в раствор, а примеси оставить в красном шламе – твердом остатке.
Химизм выщелачивания важнейших компонентов боксита А1203, Fe2O3, SiO2, TiO2 при этом сводится к следующему:
Основная реакция процесса - гидроксиды алюминия при воздействии на них концентрированной NaOH образуют растворимый алюминат натрия по реакции:
Al2O3*nH2O + 2NaOH = 2NaAlO2 + (n+1)H2O ,
В то время как Fe2O3 и значительная часть SiO2 пустой породы остаются в твердом остатке (шламе). В раствор может переходить некоторое количество SiO2 в виде силиката натрия:
Si02 +2NаОН = Na2Si03( р-р) + Н20.
При взаимодействии силиката натрия Na2SiО3 с алюминатом натрия NaAlO2, образуется нерастворимая соль - алюмосиликат натрия (пермутит), выпадающая в осадок:
2Na2SiО3+2 NaAlO2+4 Н20= Na2О* Al2O3*2 SiО2*2 Н20 +4 NаОН
Этот побочный процесс уменьшает извлечение из боксита алюминия, увеличивает потери щелочи, ухудшает обезвоживание пульпы. Измельчение боксита совместно с определенным количеством СаО значительно снижает этот отрицательный эффект благодаря образованию нерастворимого силиката кальция .
Прочие примеси, которые присутствуют в боксите в небольших количествах (кремний, фосфор, хром, ванадий, галлий и органические вещества, сера) обычно переходят в раствор, но в дальнейшем либо не высаживаются совместно с глиноземом из раствора, либо высаживается незначительно.
Таким образом, раствор, получаемый в результате выщелачивания боксита, представляет собой раствор алюмината натрия NaAlO2, загрязненный небольшими количествами примесей – соединениями кремния, фосфора, хрома, ванадия, галлия и органических веществ.
Основную массу твердого остатка от выщелачивания - красного шлама – составляют оксид железа Fe2O3 и натриевый алюмосиликат (Na2О*Al2O3*2 SiО2*2Н20).
Технология выщелачивания боксита в автоклавах.
Сырую пульпу после измельчения перекачивают насосами в систему трубчатых подогревателей, где с помощью сепараторного (острого) пара пульпу нагревают до 145-160С. Подогретую пульпу направляют в автоклавную батарею, состоящую из 8-10 аппаратов. Первые два автоклава являются греющими, т.к. в них подается острый пар. Пульпа нагревается до 220-230оС и под давлением проходит через всю батарею. Автоклавы работают в непрерывном режиме. Подводимый снизу пар подогревает пульпу и перемешивает ее. По окончании выщелачивания пульпа из автоклава вытесняется через вертикальную разгрузочную трубу под давлением пара, заполняющего свободное пространство над пульпой.
Из последнего автоклава пульпа с температурой примерно 220оС и давлением около 23 атм выгружается в сепаратор первой ступени, где за счет резкого снижения давления пульпа вскипает с выделением большого количества пара. В первом самоиспарителе (сепараторе) пульпа охлаждается до 180оС. Давление падает до 7-8 атмосфер. Образующийся здесь сепараторный пар идет на нагрев сырой пульпы в трубчатых подогревателях.
Из первого сепаратора пульпа поступает в аппарат второй ступени, где давление снижается до 1-1,5 атмосфер. Здесь так же образуется сепараторный пар, но уже меньших параметров, который используют для нагрева воды для промывки красного шлама. Здесь температура снижается уже при атмосферном давлении до 105°С. Из второго сепаратора пульпу подают на участок разделения пульпы и раствора в сгустители или гидроциклоны. Пар из самоиспарителя используется для подогрева растворов.
Самоиспаритель (сепаратор) представляет собой полый цилиндр со сферическим верхним и коническим нижним днищем. Посередине цилиндрической части самоиспарителя приварена труба, по которой поступает пульпа из автоклава. Пульпа выпускается из самоиспарителя через нижнее коническое днище, а пар отбирается по паропроводу, присоединенному в центре верхнего сферического днища.
Извлечение Al2O3 из боксита при выщелачивании обычно составляет около 85%. Концентрация алюминатного раствора после выщелачивания 160-170 г/л Al2O3, ж:т = 9:1.
Разбавление автоклавной пульпы и отделение алюминатного раствора от красного шлама.
Пульпа, разгружаемая из самоиспарителя, направляется на разбавление. Назначение этой операции — уменьшение концентрации алюминатного раствора и увеличение ж:т в пульпе для того, чтобы:
Обеспечить большую эффективность протекания процесса разложения алюминатного раствора с выделением гидроксида алюминия
Более глубоко обескремнить раствор
Облегчить отстаивание и сгущение красного шлама
уменьшить износ фильтровальных полотен во время осветления алюминатного раствора.
Пульпу разбавляют в чанах с мешалками, куда для этой цели направляют промывные воды от промывки красного шлама. Общий объем пульпы в результате разбавления увеличивается в два раза. Отношение Ж:Т равно 19,5:1. Отделение алюминатного раствора от красного шлама и промывку последнего проводят в системе непрерывно действующих сгустителей. Температура пульпы составляет 90-100 С, допустимое количество твердого вещества в сливе (алюминатном растворе) — не более 1 г/л, ж:т в шламе — 3,5:1. Для ускорения сгущения красного шлама в него часто добавляют коагулянты (вещества, способствующие слипанию мелких частиц в более крупные. При этом между частицами остаются тонкие водные прослойки). Обычно это крахмал, ржаная мука в количестве 0,15-0,25% от массы шлама. Эти вещества ускоряют осаждение шлама и уменьшают содержание твердых частиц в сливе. Используют и высокополимерные флокулянты — сепаран и полиакриламид. Расход 60-100 г и 1-1,2 кг на 1 тонну шлама.
Алюминатный раствор, сливающийся из сгустителя, фильтруют для удаления увлеченных частиц красного шлама. Шлам, выгруженный из сгустителя, промывается в серии каскадно расположенных промывателей. Отделенный от раствора, красный шлам содержит 12-15% А1203, 5-11% Si02 и около 50% Fe203, и может служить сырьем для извлечения железа и алюминия, редких элементов, но, как правило, после промывки шлам направляют в хвостохранилища. На каждую тонну полученного оксида алюминия приходится от 360 до 800 кг шлама. Шлам складируют на тщательно изолированных территориях – шламохранилищах. Осветленный алюминатный раствор характеризуется следующими показателями: 120 г/ л Al2O3, 150 г/л Na2O, весовое соотношение Al2O3:SiO2 — не ниже 250-300. Осветленный раствор направляется на разложение.
Декомпозиция алюминатного раствора (разложение алюминатного раствора выкручиванием) и выпаривание маточного раствора
Отделенный от шлама раствор подают на декомпозицию - процесс, в ходе которого происходит выделение кристаллического А1(ОН)3. Для этого раствор разбавляют водой (с целью снижения концентрации NaOH) и охлаждают до 50-55°С (в трубчатых теплообменниках). В этих условиях раствор становится пересыщенным и большая часть А1(ОН)3 выпадает в осадок. Процесс кристаллизации ускоряется в результате введения в раствор затравки - мелких кристаллов А1(ОН)3. Таким образом, алюминатные растворы подвергаются гидролизу с выделением в осадок кристаллической гидроокиси алюминия:
NaAlO2 + 2H2O ↔ NaOH + Al(OH)3
Ускорение разложения алюминатных растворов может быть достигнуто механическим перемешиванием и введением затравки - свежеосажденной гидроокиси алюминия. Одновременное воздействие этих факторов (перемешивания и введения затравки) на алюминатные растворы носит название «выкручивания» (декомпозиции). Операция выкручивания - достаточно сложный процесс. Продолжительность – около 3-х суток. Она состоит из двух стадий:
Гидролиз алюминатного раствора
Кристаллизация гидроксида алюминия
Именно вторая стадия и ускоряется введением достаточного количества центров кристаллизации (затравки) и перемешиванием. На выкручивание оказывают влияние и другие факторы, которые в производственных условиях должны сочетаться таким образом, чтобы обеспечить возможно более высокий выход глинозема при минимальной продолжительности операции, наилучшем использовании аппаратуры и высоком качестве получаемого гидрата.
Это следующие факторы:
Каустическое отношение алюминатного раствора (Na2Oк/Al2O3)
Температурные условия процесса
Концентрация раствора
Количество и качество затравки
Характер перемешивания
Чистота алюминатного раствора
Выход глинозема — это процентное отношение глинозема, выделившегося в осадок, к глинозему, содержащемуся в разлагаемом растворе.
Каустическое отношение алюминатного раствора служит показателем, по изменению которого во времени судят обычно о скорости разложения раствора.
Влияние каустического отношения (Na2Oк/Al2O3). С уменьшением каустического отношения исходного алюминатного раствора выкручивание протекает более интенсивно. Сильно снижать модуль раствора нельзя, потому что разложение может начаться уже при сгущении красного шлама, что приведет к дополнительным потерям глинозема.
Влияние концентрации раствора - растворы средней концентрации являются менее стойкими и разлагаются быстрее, чем разбавленные и концентрированные растворы.
Влияние температуры. При понижении температуры процесс выкручивания значительно ускоряется: снижение температуры алюминатного раствора с 80 до 30С сильно ускоряет процесс, но при этом образуется очень мелкодисперсный гидрооксид алюминия, кроме того, при температуре ниже 30С процесс разложения снова замедляется, поэтому на практике температура процесса составляет около 45-55 С.
Влияние количества и качества затравки. Роль свежеосажденного гидроксида алюминия при выкручивании заключается в создании центров кристаллизации в массе алюминатного раствора, что ускоряет его разложение. В процессе разложения алюминатного раствора кристаллы затравки укрупняются. Количество затравки в алюминатном растворе, поступающем на выкручивание, характеризуется т. н. Затравочным числом, или затравочным отношением. Это весовое отношение Al2O3, содержащегося в затравке, к Al2O3 алюминатного раствора. На практике затравочное отношение принимают не ниже 1.
Чистота затравки. В производственных условиях с затравкой в исходный алюминатный раствор может поступить значительное количество щелочного раствора с высоким каустическим отношением (3,8), это приводит к тому, что каустическое отношение алюминатного раствора после смешивания с затравкой повышается, что замедляет процесс выкручивания, поэтому затравку предварительно тщательно отмывают от щелочного раствора.
Влияние перемешивания. Перемешивание в процессе выкручивания производят для того, чтобы, во-первых, поддержать затравку во взвешенном состоянии и обеспечить наибольшую поверхность соприкосновения ее с раствором, и, во-вторых, чтобы облегчить выравнивание концентрации раствора.
Разложение алюминатных растворов осуществляется в аппаратах, которые называются декомпозеры. Применяются декомпозеры с механическим и с воздушным перемешиванием. Продолжительность процесса кристаллизации - декомпозиции до 100 ч.
Декомпозеры с механическим перемешиванием имеют несложное устройство - это цилиндрический резервуар высотой 22м и диаметром 7,5 м (вместимостью до 3000 м3), внутри которого вращается (скорость вращения 8-10 об/мин) цепная мешалка. Декомпозеры с сифонами соединяются в серии 9-10 штук. Выкручивание — непрерывный процесс. В головной декомпозер непрерывно поступает алюминатный раствор и затравка гидроксида алюминия. Из хвостовых декомпозеров отбирается полученная гидратная пульпа. Скорость перемещения алюминатного раствора регулируют так, чтобы от головного декомпозера серии до хвостового раствор проходил за 90-100 часов. По мере перемещения алюминатного раствора, каустическое отношение его повышается с 2 до 4, ж:т в пульпе уменьшается с 7:1 до 4:1. Температура в головном декомпозере = 60С и постепенно снижается до 30-40 градусов. Температурный перепад от одного декомпозера к другому 2-3С.
Итак, после процесса декомпозиции получают 2 продукта:
- твердый продукт - гидратную пульпу (А12О3*3Н2О или 2А1(ОН)3 )
- жидкий продукт - маточный раствор.
Гидратная пульпа, выходящая из хвостового декомпозера, направляется в сгустители, откуда часть сгущенного гидратного шлама (50-75% от выделившегося гидроксида) идет на классификацию - пульпу разделяют на крупную и мелкую фракции – частицы разделяют по крупности во взвешенном состоянии, т.е. в потоках раствора. Для отбора частиц используют как различие в скорости падения крупных и мелких частиц, так и разное их сопротивление при пересечении потоков жидкости. В результате этого в разных частях гидроциклона собираются разные по крупности частицы. Классификацию проводят в гидроциклонах.
После окончания процесса классификации мелкие частицы с основной массой раствора попадают в сгуститель, где происходит разделение твердой и жидкой фаз. После этого мелкие кристаллы гидроксида алюминия подают на барабанные вакуум-фильтры, промывают от остатков алюминатного раствора и направляют в качестве затравки обратно на декомпозицию - в головные декомпозеры в качестве затравки. А крупные кристаллы Al2O3 идут на дополнительную промывку в систему промывателей. Промытую крупную фракцию гидратной пульпы фильтруют в вакуумных фильтрах, после чего гидроксид алюминия поступает на завершающую операцию процесса производства глинозема - кальцинацию.
Выход глинозема при выкручивании составляет в среднем 53%.
Выпаривание маточного раствора
Маточный раствор после декомпозиции поступает на первую операцию производства глинозема – выщелачивание боксита. Но концентрация получаемого при декомпозиции маточного раствора значительно ниже необходимой для выщелачивания боксита. Поэтому для удаления избыточной воды и повышения концентрации маточного раствора его предварительно упаривают. Раствор после декомпозиции содержит примерно 140 г/л Na2Oк, а для выщелачивания бокситов используется раствор с содержанием до 280-300г/л щелочи. Таким образом, задача выпарной батареи - испарить лишнюю воду из маточного раствора с тем, чтобы поднять его концентрацию до нужной величины. Дополнительная трудность возникает здесь в связи с тем, что в маточном растворе содержится в растворенном состоянии много карбонатной щелочи - содыNa2СO3. Она попадает туда при выщелачивании бокситов: содержащиеся в боксите карбонаты кальция, магния, железа и др. металлов при взаимодействии с едким натром дают соду, которая сохраняется в растворенном состоянии в маточном растворе. Если эта сода не будет удалена, то вместе с едким натром она попадает в передел выщелачивания и начнет раз от раза накапливаться в процессе.
Маточный раствор после декомпозиции с содержанием примерно 140 г/л Na2Oк , 65 г/л Al2O3, направляется на выпарку. Выпаривание позволяет подготовить раствор к его повторному использованию для выщелачивания боксита. Выпаривание происходит в два этапа:
- удаление избыточной воды, которое было введено с промывной водой. Этот процесс называется «выпарка» и ведут его в выпарных батареях – т.е. в нескольких выпарных аппаратах (обычно 4-6 шт), соединенных между собой последовательно. Подлежащий упарке раствор подается в первый выпарной аппарат, затем во второй и т.д. При выпаривании маточного раствора часть воды превращается в пар. Классическая схема упаривания – это упаривание раствора в трехкорпусной прямоточной выпарной батарее.
По мере выпаривания воды и, соответственно, при повышении концентрации раствора, из раствора выпадает осадок моногидрата соды - Na2СO3*Н2О. Полученный после упаривания раствор направляют в отстойник, затем отстоявшийся раствор с содержанием 300-310 г/л Na2O и каустическим модулем 3,8 возвращается на выщелачивание, а осадок (сода) идет на регенерацию щелочи – второй этап процесса выпаривания.
- регенерация щелочи (каустификация). Сода Na2СO3*Н2О, которая образуется при выщелачивании из-за растворения карбонатов шихты, связывает едкий натр, его необходимо превратить обратно в каустическую щелочь. Для этого отфильтрованный на первой стадии выпаривания осадок кристаллической соды растворяют в воде, и полученный раствор обрабатывают известью при постоянном перемешивании и температуре 90-95 С. Образуется раствор едкого натра NaOH (каустической щелочи) и белый шлам (СаСО3), который направляют в отвал. Полученный раствор смешивают с раствором, полученным после первой стадии выпаривания, и направляют на выщелачивание. Для восполнения потерь щелочи (из-за образования нерастворимых соединений, потерь из-за неплотностей в аппаратуре и т.д.) в процесс вводят свежую щелочь.
Кальцинация (обезвоживание) гидроксида алюминия
Назначение кальцинации – полное обезвоживание гидроксида алюминия при высокой температуре и получение практически безводного глинозема, достаточно негигроскопичного (не впитывающего влагу). Это сложный процесс, заключающийся в диссоциации и структурных превращениях обезвоживаемого продукта. При кальцинации влага удаляется в два приема :
- при 225 С удаляется две молекулы воды, при этом А1(ОН)3 (или это А12О3*3Н2О - 2А1(ОН)3) превращается в моногидрат А12О3*Н2О (или 2А1ООН),
- при 500 С удаляется последняя, третья молекула воды, моногидрат переходит в гамма- А12О3.
Таким образом, при температуре выше 500 С мы имеем дело уже с безводным глиноземом. Таким образом, гидрооксид алюминия в процессе кальцинации последовательно проходит следующие структурные превращения:
А1(ОН)3 ->А1ООН-> гамма-А12О3-> альфа -А12О3(корунд)
Эти превращения завершаются при температуре 1200 С, при которой и ведут процесс кальцинации. Обезвоживание гидроксида алюминия - кальцинацию - осуществляют, как правило, в трубчатых вращающихся печах. Трубчатая вращающаяся печь – традиционный агрегат для кальцинации – стальная труба длиной 50-150 м и диаметром 2,5-5 м. Футеруется такая печь шамотным кирпичом. Наклон печи – 2-5% к длине. Печь опирается на ролики и вращается со скоростью 1-2 об/мин. Обогревается печь с нижнего конца газом или мазутом. Загрузка осуществляется с верхнего конца, там же отводятся печные газы. Гидрооксид алюминия медленно перемещается в печи благодаря ее вращению и наклону навстречу горячим газам, медленно теряет влагу и превращается в глинозем. Пройдя всю печь, глинозем пересыпается в холодильник. Чаще всего, холодильник устроен так же, как печь. Но он имеет меньшие размеры (дл.20-30 м и диаметр 1,5-2 м) и кладку только на 1/3 длины. Глинозем охлаждается воздухом, просасываемым через холодильник, и водой, которая орошает снаружи кожух холодильника.
Выпускной конец холодильника снабжен сеткой, которая задерживает спекшиеся образования, куски выкрошившейся футеровки, попадающие в глинозем. Прошедший через сетку прокаленный глинозем взвешивают и направляют в бункера на хранение, а оттуда – на электролиз.
Загрузочная часть печи соединена с пылевой камерой и электрофильтром. Газы, выносимые из печи, содержат до 80 г/м3 А12О3 и они подвергаются тщательной очистке. В атмосферу сбрасываются газы с 0,5 г/м3 А12О3.
Общая продолжительность процесса кальцинации – около 1,5 часов.
Кроме способа Байера для производства глинозема используют еще 2 способа:
- способ спекания,
- комбинированный способ «Байер-спекание».
Кремнеземистые бокситы (с содержанием SiO2 больше 5%) перерабатываются по способу спекания. Принцип выделения А1203, из руды остаётся тем же, что и в способе Байера:
- перевод глинозема в растворимое состояние,
- отделение алюминатного раствора от шлама (пустой породы),
- выделение А1(ОН)3 из раствора в кристаллический осадок.
Отличия от процесса Байера связаны с необходимостью освободиться от
повышенного содержания Si02 в боксите. Для этого
1. В состав шихты для выщелачивания А12О3 вводится каустическая сода Na2C03, а также значительное количество известняка (СаСО3), СаО которого должен связывать SiO2 в нерастворимый силикат кальция 2СаО*SiО2. Шихту составляют таким образом, чтобы выполнялись соотношения:
|
|
|
CaO/SiO2=2, (K2O+Na2O)/(Al2O3+Fe2O3)=1
j((K2O+Na2O)/(Al2O
Для повышения эффективности последующих процессов приготовленную шихту измельчают в шаровых мельницах в содовом растворе.
2. В способе Байера химическое взаимодействие А12О3 боксита и NaOH и перевод в раствор алюмината натрия происходят одновременно и в одном аппарате - автоклаве. В способе спекания эти процессы разделены: вначале в печи при высоких температурах осуществляются химические процессы, а затем производят растворение NaAlO2:
измельченную шихту спекают в трубчатых печах при 1200-1250°С. В ходе этой операции идут следующие реакции:
SiO2 +Na2C03= Na20* SiO2 + CO2, 550-850°C
Fe203+ Na2CO3 = Na20 *Fe203 + C02, 690-950°C
Al203 + Na2CO3= Na20 *A1203 + CO2. 750-1100°C
Одновременно идут вторичные реакции, основная из которых:
Na20* Al203*2SiO2 + 4CaO = 2NaA102 + 2Ca2 *Si04 1000-1200 C
В результате этой реакции образуются растворимый в воде или содовом растворе алюминат натрия и практически нерастворимый двухкальциевый силикат.
3. Поскольку в ходе спекания при высоких температурах реакции образования NaAlO2 и 2CaO*SiO, проходят достаточно полно, нет необходимости производить выщелачивание при повышенных температурах в автоклавах - этот процесс успешно идет при температурах 70-80°С и при атмосферном давлении. С целью увеличения реакционной поверхности спек трубчатых печей, уплотненный и частично оплавленный, подвергается мокрому измельчению в шаровых или стержневых мельницах в содовом растворе. Именно в это время и происходит переход основного количества А1203 в раствор. Выщелачивание завершается в процессе разделения шлама и алюминатного раствора.
|
|
|
4. В полученных алюминатных растворах содержится еще значительное количество SiO2, что не позволяет получать А1203 стандартного качества. Поэтому растворы обрабатывают известковым молоком Са(ОН)2 для осаждения SiO2 в виде нерастворимого осадка силиката кальция.
5. Снижение концентрации в растворе щелочи, благодаря чему происходит выпадение из раствора А1(ОН)3
NaAI02 + 2Н20 = Al(OH)3+NaOH,
производят путём карбонизации раствора:
2NaOH +С02 = Na2C03 +Н20.
Практически карбонизацию осуществляют продувкой раствора в баках (подобных декомпозёрам) емкостью 500-600 м3 дымовыми газами от трубчатых печей (спекания или кальцинации), содержащих 12-14% С02.
Дальнейшая обработка раствора и А1(ОН)3 та же, что и в способе Байера.
Показатели процесса извлечения глинозема из бокситов по способу спекания:
- степень извлечения глинозема - 82%;
- удельные расходы на 1 т А1203: боксита - около 3 т; известняка 1,3 -1,4т, извести 20-30 кг; соды 180-200 кг; условного топлива 1,1-1,2 т; электроэнергии 800 кВч *ч
Переработку нефелинов ведут по аналогичной схеме с некоторыми количественными изменениями. В результате процесса кроме А1203 и Na2СО3 получают еще и цемент (примерно 10 т/т алюминия).
Комбинированный способ сочетает в себе автоклавный способ и способ спекания. Это дает возможность перерабатывать автоклавным способом бокситы, содержащие значительное количество кремнезема с высоким извлечением глинозема и позволяет пополнять потери щелочи не дорогим едким натром, а дешевой кальцинированной содой.
Параллельный вариант комбинированного способа предусматривает переработку низкокремнистого боксита по автоклавному способу, и переработку лишь небольшой части боксита способом спекания с таким расчетом, чтобы покрыть потери щелочи содой, нужной для спекания.
Раствор алюмината натрия из ветви спекания после обескремнивания смешивают с раствором из автоклавной основной ветви и выкручивают совместно.
Последовательная комбинированная схема предусматривает переработку автоклавным способом бокситов с повышенным содержанием кремнезема. Полученный после выщелачивания красный шлам, содержащий значительное количество оксида алюминия, едкой щелочи спекают с содой и известняком.
Алюминатный раствор после выщелачивания спека идет на выкручивание с растворами основного производства. Применение такого способа к бокситам, содержащим до 14% SiO2, дает возможность извлечь до 96% глинозема, компенсировать потери щелочи только содой и не производить каустификацию оборотного моногидрата соды.
Производство криолита.
Криолит применяется для электролиза глинозема, так как
В своем составе не содержит металлов более электроположительных, чем алюминий, которые, выделяясь на катоде, могли бы его загрязнять,
в расплавленном криолите нет свободных ионов водорода, которые могли бы разряжаться на катоде вместо ионов алюминия
В расплавленном состоянии криолит хорошо растворяет глинозем.
Расплавленный криолит и его сплавы с глиноземом достаточно электропроводны, что позволяет иметь сравнительно небольшую величину падения напряжения в слое расплавленного электролита
Криолит химически не взаимодействует с углеродистой футеровкой, угольным анодом и катодом
Криолит в расплавленном состоянии обладает сравнительно малой летучестью в температурных условиях электролиза.
В электролит часто добавляют фтористые соли (СаF2), что приводит к снижению температуры плавления электролита.
Криолит - двойной фторид алюминия и натрия Na3AlF6 - это химическое соединение 3NaF*AlF3, в котором молекулярное отношение NaF:AlF3 = 3. Это отношение называется криолитовым отношением и служит основной характеристикой состава электролита. Промышленные электролиты работают при криолитовом отношении 2,3 – 2.7, то есть с увеличенным содержанием AlF3. Электролиты с криолитовым отношением больше 3 неприменимы, так как при повышении концентрации ионов натрия возможно выделение натрия на катоде. В расплавленном криолите при 1050С удается растворить до 20% глинозема, однако практически в электролите концентрация глинозема не превышает 8 процентов.
Криолит, а так же AlF3 и NaF получают искусственно из природного плавикового шпата – сначала концентрат, содержащий до 96% CaF2. Из концентрата криолит и другие фтористые соли получают кислотным способом: плавиковый шпат нагревают в смеси с концентрированной серной кислотой до 200С в трубчатых вращающихся печах. При этом получается фтористый водород и сульфат кальция по реакции:
CaF2 + H2SO4 = CaSO4 + 2HF^
Газообразные продукты реакции (HF) поглощаются водой в башнях вне печи, в результате чего получается раствор плавиковой кислоты (HF) с примесью кремнефтористоводородной кислоты (H2SiF6).
Для очистки плавиковой кислоты к ней добавляют соду. Выпадает малорастворимый кремнефтористый натрий (Na2SiF6).
В очищенную плавиковую кислоту добавляют гидроксид алюминия с получением фторалюминиевой кислоты, которую затем нейтрализуют содой, в результате чего выпадает малорастворимый криолит.
2H3AlF6 + 3Na2CO3 → 2Na3AlF6| + 3H2O + 3CO2
Криолит отделяют от раствора, промывают и сушат при 160С.
Для получения других фтористых солей плавиковую кислоту полностью нейтрализуют гидратом оксида алюминия для получения AlF3, либо содой для получения NaF.
Производство угольных электродов и анодной массы.
Для производства алюминия электролитическим способом необходимы следующие угольные изделия:
Подовые блоки для футеровки пода электролизера, который одновременно служит катодом.
Боковые плиты разных размеров для футеровки боковых стенок алюминиевых ванн
Жидкая или твердая анодная масса для формирования самообжигающегося или предварительно обожженного анода.
Требования к исходному сырью для производства этих изделий одинаковы:
1.Необходимы исходные углеродистые материалы с ограниченным содержанием золы, т. к. она рано или поздно перейдет в электролит и загрязнит алюминий.
2.Обожженные угольные изделия должны быть достаточно прочны и плотны (пористость не выше 25%).
Для производства электродов употребляются два вида исходного сырья:
- твердые углеродистые материалы, составляющие основу электрода,
- связующие вещества, назначение которых — прочно скреплять зерна основы.
В качестве твердых составляющих применяются лучшие сорта антрацита (содержание углерода 95-97%) и термоантрацита (это антрацит после прокалки в шахтных печах при 1100-1200 С с пропусканием через слой антрацита водяного пара. В нем выше содержание углерода – до 98%), нефтяной и пековый (смоляной) кокс, т. е. остатки после крекинга нефти или перегонки каменноугольной смолы, отличающиеся малой зольностью — 0,3 - 0,4% золы .
Связующим служит пек — промежуточный продукт перегонки каменноугольной смолы, имеющий температуру размягчения 45-85С.
Технологическая схема производства угольных электродов включает в себя дробление антрацита и др.материалов до крупности 30-50 мм, затем прокаливание в трубчатых печах при 1200-1400 С для удаления летучих (ост.содержание летучих – 0,15-0,2%). Прокаленные материалы измельчают и классифицируют по крупности. При производстве углеродных изделий смесь материалов разной крупности используют в разной дозировке. Это позволяет получать угольные изделия с требуемыми механическими и электрическими свойствами. При смешении к углеродистым материалам добавляют связующее – предварительно разогретый угольный пек (20-22% от массы изделия). Готовую тестообразную массу направляют на прессование под давлением до 40 МПа. После прессования изделия выдерживают на воздухе не менее 24 часов для снятия внутреннего напряжения, которое возникает в процессе прессования. Затем их обжигают при 1300-1400 С без доступа воздуха в камерных или туннельных печах. Во время обжига происходит коксование связующего, в результате чего изделия приобретают повышенную прочность, твердость и электропроводность. Общая продолжительность обжига зависит от размера и от сечения обжигаемых изделий, конструкции печей и т.д. и составляет от 14-16 до 30 суток. Этот период включает в себя медленный подогрев электрода (до 4 суток) до температуры около 800 С, затем непосредственно обжиг (1300-1400 С) в течение 2 суток и охлаждение до температуры, при которой их можно выгрузить из печи (300С) - 4 суток. Для крупных электродов продолжительность каждого периода увеличивается.
Технология производства самообжигающихся анодов в начальной стадии аналогична технологии производства обожженных анодов - дробление антрацита, рассев по фракциям, прокалка, смешение со связующим (пеком). Но прессованию и обжигу их не подвергают. Сырую (необожженную) углеродистую массу (она имеет тестообразную консистенцию) набивают в металлический кожух. Под влиянием тепла, излучаемого электролизером, и проходящего по электроду тока, сырая углеродистая масса коксуется. По мере сгорания электрода кожух наращивают сверху и набивают новыми порциями углеродистой массы.
