Семестр 5
|
№ раз- дела |
Наименование разделов |
Количество часов | ||||
|
Всего |
Аудиторная работа |
Самостоятельная работа | ||||
|
Л |
ПЗ |
ЛР |
| |||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1 |
Основы химической термодинамики |
162 |
30 |
16 |
80 |
36 |
|
2 |
Элементы статической термодинамики. |
54 |
10 |
4 |
- |
40 |
|
|
Итого: |
216 |
40 |
20 |
80 |
76 |
|
|
Всего: |
|
|
|
|
|
Семестр 6
|
№ раз- дела |
Наименование разделов |
Количество часов | ||||
|
Всего |
Аудиторная работа |
Самостоятельная работа | ||||
|
Л |
ПЗ |
ЛР |
| |||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1 |
Термодинамика растворов |
43 |
6 |
4 |
8 |
25 |
|
2 |
Фазовые равновесия |
60 |
8 |
4 |
18 |
30 |
|
3 |
Элементы линейной термодинамики необратимых процессов |
30 |
6 |
2 |
2 |
20 |
|
4 |
Электрохимия. |
74 |
8 |
4 |
32 |
30 |
|
5 |
Химическая кинетика |
72 |
8 |
4 |
30 |
30 |
|
|
Итого: |
279 |
36 |
18 |
90 |
135 |
|
|
Всего: |
495 |
76 |
38 |
170 |
211 |
4.4. Лекционные занятия
|
№ |
Тема |
Час. |
|
|
Основы химической термодинамики. Термодинамические системы. Основные понятия и определения. Координаты и потенциалы термодинамических систем. Обобщенная работа. Уравнения состояния. Нулевой закон термодинамики (закон термического равновесия). |
3 |
|
|
Первый закон термодинамики. Внутренняя энергия, энтальпия. Математические и физические свойства внутренней энергии, энтальпии, теплоты и работы. |
3 |
|
|
Приложение Iначала термодинамики к химическим и физико-химическим процессам. Закон Гесса и его следствия. Расчет тепловых эффектов химических реакций при стандартных условиях. Зависимость теплового эффекта химической реакции от температуры (Закон Кирхгоффа). |
3 |
|
|
Второй закон термодинамики и его формулировка. Уравнения второго начала термодинамики. Энтропия как функция состояния и методы ее вычисления. Неравенство Клаузиуса. Изменение энтропии в изолированных и адиабатических системах. |
3 |
|
5 |
Фундаментальные уравнения Гиббса. Энергия Гиббса, энергия Гельмгольца. Условия равновесия и критерии самопроизвольного протекания процессов в изобарно-изотермических и изохорно-изотермических условиях. Уравнения Гиббса-Гельмгольца. |
3 |
|
6 |
Учение о парциальных мольных величинах. Свойства парциальных мольных величин. |
3 |
|
7 |
Химические потенциалы, их определение, вычисление и свойства уравнения Гиббса-Дюгема. |
3 |
|
8 |
Химические равновесия. Закон действующих масс. Уравнение изотермы химической реакции. |
3 |
|
9 |
Уравнение изобары и изохоры химической реакции. Расчет констант равновесия химических реакций. |
3 |
|
10 |
Третий закон термодинамики. Принцип недостижимости абсолютного нуля. Теорема Планка. Расчет химических равновесий методом абсолютных энтропий. |
3 |
|
11 |
Элементы статической термодинамики. Механическое описание молекулярной системы. Канонические уравнения Гамильтона. Микро- и макросостояния. Фазовые Г- и -пространства |
2 |
|
12 |
Метод ансамблей Гиббса. Эргоидная гипотеза. Теорема Лиувилля. Принцип равной вероятности. |
2 |
|
13 |
Вероятность заданного макроскопического состояния системы. Статическое определение системы. Ограничения второго начала термодинамики. |
2 |
|
14 |
Канонический ансамбль. Модуль канонического распределения. Статический интеграл и статическая сумма. |
2 |
|
15 |
Приложения статической термодинамики. Распределение молекул по энергиям. Расчет термодинамических функций методами статистической термодинамики. Вычисление констант химического равновесия. |
2 |
|
16 |
Термодинамика растворов. Термодинамическая классификация растворов. Давление насыщенного пара жидких растворов. Закон Рауля. Отклонения от законов Рауля. |
2 |
|
17 |
Растворимость. Уравнение Шредера. Эбулио- и криоскопия. Осмотические явления. Уравнение Вант-Гоффа. |
2 |
|
18 |
Равновесие жидкость-пар. Законы Гиббса-Коновалова. Диаграммы состояния. Разделение веществ путем перегонки. Азеотропные смеси и их свойства. |
2 |
|
19 |
Фазовые равновесия. Понятия фазы, компонента, степени свободы. Правило фаз и его вывод. Классификация гетерогенных систем. |
2 |
|
20 |
Однокомпонентные системы. Уравнение Клапейрона-Клаузиуса. Энантиотропные и монотропные фазовые переходы. |
2 |
|
21 |
Диаграммы состояния двухкомпонентных систем. Типы диаграмм состояния. Правило фаз. |
2 |
|
22 |
Диаграммы состояния трехкомпонентных систем. Треугольники Гиббса-Розебома. |
2 |
|
23 |
Элементы линейной термодинамики необратимых процессов. Описание необратимых процессов в термодинамике. Потоки и силы. |
2 |
|
24 |
Феноменологические процессы. Открытые и закрытые системы. |
1 |
|
25 |
Производство энтропии. Теорема Пригожина. Потоки при взаимодействии нескольких сил. Соотношение взаимности Онзагера. |
1 |
|
26 |
Термодиффузия, эффект Дюфура. Электрокинетические процессы, их термодинамический анализ. |
1 |
|
27 |
Приложение термодинамики неравновесных процессов к мембранным процессам. Уравнения Кедем-Качальского. |
1 |
|
28 |
Электрохимия. Особенности электрохимических реакций. Электрохимическая цепь и ее компоненты. Структура электрохимии, ее разделы, прикладные аспекты. Развитие представлений о строении растворов электролитов (модели Гротгуса, Фарадея, Аррениуса). Теория электролитической диссоциации, ее критический анализ. |
1 |
|
29 |
Энергия кристаллической решетки и энергия сольватации.Ион-дипольное взаимодействие в растворах электролитов, модели Борна, причины устойчивости ионных систем. |
1 |
|
30 |
Ион-ионное взаимодействие в растворах электролитов и его термодинамическое описание. Понятие средней ионной активности и среднего ионного коэффициента активности, их связь с индивидуальными характеристиками ионов. |
1 |
|
31 |
Основные допущения теории Дебая-Хюккеля. Модель ионной атмосферы, потенциал ионной атмосферы. Схема вывода предельного закона Дебая-Хюккеля. Уравнения для коэффициента активности во втором и третьем приближении теории Дебая-Хюккеля. Методы экспериментального определения коэффициентов активности. |
1 |
|
32 |
Подвижность ионов и закон Кольрауша. Числа переноса ионов и методы их определения. Особые случаи электропроводности электролитов. Зависимость подвижности ионов, чисел переноса, электропроводности от концентрации в рамках теории Дебая-Хюккеля-Онзагера. Электрофоретический и релаксационный эффекты. Опыты Вина и Дебая-Фалькенгагена. |
1 |
|
33 |
Электрохимические цепи, электродные потенциалы, электродвижущая сила (ЭДС). Уравнение Нернста для электродных потенциалов и ЭДС. |
1 |
|
34 |
Классификация электродов и электрохимических цепей. Концентрационные цепи с переносом и без переноса. Метод ЭДС для определения коэффициентов активности. |
1 |
|
35 |
Метод ЭДС для определения термодинамических характеристик электрохимических реакций: изменения энтропии, энтальпии, свободной энергии, констант равновесия и нестойкости комплексных соединений и др. |
1 |
|
36 |
Химическая кинетика. Основные понятия химической кинетики. Скорость реакции. Кинетические уравнения. Порядок и молекулярность реакции. |
1 |
|
37 |
Кинетический закон действия масс, его применение. Зависимость константы скорости от температуры. Уравнение Аррениуса. Эффективная и истинная энергия активации. |
1 |
|
38 |
Необратимые реакции первого и второго порядков. Определение константы скорости, порядка реакции, энергии активации из результатов кинетических экспериментов. |
1 |
|
39 |
Обзор теоретических представлений в химической кинетике. Теория соударений и теория абсолютных скоростей реакций на примере бимолекулярной реакции. |
1 |
|
40 |
Метод активного комплекса. Поверхность потенциальной энергии. Схема вывода уравнения для константы скорости. Термодинамический аспект теории. Свободная энергия, энтальпия, энтропия активации. |
2 |
|
41 |
Общие принципы катализа. Примеры механизмов каталитических реакций. |
2 |
4.5. Практические занятия
|
№ |
Тема |
Час. |
|
|
Расчет теплоты и работы в различных процессах. Первый закон термодинамики; внутренняя энергия, энтальпия. Расчет тепловых эффектов химических реакций по теплотам образования и сгорания. Зависимость теплового эффекта реакции от температуры. |
4 |
|
|
Второй закон термодинамики. Расчет изменения энтропии в различных процессах. |
2 |
|
|
Расчет изменения энергии Гельмгольца и энергии Гиббса в различных процессах. |
2 |
|
|
Контрольная работа № 1 |
2 |
|
5 |
Парциальные мольные величины и определение их из опытных данных для бинарных систем. |
2 |
|
6 |
Закон Рауля. Закон Генри. Идеальные растворы. Неидеальные растворы. Коэффициенты активности и определение их из опытных данных. Криоскопический эффект. Осмотическое давление. |
2 |
|
7 |
Правило фаз Гиббса. Уравнение Клапейрона. Уравнение Клапейрона – Клаузиуса. Диаграммы состояния одно и двухкомпонентных систем, их анализ. |
2 |
|
8 |
Закон действия масс. Изотерма Вант-Гоффа. Расчет констант равновесия химических реакций с использованием таблиц стандартных значений термодинамических функций. Расчет выхода продуктов химических реакций. Зависимость константы равновесия химической реакции от температуры. |
4 |
|
9 |
Контрольная работа № 2 |
2 |
|
10 |
Термодинамическое описание ион-ионного взаимодействия. Расчет среднего коэффициента активности в первом, втором и третьем приближении теории Дебая – Хюккеля. |
2 |
|
11 |
Неравновесные явления в растворах электролитов. Диффузионный потенциал. Удельная и эквивалентная электропроводность.Числа переноса. Подвижности ионов и закон Кольрауша. Зависимость подвижностей и чисел переноса ионов от концентрации в рамках теории Дебая – Хюккеля – Онзагера. |
4 |
|
12 |
Равновесные электрохимические цепи и их ЭДС. Формула Нернста и уравнение Гиббса – Гельмгольца. Определение коэффициентов активности и чисел переноса на основе измерения ЭДС. |
4 |
|
13 |
Контрольная работа № 3 |
2 |
|
14 |
Формальная кинетика необратимых реакций первого, второго и третьего порядков. |
2 |
|
15 |
Методы определения порядка и константы скорости реакции. Зависимость константы скорости от температуры. Уравнение Аррениуса. |
2 |
|
16 |
Формальная кинетика химических сложных (обратимых, параллельных, последовательных) реакций. |
2 |
|
17 |
Контрольная работа № 4 |
2 |
4.6. Лабораторные работы
|
№ |
Тема |
Час. |
|
|
Термодинамика и термохимия. Определение тепловых эффектов химических реакций растворения соли. |
8 |
|
|
Определение тепловых эффектов химических реакций реакции нейтрализации. |
8 |
|
|
Исследование свойств растворов методом криоскопии. |
8 |
|
|
Определение относительной молекулярной массы вещества в газообразном состоянии. |
6 |
|
|
Химическое равновесие. Изучение химического равновесия в гомогеной системе. |
8 |
|
|
Изучение равновесия гомогеной реакции в растворе. |
8 |
|
|
Определение константы ионообменного равновесия. |
6 |
|
|
Фазовое равновесие. Изучение равновесия жидкость – пар в двухкомпонентой системе. |
8 |
|
|
Изучение взаимной растворимости жидкостей в двухкомпонентной системе. |
8 |
|
|
Изучение равновесия в трехкомпонентной системе. |
6 |
|
|
. Растворы электролитов. Определение константы диссоциации индикатора. |
6 |
|
|
Исследование растворов сильных и слабых электролитов кондуктометрическим методом. |
6 |
|
|
Определение растворимости и произведения растворимости труднорастворимой соли по удельной электропроводности. |
8 |
|
|
Кондуктометрическое титрование. |
6 |
|
|
Измерение чисел переноса ионов в растворе методом Гитторфа. |
6 |
|
|
Определение коэффициента диффузии в системе H2O – NaCl. |
6 |
|
|
Электродвижущие силы. Определение потенциалов отдельных электродов, ЭДС гальванических цепей. |
6 |
|
|
Измерение температурного коэффициента ЭДС гальванического элемента и расчет термодинамических величин. |
6 |
|
|
Определение коэффициента активности соляной кислоты . |
6 |
|
|
Потенциометрическое определение рН растворов. |
6 |
|
|
Химическая кинетика. Определение константы скорости инверсии сахарозы. |
8 |
|
|
Исследование кинетики растворения малорастворимых веществ. |
8 |
|
|
Определение порядка реакции окисления иодид-ионов ионами трехвалентного железа. |
6 |
|
|
Определение порядка реакции по иодид-ионам |
6 |
|
|
Измерение температурного коэффициента ЭДС гальванического элемента и расчет термодинамических величин |
6 |
5. Образовательные технологии
|
Семестр |
Вид занятия (Л, ПР, ЛР) |
Используемые интерактивные образовательные технологии |
Количество часов |
|
5 |
Л |
Мультимейный комплекс в составе проектора, ноутбука и экрана |
80 |
|
ПР |
ПК |
20 | |
|
ЛР |
ПК |
80 | |
|
6 |
Л |
Мультимейный комплекс в составе проектора, ноутбука и экрана |
36 |
|
ПР |
ПК |
18 | |
|
ЛР |
ПК |
90 | |
|
Итого:284 |
| ||
6. Оценочные средства для текущего контроля успеваемости и промежуточной аттестации
Контрольная работа
ВАРИАНТ КОНТРОЛЬНОЙ РАБОТЫ № 1
по курсу «Физическая химия»
по теме «I, II, III начала термодинамики»
1. Вывести, пользуясь справочными
данными, наиболее точное уравнение для
зависимости
![]() от температуры для газообразного
сероуглерода CS2 (газ). Какое
количество тепла необходимо для
превращения 10 кг жидкого сероуглерода,
взятого при температуре 15С,
в газообразный при температуре 1273С?
от температуры для газообразного
сероуглерода CS2 (газ). Какое
количество тепла необходимо для
превращения 10 кг жидкого сероуглерода,
взятого при температуре 15С,
в газообразный при температуре 1273С?
2. Найти изменение энтропии в процессе конденсации 1 моль переохлажденного водяного пара при давлении 1 атм. и температуре 25С, если давление паров воды при 298 K равно 0,03229 атм., теплота испарения воды равна 538,9 ккал/кг, теплоемкость при постоянном давлении парообразной воды равна 8,025 кал/моль, а жидкой 18,02 кал/моль.
3. Вычислить A,Q,H,U,G,F,Sдля изотермического сжатия 1 моль идеального газа от давления 0,5 атм. до давления 1 атм. при 500С.
ВАРИАНТ КОНТРОЛЬНОЙ РАБОТЫ № 2
по курсу «Физическая химия»
по теме «Химическое равновесие. Равновесие в гетерогенных системах. Растворы»
1. Определить температуру разложения известняка при давлении 1,013105Па, если давление диссоциации при 900С равно 1,322105Па, а тепловой эффект реакции при постоянном давлении равен 165,0 кДж/моль.
2. Определите парциальные молярные теплоёмкости HNO3и H2O в 0,5mрастворе. Удельные теплоёмкости растворов азотной кислоты приведены ниже:
|
CHNO3, % |
0 |
1 |
2,5 |
5 |
10 |
15 |
20 |
25 |
|
Удельная теплоёмкость, Дж/(гК) |
4,18 |
4,117 |
4,034 |
3,908 |
3,712 |
3,545 |
3,373 |
3,219 |
3. Зависимость давления пара водорода от температуры между 1 атм и Ркритможно выразить уравнением
Р= – 56,605 /Т+ 3,8015 – 0,10458Т+ 0,00332177Т 2+ 0,0432197Т 3
При Т= 27,47 КHисп= 375,3466 кДж/кг,dп= 0,00613 кг/дм3,dж= 0,06050 кг/дм3. Согласуются ли эти данные друг с другом?
ВАРИАНТ КОНТРОЛЬНОЙ РАБОТЫ № 3
по курсу «Физическая химия»
по теме Электрохимия
1. Поясните, что называют «ионной атмосферой». В каких случаях, это понятие используется в физической химии? Приведите не менее трех уравнений, которые выводятся, и эффекты, которые объясняются существованием ионной атмосферы.
2. Определите ионную силу и коэффициент активности иона кальция в растворе, содержащем 1,62 г Ca(HCO3)2в 250 г воды.
3. Рассчитать рН буферного раствора, приготовленного смешиванием 20 мл 0,2 М раствора Na2HPO4и 50 мл 0,5 М раствора NaH2PO4.
4. Удельная электропроводность 0,135 моль/л раствора пропионовой кислоты равна 4,810–2См/м. Рассчитать молярную электропроводность пропионовой кислоты, константу диссоциации кислоты и рН раствора.
5. ЭДС элемента Pt | H2| HBr | AgBr | Ag в широком интервале температур описывается уравнением:
Е(В) = 0,07131 – 4,9910–4(Т – 298) – 3,4510–6(Т – 298)2.
Рассчитать Gо,Hо,Sореакции в элементе при 25оС.
ВАРИАНТ КОНТРОЛЬНОЙ РАБОТЫ № 4
по курсу «Физическая химия»
по теме Химическая кинетика
1. Изучалась реакция между пропионовым альдегидом и синильной кислотой в водном растворе при 25 оС. В одном из опытов в различные моменты времени были получены следующие концентрации:
|
Время, мин |
2.78 |
5.33 |
8.17 |
15.23 |
19.80 |
|
|
[HCN], моль/л |
0.0990 |
0.0906 |
0.0830 |
0.0706 |
0.0653 |
0.0424 |
|
[C3H7CHO], моль/л |
0.0566 |
0.0482 |
0.0406 |
0.0282 |
0.0229 |
0.000 |
Каков порядок реакции и чему равно значение константы скорости k?
2. Константы скорости для реакции второго порядка атомов кислорода с бензолом равны 1.44107при 300.3 К, 3.03107при 341.2 К и 6.9107при 392.2 К. Найдите предэкспоненциальный множитель и энергию активации.
3. Реакция разложения перекиси бензоила протекает как реакция первого порядка. Период полупревращения перекиси бензоила в данных условиях равен 4,9 мин. Определить время разложения 83,0% перекиси бензоила.
2. Примеры вариантов контрольных тестов
ТЕСТ
по теме "Основные понятия и законы термодинамики. Первое начало термодинамики. Термохимия"
1. Какие величины обладают свойствами функций состояния?
а) A, Q, U, H; б) Q, U; в) A, U, H; г) U, H.
2. Работа, совершаемая системой, равна:
-
а)
 ;
;в)
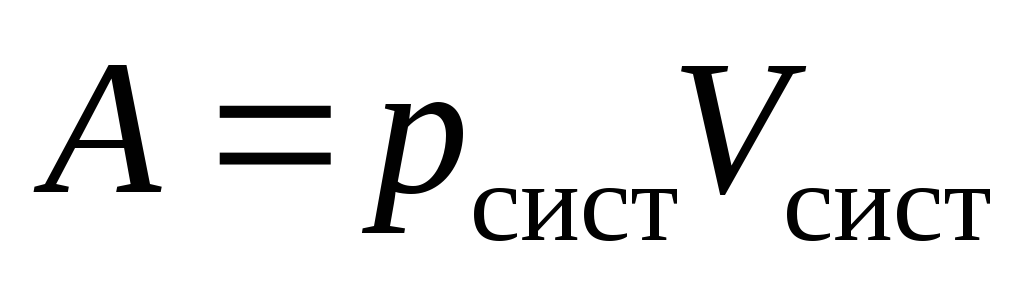 ;
;б)
 ;
;г)
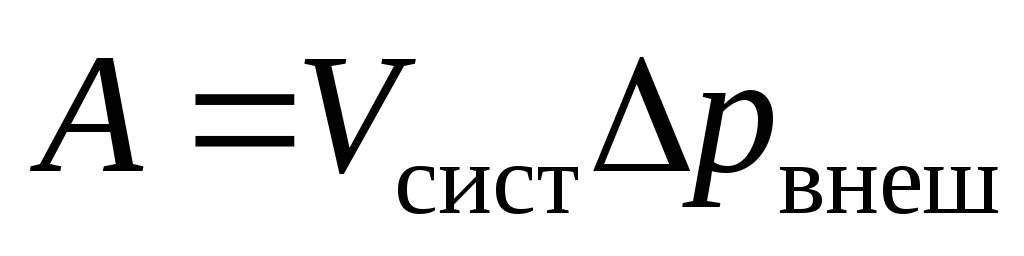 .
.
3. Укажите правильную формулировку нулевого начала термодинамики:
а) если каждая из систем A и B находится в тепловом равновесии с системой С, то системы A и B не всегда находятся в тепловом равновесии друг с другом.
б) если каждая из систем A и B находится в тепловом равновесии с системой С, то системы A и B находятся в тепловом равновесии друг с другом;
в) если каждая из систем A и B находится в тепловом контакте с системой С, то системы A и B не обязательно находятся в тепловом равновесии друг с другом;
г) если каждая из систем A и B находится в тепловом контакте с системой С, то системы A и B находятся в тепловом равновесии друг с другом;
4. Укажите правильное уравнение для расчета теплового эффекта химической реакции:
C6H5OH(г)+ 7O2(г)(;(6CO2(г)+ 3H2O(г)
|
а) |
в) |
|
б) |
г) |
|
5. |
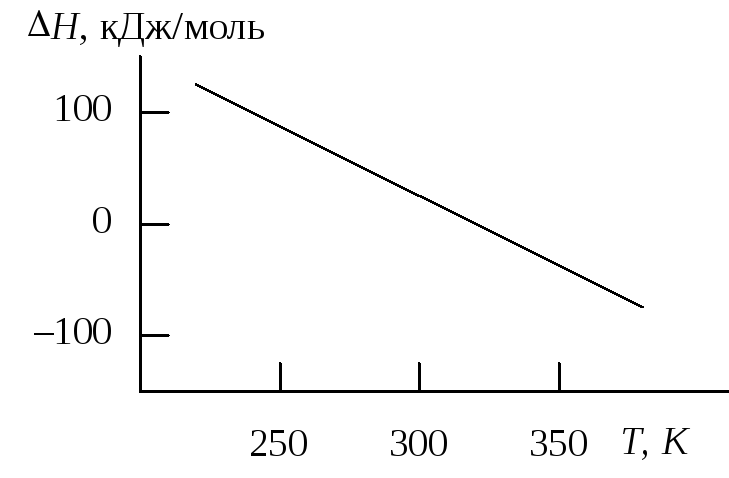
На рисунке приведена зависимость теплового эффекта некоторой химической реакции от температуры. Укажите правильный знак изменения теплоемкости в процессе протекания данной реакции |
|
а) Cp > 0; б)Cp < 0; в)Cp = 0;
г) при увеличении температуры вначале Cp > 0, затемCp < 0.
ТЕСТ
по теме "Второе и третье начала термодинамики. Термодинамические потенциалы."
1. Соотношение между изменением энтропии термодинамической системы и теплотой необратимого процесса имеет вид
а) ![]() ; б)
; б)![]() ; в)
; в)![]() ; г)
; г)![]() .
.
|
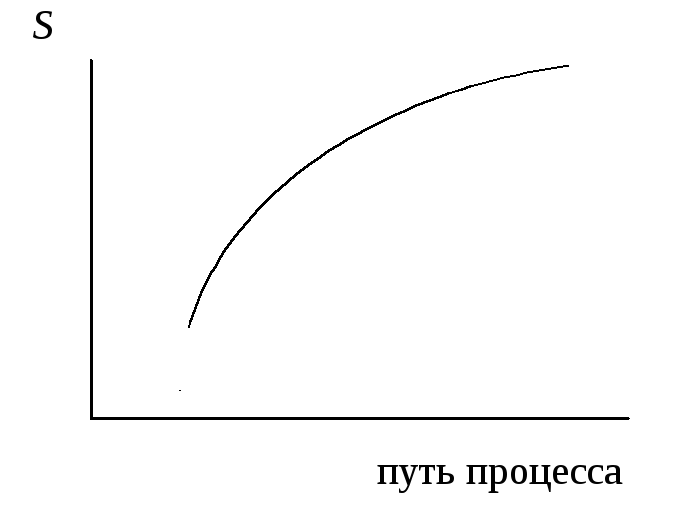
2. |
Какому процессу, протекающему в изолированной системе, соответствует график изменения энтропии, показанный на рисунке? а) самопроизвольному; б) несамопроизвольному; в) состоянию равновесия; г) для ответа не хватает данных. |
|
3. Каково соотношение между энергией Гиббса Gи энергией ГельмгольцаFдля любой термодинамической системы?
а) G=F-pV; б)G=F+pV; в)G=F-TS; г)G=F+TS.
4. Как зависит от объема системы энергия Гельмгольца?
а) dF =pdV; б)dF =Vdp; в)dF = –Vdp; г)dF= –pdV.
5. Укажите правильное утверждение:
а) для любого вещества можно рассчитать абсолютное значение энтропии;
б) для любого вещества можно рассчитать абсолютное значение энтальпии;
в) в процессе плавления кристаллов серы ее энтропия уменьшается;
г) энтропия не является функцией состояния.
ТЕСТ
по теме "Химическое равновесие"
1. Для какой реакции константа равновесия, выраженная через концентрации (Kс), будет иметь размерность концентрации?
а) Zn(т)+ Br2(ж)= ZnBr2(т); в) S(т)+ O2(г)= SO2(г);
б) NH3(г)+ HCl(г)= NH4Cl(т); г) 2H2O2(ж)= 2H2O(ж)+ O2(г).
2. Студент записал уравнение изотермы химической реакции
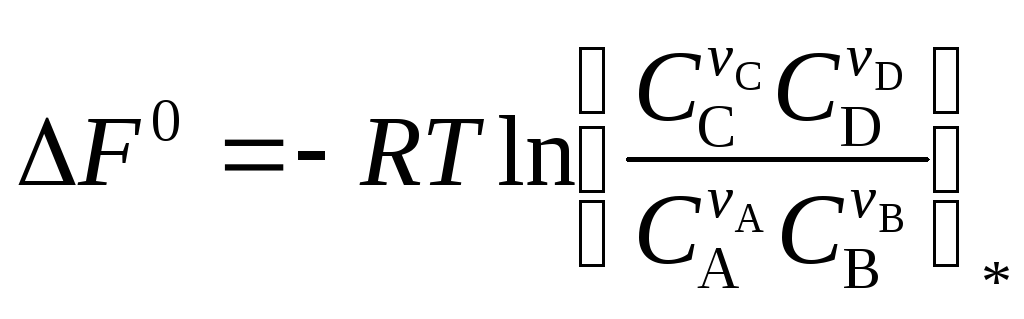 ;
;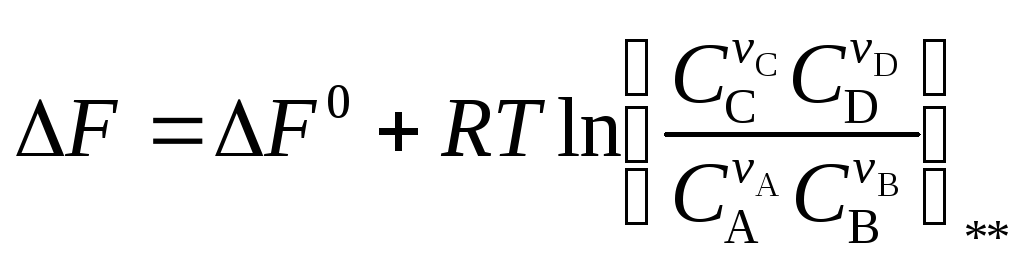
не вполне точно, так как не указал в тех местах, где стоят символы * и **, какие именно концентрации должны использоваться в расчете: концентрации в состоянии равновесия или концентрации в начальный момент времени. Правильной эта запись станет, если вместо символов * и ** вставить соответственно:
а) нач. и равн.; б) нач. и нач.; в) равн. и равн.; г) равн. и нач.
|
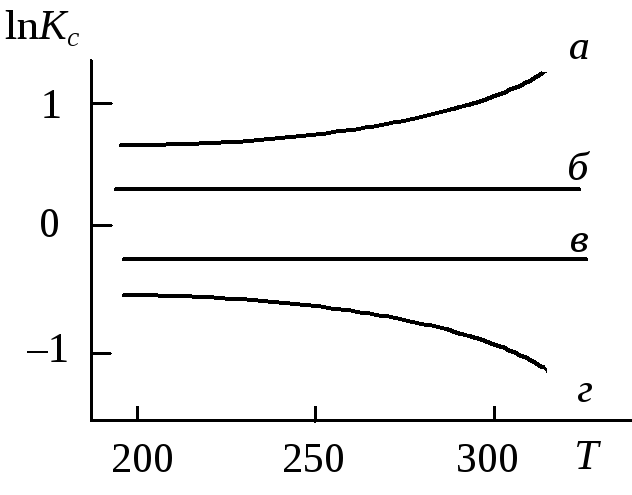
3. |
В некотором диапазоне температур стандартный тепловой эффект некоторой химической реакции при постоянном объеме отрицателен U0<0 и практически не зависит от температуры. Какая линия на рисунке правильно передает зависимость константы равновесияKсэтой реакции от температуры? |
|
4. Расчет по уравнению изотермы некоторой химической реакции при начальных значениях концентраций исходных веществ и продуктов реакции при постоянных температуре и объеме показал, что F < 0. Какой процесс будет в этом случае самопроизвольным?
а) для ответа необходимы дополнительные данные;
б) никакие процессы протекать не будут, так как реакция уже находится в состоянии равновесия;
в) протекание реакции в обратном направлении;
г) протекание реакции в прямом направлении.
|
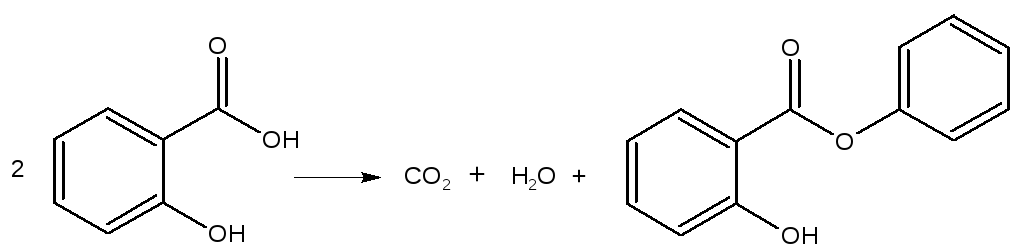
5. |
В каком случае равновесие в реакции разложения салициловой кислоты сместится в сторону исходного вещества? |
|
Все вещества, кроме диоксида углерода и воды твердые; CO2газообразный; H2O жидкая. Тепловой эффект реакции равенH0298=14,63 кДж.
а) при понижении температуры;
б) при повышении температуры;
в) температура не влияет на состояние равновесия;
г) для ответа не хватает данных.
ТЕСТ
по теме "Фазовые равновесия"
|
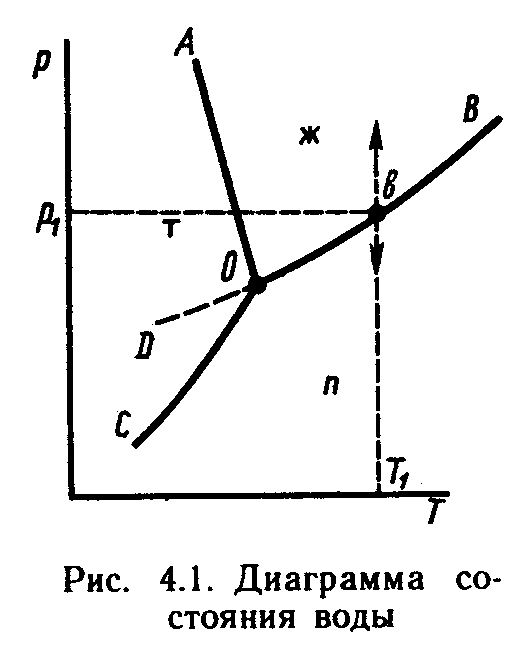
1. Используя уравнение Гиббса С= К– Ф+ n, рассчитайте число степеней свободы в точке ”A” (рисунок)
а) 0; б) 1; в) 2; г) 3. |
|
2. Уравнение Клапейрона
![]()
а) позволяет рассчитать по экспериментальным данным теплоту плавления;
б) показывает, что давление, при котором происходит фазовый переход, всегда растет с ростом температуры;
в) позволяет рассчитать по соответствующим экспериментальным данным теплоту возгонки;
г) применимо для состояния равновесия “жидкость-пар”.
(... укажите неправильное утверждение)
|
3. Назовите фазы, которые находятся в полях диаграммы, помеченных цифрами 1, 2, 3
а) 1-пар, 2-жидкость, 3-жидкость и пар;
б) 1-жидкость и пар, 2-пар, 3-жидкость;
в) 1-жидкость, 2-пар, 3-жидкость и пар;
г) 1-жидкость, 2-жидкость и пар, 3-пар.
|
|
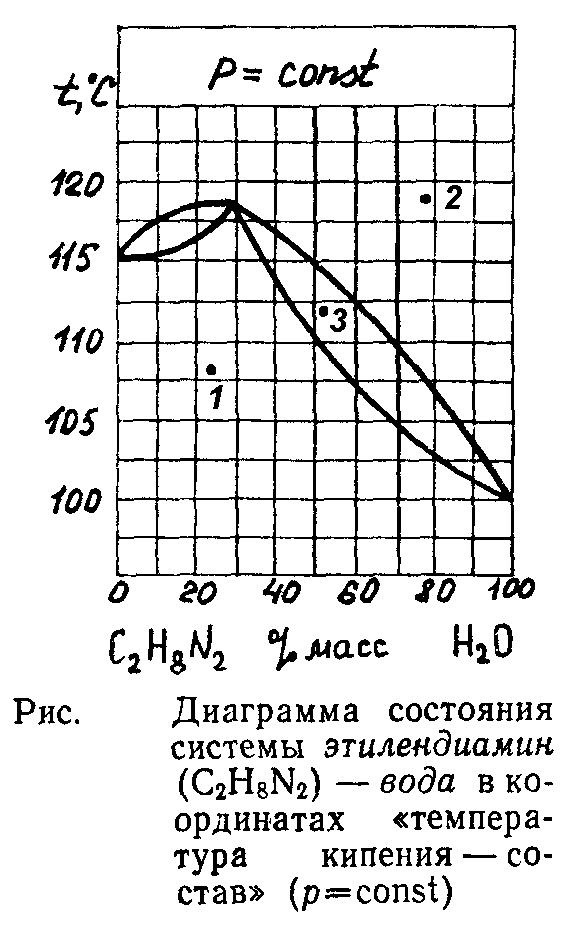
4. Перегонка с водяным паром
а) применяется в том случае, когда нужно очистить органическое соединение неограниченно смешивающееся с водой;
б) применяется в том случае, когда органическое соединение легко разлагается при температуре кипения и, кроме того, практически не растворяется в воде;
в) протекает таким образом, что чем больше давление пара органической жидкости, тем меньше ее содержание в паре и конденсате;
г) протекает при температуре выше 100С, если давление равно 101,3 кПа.
5. Экстракция органического соединения из водного раствора в первом случае проводится однократно объемом эфира, равным 100 мл, а во втором случае - дважды объемами по 50 мл. В каком случае остаточная концентрация в водном растворе будет ниже?
а) в первом;
б) во втором;
в) будет одинакова в обоих случаях;
г) ответ дать нельзя: все зависит от природы органического соединения.
ТЕСТ
по теме "Термодинамика разбавленных растворов."
1. Идеальным считается раствор, в котором:
а) силы притяжения между частицами равны силам отталкивания;
б) образуется малодиссоциирующее вещество;
в) все компоненты – слабые электролиты;
г) все компоненты не взаимодействуют друг с другом.
2. Давление пара растворителя над раствором нелетучего вещества:
а) всегда выше, чем над чистым растворителем;
б) всегда ниже, чем над чистым растворителем;
в) такое же, как и над чистым растворителем;
г) зависит от природы растворителя.
3. Коллигативные свойства растворов:
а) зависят от природы частиц растворенного вещества;
б) не зависят от природы частиц растворенного вещества;
в) не зависят от концентрации;
г) не зависят от влажности воздуха.
Выберите неверное утверждение.
4. Закон Рауля справедлив только для:
а) идеальных разбавленных растворов;
б) идеальных концентрированных растворов;
в) идеальных и реальных разбавленных растворов;
г) концентрированных растворов сильных электролитов.
5. Осмотическое давление растворов электролитов рассчитывается по формуле:
а) = icRT, где i – изотонический коэффициент;
б) = cRT;
в) = cRT, где – степень диссоциации;
г) = KдcRT, где Kд – константа диссоциации.
ТЕСТ
по теме "Термодинамика растворов электролитов. Буферные системы."
1. Степень диссоциации – это:
а) отношение числа продиссоциировавших молекул к исходному числу растворенных молекул;
б) отношение исходного числа растворенных молекул к числу продиссоциировавших молекул;
в) сумма чисел продиссоциировавших и растворенных молекул;
г) разность чисел растворенных и продиссоциировавших молекул.
2. Чем больше константа диссоциации слабого электролита, тем:
а) он сильнее диссоциирован
б) он слабее диссоциирован
в) он лучше растворим в воде
г) хуже он проводит электрический ток
3. Изотонический коэффициент i:
а) больше 1 для электролитов
б) больше 1 для неэлектролитов
в) равен 0 для электролитов
г) меньше 1 для электролитов
4. Связь коэффициента активности (), концентрации (с) и активности (а) и ионной силы (I) имеет вид:
а)
lg
= –0,508 I–1/2;
б) a
= с;
в)
![]() ;
г )
;
г )![]()
5. Буферная емкость системы может быть нарушена:
а) добавлением сильного электролита (кислоты или основания);
б) добавлением слабого электролита (кислоты или основания);
в) добавлением соли;
г) ничем не нарушается.
6. Выберите неверное утверждение. Ионная сила раствора тем больше, чем больше:
а) концентрация электролитов
б) заряды ионов, образующих раствор
в) число ионов, образующих раствор
г) концентрация растворителя
7. Ионная атмосфера образуется:
а) вокруг каждого иона в кристалле
б) вокруг каждого иона в растворе
в) вокруг электролитов и неэлектролитов
г) вокруг растворенного вещества и растворителя
ТЕСТ
по теме "Электропроводность растворов. Электродные потенциалы"
1. При разбавлении концентрированного раствора сильного электролита его электропроводность:
а) падает
б) увеличивается
в) не изменяется
г) растет, а потом падает
2. Число переноса катиона – это:
а) число Фарадея
б) заряд катиона
в) доля электричества, переносимая катионами
г) доля электричества, переносимая анионами
3. Гальванический элемент – это устройство, преобразующее:
а) химическую энергию в электрическую
б) электрическую энергию в химическую
в) электрическую энергию электродов
г) энергию электродов в энергию раствора
4. Потенциал нормального водородного электрода условно равен:
а) нулю
б) единице
в) бесконечности
г) может быть любым
5. К электродам сравнения относятся:
а) стеклянный, хлорсеребряный
б) хингидронный, стеклянный
в) хлорсеребряный, каломельный
г) хингидронный, каломельный
ТЕСТ
по теме "Химическая кинетика: основные понятия; формальная кинетика; зависимость скорости реакции от температуры"
1. Химическая кинетика – это:
а) учение о тепловых эффектах реакций;
б) учение о скоростях реакций;
в) учение о катализе и катализаторах;
г) учение об энергетике химических процессов.
2. Скорость химической реакции – это:
а) изменение объема в единицу времени
б) изменение массы вещества в единицу времени
в) изменение концентрации вещества в единицу времени
г) изменение числа фаз системы в единицу времени
3. Закон Гульдберга и Вааге для реакции аА + bB cC имеет вид
а)
![]() б)
б)![]() в)
в)![]() г)
г)![]()
4. Выберите неверное утверждение. Порядок реакции – это величина:
а) всегда положительная и целая;
б) определяемая только экспериментально;
в) не всегда совпадающая с молекулярностью;
г) положительная, отрицательная, дробная или нулевая в зависимости от
механизма реакции.
5. Выберите неверное утверждение. Молекулярность – это:
а) число веществ-участников реакции;
б) число молекул, сталкивающихся одновременно с образованием новых соедине-
ний;
в) сумма коэффициентов в уравнении реакции;
г) величина, принимающая значение от 1 до бесконечности.
6. При увеличени температуры на каждые 10С скорость реакции:
а) увеличивается в 2–4 раза
б) уменьшается в 2–4 раза
в) возратает в 10 раз
г) не изменяется
7. Энергии активации – это:
а) тепловой эффект реакции;
б) энергия Гиббса;
в) избыточная энергия, которую должны иметь молекулы для начала реакции;
г) внутренняя энергия реагентов.
Вопросы к курсовым экзаменам
Термодинамика
Основные понятия и определения. Термодинамическая система. Изолированная, открытая и закрытая системы.
Процесс и состояние. Функция состояния. Уравнение состояния. Интенсивные и экстенсивные свойства.
Работа в равновесных и неравновесных процессах.
Энтальпия и внутренняя энергия.
Первое начало термодинамики. Свойства полного дифференциала и функции состояния.
Закон Гесса.
Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа, его вывод.
Второе начало термодинамики. Обобщенное уравнение первого и второго начала термодинамики.
Энтропия и ее вычисление для равновесных процессов.
Энтропия смешения идеальных газов.
Статистический смысл энтропии. Уравнение Больцмана.
Третье начало термодинамики. Постулат Планка. Тепловая теорема Нернста.
Характеристические функции.
Уравнение Гиббса – Дюгема.
Уравнение Гиббса – Гельмгольца.
Уравнения Максвелла.
Химический потенциал.
Химическая термодинамика
Химическая переменная. Уравнение изотермы Вант-Гоффа.
Закон действующих масс. Различные виды констант равновесия и связь между ними.
Изменение энергии Гиббса и энергии Гельмгольца в химической реакции.
Расчеты констант равновесия химических реакций по термодинамическим данным.
Расчет констант равновесия химических реакций. Метод Темкина – Шварцмана.
Расчет констант равновесия химических реакций. Использование уравнений изобары и изохоры.
Фазовые равновесия
Зависимость константы химической реакции от температуры. Уравнение изобары (изохоры) химической реакции его вывод.
Основные понятия: фаза, компонент, степени свободы. Условие межфазного равновесия.
Правило фаз Гиббса и его вывод. Классификация гетерогенных систем.
Фазовые диаграммы однокомпонентных систем (вода, сера, фосфор).
Уравнение Клапейрона, уравнение Клаузиуса – Клайперона, их вывод.
Фазовая диаграмма состояния двухкомпонентной системы с эвтектикой.
Фазовые диаграммы двухкомпонентной системы с неограниченной растворимостью компонентов в жидком и твердом состоянии.
Фазовые диаграммы двухкомпонентных систем с ограниченной растворимостью компонентов в твердом состоянии.
Фазовая диаграмма двухкомпонентной системы с конгруэнтной точкой плавления.
Фазовая диаграмма двухкомпонентной системы с инконгруэнтной точкой плавления.
Диаграммы состояния двухкомпонентных систем с ограниченной растворимостью в жидкой фазе.
Диаграммы состояния трехкомпонентных систем. Треугольники Гиббса и Розебома. Эвтектика в трехкомпонентной системе.