
Atomnaya_fizika_UP
.pdf
91
жен представлять собой сумму орбитального и собственного моментов.
Модуль полного механического момента электрона опре-
деляется выражением |
j( j +1), |
|
L j = |
(4.8.1) |
где j — квантовое число полного момента («полное» квантовое число):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j = |
+ S , |
|
|
−S |
|
. |
(4.8.2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
При |
= 0 , |
|
|
j = |
1 |
|
|
— наблюдается одна спектральная линия; при |
||||||||||||||||||||
2 |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
=1 |
j |
= |
3 |
, |
j |
|
|
= |
|
1 |
— две спектральные линии. |
|
||||||||||||||||
|
|
2 |
|
|
||||||||||||||||||||||||
|
1 |
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Проекция полного механического момента электрона |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Lzj = m j |
, |
|
|
(4.8.3) |
||||
где |
m j |
|
— квантовое число, отвечающее за проекцию полного |
|||||||||||||||||||||||||
момента на какую-либо ось: |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m j |
= − j,− j +1,..., j −1, j . |
(4.8.4) |
||||||||
Например, |
если |
j = |
3 |
, |
то |
возможны следующие |
значения: |
|||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||
m j = − |
3 |
,− |
1 |
, |
1 |
, |
3 |
. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
2 |
2 |
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Расчет полного магнитного момента оказывается сложнее. |
|||||||||||||||||||||||||||
Дело в том, что у орбитального и собственного момента разные гиромагнитные отношения (см. 4.4.10). Французский ученый Ландé ввел поправку, учитывающую вклад собственного момента ( g -фактор или фактор Ланде):
g =1+ |
j( j +1)+ S(S +1)− ( +1) |
. |
(4.8.5) |
|
|
||||
|
|
2 j( j +1) |
|
|
При S = 0, j = , g =1; при |
= 0 , j = S и g = 2. |
|
||
С учетом g-фактора модуль полного магнитного момента |
||||
электрона равен: |
= g μБ j ( j +1) . |
|
||
|
μj |
(4.8.6) |
||
Проекция полного магнитного момента электрона |
|
|||
|
|
μzj = g mjμБ . |
(4.8.7) |
|

92
4.9 Механический и магнитный моменты атомов
В многоэлектронных атомах состояние каждого электрона определяется теми же квантовыми числами, что и в атоме водорода. Влияние на данный электрон всех остальных электронов проявляется в том, что поле, в котором движется электрон, пере-
стает быть кулоновским, т.е. изменяющимся по закону ~ 1 . Это r 2
обусловливает зависимость энергии не только от n, но и от . Механический и магнитный моменты атома слагаются из
орбитальных и спиновых моментов отдельных электронов. При этом возможны два случая.
1.Орбитальные механические моменты (Le) взаимодействуют между собой сильнее, чем со спиновыми (собственными) моментами (Ls), которые, в свою очередь, сильнее связаны друг с другом, чем с Le. Вследствие этого, все Le складываются в результирующий орбитальный момент атома (Lea), а все Ls — в результирующий спиновый момент атома (Lsa). Затем уже Lea и Lsa, складываясь, дают суммарный момент атома. Такой вид связи называют S -связью.
2.Каждая пара Le и Ls одного электрона взаимодействуют между собой сильнее, чем с Le и Ls других электронов. Находится Lj электронов, а потом уже Lja. Такая связь называется jj- связью. Этот вид связи наблюдается значительно реже и только у тяжелых атомов.
Мы ограничимся кратким рассмотрением только S -связи.
Вэтом случае
|
|
|
Lea = |
a ( a +1) , |
(4.9.1) |
||||
где |
a — орбитальное квантовое число атома. |
|
|||||||
|
В случае двух электронов |
a может иметь значения: |
|
||||||
|
|
a = |
1 + 2 , |
1 + 2 −1,....., |
|
1 − 2 |
|
, |
|
|
|
|
|
|
|||||
где |
1 и |
2 — орбитальные квантовые числа, определяющие мо- |
|||||||
дули электронов: Le = |
( +1). Результирующий момент может |
||||||||
иметь 2 |
min +1 различных значений ( min — меньшее из |
1 и 2 ). |
|||||||

93
В случае атома, имеющего более чем два электрона, максимальное значение a равно сумме всех электронов. Чтобы най-
ти минимальное значение a , нужно сложить сначала любых
двух электронов, затем каждый из полученных результатов складывается с третьего электрона и т.д. Наименьшее из получившихся при этом чисел будет представлять искомое минимальное значение a .
Пусть, например, 1 = 2 = 1, 3 = 3. Возможные значения
суммарного момента первого и второго электронов определяются числами 0,1,2. Сложение первого из этих чисел с 3 = 3 дает
a = 3, второго — a = 2,3,4 (1+3=4, 1+3-1=3, 1+3-2=2, 1−3 = 2 );
третьего числа — a =1,2,3,4,5. Следовательно, квантовое число,
определяющее результирующий момент в рассматриваемом случае, может иметь значения a =1,2,3,4,5. Минимальное значение
min =1, максимальное max = 5. Максимальное значение можно
было получить просто: 1+1+3=5.
Орбитальные квантовые числа всегда бывают целыми или нулями.
Проекция результирующего момента на некоторое направление z определяется, как и для любого момента, выражением:
Laz = ma , где ma = − a ,− a +1,..., a −1, a .
Результирующий спиновый механический момент атома и
проекция этого момента определяются выражениями: |
|
Lsa = Sa (Sa +1) и Lsza = ms . |
(4.9.2) |
Квантовое число Sa результирующего спинового момента
атома может быть целым или полуцелым в зависимости от того, четным или нечетным является число электронов в атоме. Например, при N = 4, Sa может принимать значения 0,1,2; при
N = 5 — Sa = 1 , 3 , 5 . 2 2 2
Результирующие орбитальный и спиновый механические моменты атома образуют в сумме полный момент импульса атома:
LJ = J (J +1), |
(4.9.3) |
где J = La + Sa , La + Sa −1,..., La −Sa .

94
Следовательно, J будет целым, если Sa |
— целое число (при |
||||||||||||
четном числе электронов в атоме). Например, при L |
|
= 2, S |
a |
= 3 |
|||||||||
|
|
|
|
|
|
|
|
|
a |
|
2 |
||
возможны значения J = |
1 |
, |
3 |
, |
5 |
, |
7 |
; а при L |
= 2, S |
|
= 1 возмож- |
||
|
|
|
|
a |
|||||||||
2 |
2 |
|
2 |
|
2 |
a |
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||||
ные значения J = 1,2,3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Проекция полного механического момента атома |
|
|
|||||||||||
LJa = mJ , где mJ |
= −J ,−J +1,..., J −1, J . |
|
|
(4.9.4) |
|||||||||
С механическими моментами связаны магнитные моменты, которые взаимодействуют между собой. Поэтому энергия атома зависит от взаимной ориентации L и LS и от взаимной ориента-
ции |
L a и LSa . Следовательно, состояние атома (и его энергия) |
|||||
определяется квантовыми числами La , Sa , J . |
|
|||||
|
Модуль магнитного момента атома определяется |
|||||
|
|
μJ |
= μБ g |
J (J +1), |
(4.9.5) |
|
где |
g = 1+ |
J (J +1)+ Sa (Sa +1)− La |
(La +1) |
|
||
|
|
|
. |
|
||
2J (J |
+1) |
|
|
|||
|
|
|
|
|
||
|
Если Sa = 0 , J = La , |
g = 1; если La = 0 , J = Sa , |
g = 2. Для |
|||
атомов фактор Ланде может быть g < 1 или даже g = 0 . |
||||||
|
Проекция магнитного момента атома |
|
||||
|
μJz = μБ gmJ , где mJ |
= −J ,−J +1,..., J −1, J . |
(4.9.6) |
|||
Теперь становится ясно, почему у разных атомов в опытах Штерна и Герлаха появлялось разное число полос — у них разное число проекций магнитных моментов атомов (рис. 4.5).
экран

 – Hg, Mg — у этих атомов μJ = 0 .
– Hg, Mg — у этих атомов μJ = 0 .

 – Ag, Na, K, Cu, Al, H
– Ag, Na, K, Cu, Al, H
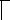
 – V (ванадий), N (азот)
– V (ванадий), N (азот)

 – Mn (марганец)
– Mn (марганец)
Рис. 4.5 — Результаты опытов Штерна и Герлаха по измерению магнитных моментов различных атомов

95
Расчет механических и магнитных моментов атомов не прост,
но он облегчается тем, что у полностью заполненных оболочек суммарные механический и магнитный моменты равны нулю.
4.10 Спектр атома водорода. Правило отбора при внутриатомных переходах
Как выяснилось, спином обладают все без исключения частицы. Спин — более фундаментальная характеристика, чем, например, заряд. Спин фотона S = 1.
Закон сохранения момента импульса требует, чтобы при поглощении или излучении фотона полный момент импульса атома изменялся на единицу, т.е. возможны не любые переходы, а подчиняющиеся так называемому правилу отбора.
Пусть атом до испускания фотона имел Jнач. = 0. Закон со-
хранения момента импульса позволяет утверждать, что после излучения Jкон. =1. Аналогично, в конечное состояние с J = 0 атом
может перейти из состояния с J = 1. Рассмотрим случай, когда J ≠ 0.
|
1 |
|
1 |
1 |
|
|
|
||
|
|
|
|
|
Jнач. |
|
Jнач. |
|
Jнач. |
Jкон. |
|
Jкон. |
||
|
Jкон. |
|
Рис. 4.6 — Возможные изменения полного момента многоэлектронного атома при испускании и поглощении фотона с S = 1.
Из рис. 4.6 видно, что при сложении единичного вектора 1 с вектором J длина последнего может измениться на единицу или
не измениться вовсе. Никакие другие изменения |
из-за квантова- |
||
ния J невозможны. Таким образом, правило отбора при излуче- |
|||
нии (или поглощении): |
= 0; |
|
|
J = ±1 |
Jнач. = 0 или Jкон. |
|
|
J = ±1,0 |
Jнач. ≠ 0 и Jкон. |
≠ 0. |
(4.10.1) |

96 |
|
Аналогично, для квантового числа mJ : |
|
mJ = ±1,0 |
(4.10.2) |
Для атома водорода и водородоподобных атомов (имеющих на орбите только один электрон) правило отбора выглядит подругому. Излучение света связано с электромагнитными свойствами электрона. Во взаимодействии с электромагнитной волной участвуют как заряд, так и магнитный момент электрона. Испускание света возможно либо в результате изменения движения заряда, либо в результате изменения (поворота) собственного магнитного момента. Расчет показывает, что для электромагнитного излучения, лежащего в оптическом диапазоне, взаимодействие фотона с зарядом электрона оказывается гораздо сильнее взаимодействия с магнитным моментом. Орбитальный момент импульса влияет как на первый, так и на второй, а направление спина — только на магнитный момент. Поэтому при испускании фотонов оптического диапазона S = 0 и изменение J на единицу фактически связано только с изменением на единицу. Итак, для водорода правила отбора:
= ±1. |
(4.10.3) |
На рис. 4.7 показаны возможные переходы электрона в атоме водорода с учетом правила отбора.
|
|
|
|
|
|
|
|
|
ℓ |
S |
|
P |
|
d |
|
f |
||
E,эВ |
|
|
|
|
0 |
1 |
2 |
3 |
|
|||||||||
|
|
|
|
n |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
–0,85 |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Серия Пашена |
|||||||
–1,5 |
|
|
|
3 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
–3,4 |
|
|
2 |
|
|
|
|
|
Серия Бальмера |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
–13,6 |
|
1 |
|
Серия Лаймана |
|
|
Рис. 4.7 — Схема возможных переходов электрона в атоме водорода с учетом правила отбора
97
4.11 Тонкая структура уровней водородоподобных атомов
Исследование спектров водорода и водородоподобных атомов (по спектральным характеристикам к ним относятся и щелочные металлы: K, Na, Ag,…) с помощью приборов с большой разрешающей силой показало, что каждая линия этих спектров, кроме S-состояний, является двойной. Почему? До введения понятия спина объяснений не было.
μ |
|
Орбитальное движение электрона |
|
создает орбитальный магнитный момент |
|
|
μS |
μ , т.е. магнитное поле B . Спиновый |
J |
магнитный момент, конечно же, взаимо- |
|
|
|
действует с этим магнитным полем. Та- |
|
−μS |
кое взаимодействие называется спин- |
ϑ |
орбитальным. И в зависимости от ори- |
|
Рис. 4.8 |
|
ентации спина это взаимодействие по- |
|
разному изменяет энергию электрона. |
|
|
|
|
Если μ ↑↑ μS |
— будет отталкивание (см. рис. 4.8), энергия уве- |
|
личивается; если μ ↑↓ μS — притяжение, энергия уменьшается.
Вместо одного основного уровня мы имеем два уровня. Расщепление уровней с данным n из-за спин-орбитального
взаимодействия называется тонкой структурой. Тонкой называют потому, что расщепление мало по сравнению с «расстоянием» между значениями энергии En с разными n (см. рис. 2.1).
На рис. 4.9, а изображена схема расщепления уровня с n = 2. Принято состояние электрона обозначать так: n j .
|
|
|
|
|
2P |
|
|
|
3P3 |
|
|
|
|
|
|
|
|
|
|||
=1 |
3 |
|
|
|
|
2 |
||||
2 |
|
|
|
|
||||||
|
|
|
|
|
2P1 |
|
|
|
3P1 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
2 |
|
|
|
|
|
|||
|
= 0 |
|
|
|
2S1 |
|
|
|
3S |
1 |
|
|
|
|
° |
° |
|||||
|
|
|
|
|
|
2 |
||||
|
|
2 |
|
5090 A |
5096 A |
|
||||
|
|
|
|
а |
|
|
||||
|
|
|
|
Рис. 4.9 |
б |
|
||||
|
|
|
|
|
|
|
|
|
||
а — к объяснению тонкой структуры уровня с n = 2 ; б — тонкая структура атома Na (дублет натрия)
98
У многоэлектронных атомов может быть по несколько линий тонкой структуры — мультиплеты. Число линий определяется числом возможных значений J и правилом отбора (например, у Mn — 6 линий, у Fe — 9 линий).
Почему у Na (11 электронов) только две линии (дублет, см. рис. 4.9, б)? У Na слои с n = 1 и n = 2 полностью заполнены: ∑μ = 0. В слое n = 3 находится только один электрон: он может
находиться либо в S-, либо P-состоянии.
4.12 Постоянная тонкой структуры
Обусловленное спин-орбитальным взаимодействием расщепление энергетических уровней является релятивистским эффектом, поскольку сам спин — релятивистский параметр. Из решения релятивистского уравнения Дирака (см. раздел 3.4) получается следующее выражение для интервала между энергетическими уровнями тонкой структуры (в системе СГС):
|
|
|
|
|
|
E = |
α2 |
E , |
(4.12.1) |
||||
|
|
|
|
|
|
16 |
|||||||
|
|
|
|
|
|
|
|
|
i |
=13,6 эВ; |
|||
где Ei — энергия ионизации, для атома водорода Ei |
|||||||||||||
α = |
e2 |
|
1 |
— постоянная тонкой структуры. |
|||||||||
C |
|
||||||||||||
|
137 |
|
|
|
|
|
|
|
|
|
|
||
(В системе СИ: α = |
e2 |
|
|
|
1 |
7,3 10−3 |
1 |
|
). |
||||
|
|
|
|
|
|||||||||
|
|
|
|
|
C 4πεo |
137 |
|
|
|||||
E , вычисленная по 4.12.1, примерно в 105 раз меньше, чем E между основными уровнями, определяемыми значением n.
Постоянная тонкой структуры принадлежит к числу фундаментальных констант природы. Ее смысл становится очевидным при переходе к естественной системе единиц, применяемой в квантовой электродинамике: единица массы равна массе электрона ( me ), единица длины равна C — комптоновской длине
электрона: C |
= |
λC |
= |
|
; единица энергии равна энергии по- |
|
|
||||
|
|
2π |
|
me C |
|
коя электрона me C2 ; уже знакомые нам: — естественная еди-
99
ница измерения механического момента импульса; μБ — естест-
венная единица измерения магнитного момента импульса и т.д. Найдем энергию взаимодействия двух электронов, находя-
щихся на расстоянии |
C (в единицах системы СГС): |
|||||||||
E = |
e2 |
|
, ε =1, r = C ; E = |
e2 |
m C |
|
e2 |
|||
|
|
|
e |
= |
|
= α. |
||||
|
|
(meC2 ) |
|
|||||||
|
ε r |
|
|
C |
||||||
(Разделив |
|
E |
, мы выразили E в «штуках» естественной |
|||||||
m C2 |
||||||||||
|
|
|
|
|
|
|
|
|||
|
|
|
e |
|
|
|
|
|
|
|
единицы энергии, т.е. в виде безразмерной величины α).
Итак, постоянная тонкой структуры характеризует энергию взаимодействия двух электронов. Иначе можно сказать, что α определяет, как сильно электрон связан с электромагнитным полем. Поскольку в выражение для α масса электрона не входит, то α является const связи с электромагнитным полем любой элементарной частицы, имеющей заряд е.
4.13 Эффект Зеемана
4.13.1 Нормальный эффект Зеемана
Эффектом Зеемана (Питер Зееман, 1865—1940 гг.) называ-
ется расщепление энергетических уровней и, следовательно,
спектральных линий на несколько компонентов в магнитном поле. Это расщепление было обнаружено голландским физиком П. Зееманом в 1896 г. Расщепление невелико: при B 1 Тл оно
составляет несколько десятых долей ангстрема ( Δλ ~ 10−11м). Расщепление объясняется тем, что атом, обладающий маг-
нитным моментом, связанным с орбитальным движением электронов, приобретает в магнитном поле дополнительную энергию
E = −μ B B ,
где μ B — проекция магнитного момента на направление внешне-
го магнитного поля B . Поскольку m = 0, ±1, ±2,..., ± , то ясно, что энергетический уровень расщепляется на 2 +1 компонентов
(рис. 4.10).

100
( |
=1) |
|
|
|
|
|
|
|
ωo + Δω, Eo + |
E |
|
|
|
|
|
|
|
||||
P |
|
|
|
|
|
|
ωo , Eo |
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
ωo |
|
|
|
|
ωo − Δω, Eo − |
E |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
( |
=1) |
S |
|
|
|
|
|
E = Δω |
|
|
B = 0 |
|
|
|
B ≠ 0 |
|
|||||
|
|
|
|
|
|
|
|
|||
Рис. 4.10 — К объяснению нормального эффекта Зеемана
Все это соответствует нормальному (или простому) эффекту Зеемана. Объяснение его было сделано Г. Лоренцем задолго до введения квантовых чисел и m.
Рассуждения просты: раз в атоме есть электроны, они как-то движутся и, следовательно, обладают магнитным моментом, который взаимодействует с внешним магнитным полем. Квантовые числа и m дали четкие и понятные количественные соотношения.
4.13.2 Аномальный эффект Зеемана
При использовании более чувствительной аппаратуры уже в относительно слабых магнитных полях было обнаружено бóльшее число линий, чем это следовало из простого эффекта Зеемана. Такая структура линий была названа тонкой структурой, а сам эффект — аномальным эффектом Зеемана. Он не был объяснен до тех пор, пока в науку не было введено понятие спина. Как было отмечено в разделе 4.11, тонкая структура есть следствие спин-орбитального взаимодействия. Спин-орбитальное взаимодействие существует всегда, т.е. и в отсутствие внешнего магнитного поля; магнитное поле нужно для выявления этого взаимодействия. На рис. 4.11 показана тонкая структура дублета натрия при B = 0 и при включении магнитного поля.
Число состояний тонкой структуры определяется числом
возможных значений J: при = 0 (S-состояние) J = |
1 |
; при = 1 |
|||
|
|||||
(P-состояние) J = 3 |
|
1 |
2 |
|
|
и |
. При включении магнитного поля ка- |
||||
2 |
|
2 |
|
|
|
