- •Текст лекций по органической химии
- •Самара 2006
- •Содержание
- •Галогензамещенные углеводороды
- •Изомерия
- •Номенклатура
- •Методы получения
- •Замещение гидроксильной группы на галоген
- •Физические свойства
- •Характеристики связей с‑х
- •1. Нуклеофильное замещение
- •2. Реакция элиминирования (отщепление)
- •3. Восстановление галогеналканов
- •4. Металлоорганические соединения
- •Углеводородов Галогенпроизводные ароматических углеводородов
- •Ненасыщенные галогенпроизводные
- •Ароматические галогенпроизводные
- •Химические свойства
- •Отдельные представители
- •Спирты и фенолы
- •Лабораторные методы получения спиртов
- •2. Гидратация алкенов
- •3. Восстановление карбонильных соединений (кетонов и альдегидов), сложных эфиров
- •4. Синтезы спиртов с использованием реактивов Гриньяра
- •Промышленные методы получения спиртов
- •Физические свойства спиртов
- •Химические свойства спиртов
- •3. Реакции отщепления
- •4. Окисление
- •Отдельные представители
- •ДвухАтомные спирты
- •Изомерия и номенклатура
- •Способы получения
- •Трехатомные спирты
- •Ненасыщенные спирты
- •Способы получения фенолов
- •1. Коксование каменного угля
- •2. Замещение галогена в ароматических соединениях
- •3. Способ Рашига
- •4.Сульфонатный способ
- •5. Кумольный метод
- •6. Из солей диазония
- •Строение фенолов
- •Химические свойства фенолов
- •Отдельные представители
- •Альдегиды и кетоны
- •Способы получения альдегидов и кетонов
- •2. Гидроформилирование алкенов (оксосинтез)
- •4. Термическое разложение Са- и Ва-солей карбоновых кислот
- •Физические свойства альдегидов и кетонов
- •Электронное строение и общая характеристика реакционной способности
- •Химические свойства альдегидов и кетонов
- •Реакции присоединения
- •2. Присоединение спиртов.
- •Основной катализ
- •Реакции с участием α-водородного атома
- •2. Галогенирование альдегидов и кетонов
- •Окислительно–восстановительные реакции
- •Отдельные представители
- •Химические свойства
- •Химические свойства
- •Способы получения
- •Физические свойства
- •Химические свойства
- •3. Бензоиновая конденсация (н.Н. Зинин)
- •Отдельные представители
- •Карбоновые кислоты
- •Кислоты
- •Промышленные способы получения карбоновых кислот
- •Лабораторные способы получения карбоновых кислот
- •5. Гидролиз жиров
- •Эта операция называется омылением, так как соли карбоновых кислот используют для изготовления мыла. Физические свойства
- •1. Диссоциация карбоновых кислот
- •8. Восстановление кислот (реакции по карбонильной группе)
- •9. Реакции по α-углеродному атому.
- •Ненасыщенные кислоты
- •Функциональные производные карбоновых кислот
- •Ангидриды карбоновых кислот
- •Нитрилы
- •Способы получения
- •Химические свойства
- •Соли карбоновых кислот
- •Двухосновные насыщенные кислоты
- •Ненасыщенные одноосновные kapбоhobыe кислоты
- •Отдельные представители
- •Ненасыщенные двухосновные kapбоhobыe кислоты
- •Способы получения
- •1. Превращение функциональных групп
- •1.3. Реакция Канниццаро:
- •Отдельные представители
- •Дикарбоновые ароматические кислоты
- •Азотсодержащие соединения
- •Номенклатура
- •Способы получения нитроалканов
- •1. Нитрование алканов азотной кислотой (Коновалов, Хэсс)
- •2. Реакция Мейера (1872)
- •Строение нитроалканов
- •Физические свойства
- •Химические свойства
- •1. Образование солей
- •2. Реакции с азотистой кислотой
- •3. Синтез нитроспиртов
- •4. Восстановление нитросоединений
- •5. Взаимодействие нитросоединений с кислотами
- •Отдельные представители
- •Соединения с нитрогруппой в ядре
- •Получение ароматических нитросоединений
- •Нитросоединения с нитрогруппой в боковой цепи (жирноароматические соединения)
- •Химические свойства
- •1. Восстановление
- •2. Реакции электрофильного замещения
- •3. Реакции нуклеофильного замещения
- •Отдельные представители
- •Способы получения алифатических аминов
- •1. Аммонолиз галогеналканов
- •2. Аммонолиз спиртов
- •3. Синтез Габриэля
- •4. Восстановительное аминирование карбонильных соединений
- •5. Восстановление нитроалканов, оксимов, нитрилов, амидов
- •6. Расщепление амидов кислот (перегруппировка Гофмана)
- •7. Перегруппировка Курциуса
- •Физические свойства
- •Химические свойства аминов
- •1. Реакции аминов с кислотами
- •2. Алкилирование аминов галогеналканами
- •3. Ацилирование аминов (получение амидов)
- •4. Взаимодействие с азотистой кислотой
- •5. Образование изонитрилов
- •Отдельные представители
- •Способы получения ароматических аминов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Синтез азометинов (оснований Шиффа)
- •4. Реакции аминов с азотистой кислотой
- •Важнейшие представители ароматических аминов
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
- •Гетероциклические соединения
- •Физические свойства
- •Строение пятичленных гетероциклов
- •Общие химические свойства
- •2. Реакции присоединения
- •6) Получение ртутных производных
- •Химические свойства
- •1) Хлорирование
- •3) Сульфирование
- •4) Нитрование
- •2. Нуклеофильное замещение
- •3. Реакции пиридина как основания
1. Диссоциация карбоновых кислот
Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты, из-за стабилизации карбоксилат – аниона, вызванной делокализацией -электронов. Другими словами, карбоксилат-ион стабилизирован вследствие резонанса:

Степень делокализации изменяется в ряду RCОО- >> RCOОH >> RОH, RO-


Энергия а - стабилизация, вызванная делокализацией вRCOOH;b - стабилизация, обусловленная делокализацией вRCOО-; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу диссоциации Ка или через рКа. Константы диссоциации большинства карбоновых кислот составляют около 10-5 (например, для уксусной кислоты 1,8∙10-5), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-анион. Электроноакцепторные заместители в молекуле карбоновой кислоты, оттягивающие электроны от карбоксильной группы, стабилизируют карбоксилат-ион и увеличивают способность его образования, т.е. увеличивают силу кислоты. Электронодонорные заместители оказывают противоположное действие.

Влияние заместителей на кислотность показано в таблице 21.1.
Таблица 21.1
Влияние заместителей на кислотность
-
Кислота
рКа
СН3СООН
4.8
СН3СН2СООН
4.8
ClСН2СООН
2.9
Cl2СНСООН
1.3
Сl3CСООН
0.7
FСН2СООН
2.6
F3CСООН
0.2
2. Образование солей. Органические кислоты образуют соли с металлами, их оксидами, карбонатами, гидрокарбонатами и щелочами, например:
СН3СООН + NaOH СН3СОО-Na+ + H2O
3. Образование галогенангидридов. Под действием галогенидов фосфора (PCl5, PCl3, PBr3) карбоновые кислоты образуют галогенангидриды (гидроксил замещается на галоген):

Хлорангидриды могут также быть получены действием на карбоновые кислоты тионилхлорида:

Реакция с аммиаком. При комнатной температуре карбоновые кислоты образуют с аммиаком аммонийные соли, которые при нагревании превращаются в амиды карбоновых кислот:

Образование ангидридов кислот

6. Декарбоксилирование. Карбоновые кислоты способны отщеплять диоксид углерода. Как правило, при этом образуется углеводород. Алифатические карбоновые кислоты декарбоксилируются в присутствии различных катализаторов, содержащих медь (например, Cu / хинолин).
CH3СН2СООНCH3CH3+CO2
К реакциям декарбоксилирования относится и синтез Кольбе (см. Лекцию №2, ч.1)
7. Реакция этерификации. В присутствии сильной кислоты (например, серной) карбоновые кислоты дают со спиртами сложные эфиры:
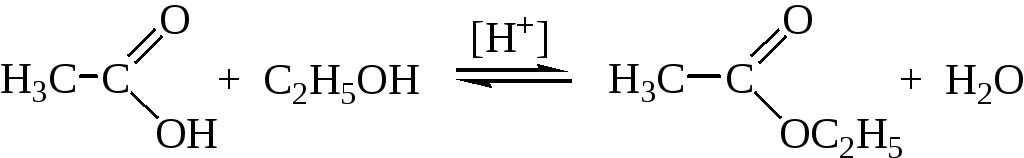
В результате реакции образуется равновесная смесь. Чтобы сместить равновесие в сторону образования продукта, используют большой избыток спирта или удаляют воду по мере ее образования.
Механизм этерификации представляет собой реакцию присоединения -отщепления (нуклеофильное ацильное замещение), его можно представить в виде следующих стадий:
Стадия 1. Атака молекулы карбоновой кислоты протоном

Стадия 2. Нуклеофильная атака молекулой спирта карбонильного атома углерода

Стадия 3. Изомеризация образовавшегося аддукта

Стадия 4. Отщепление воды и депротонирование продукта реакции