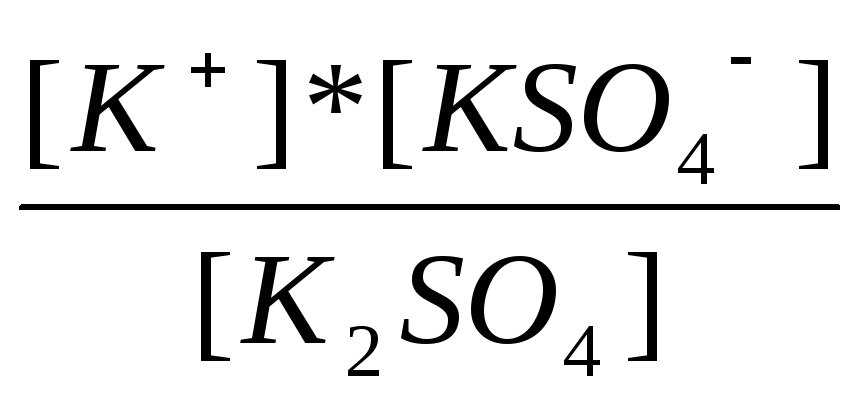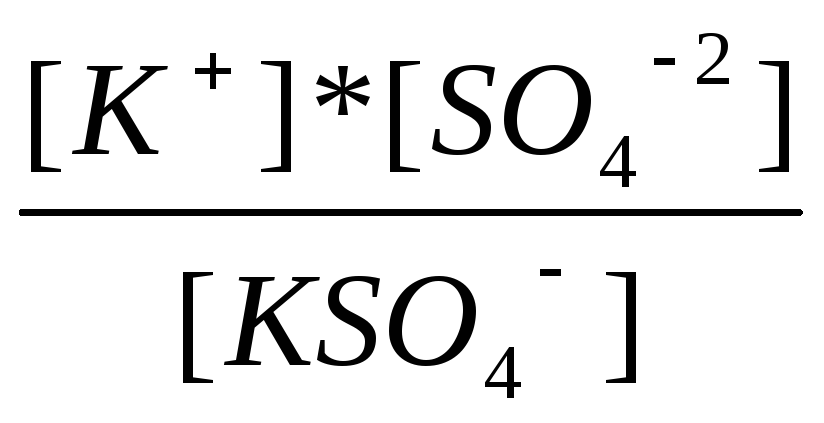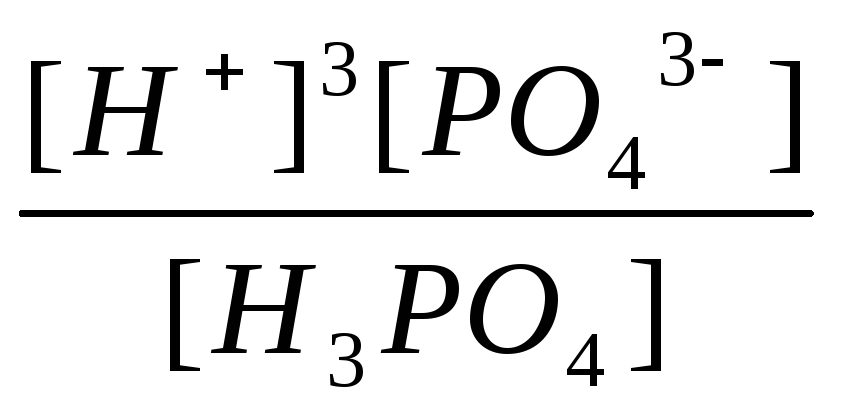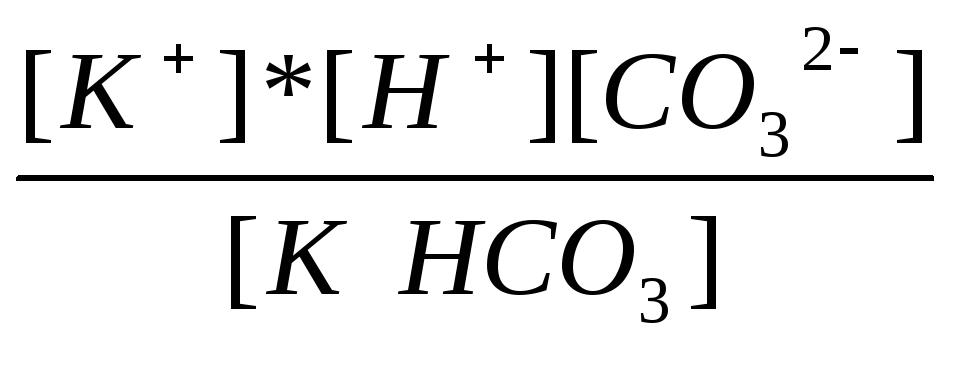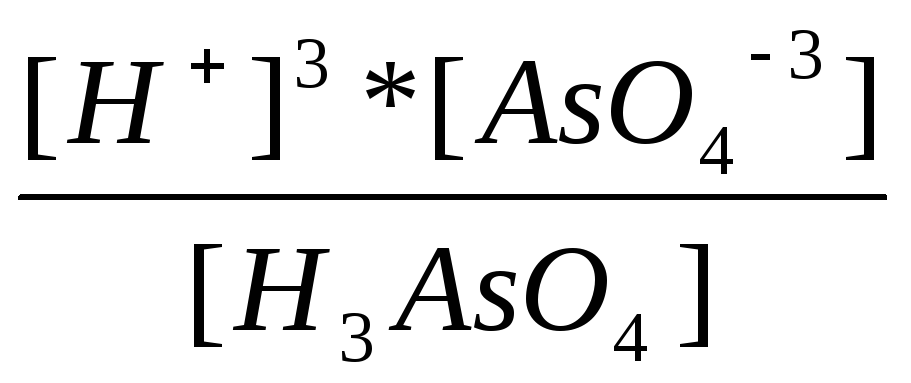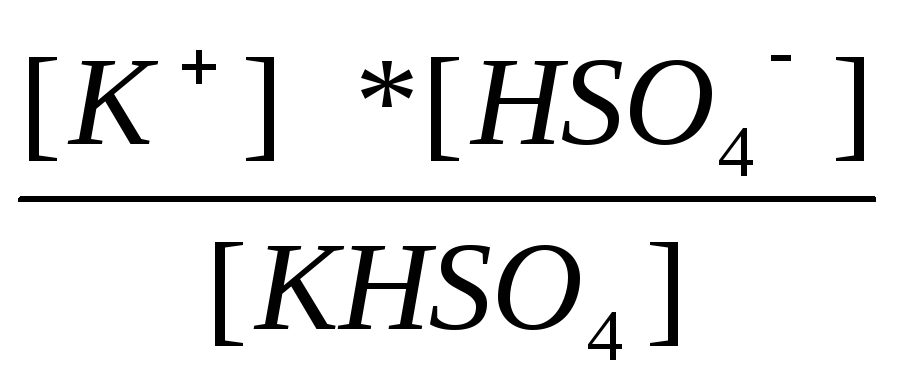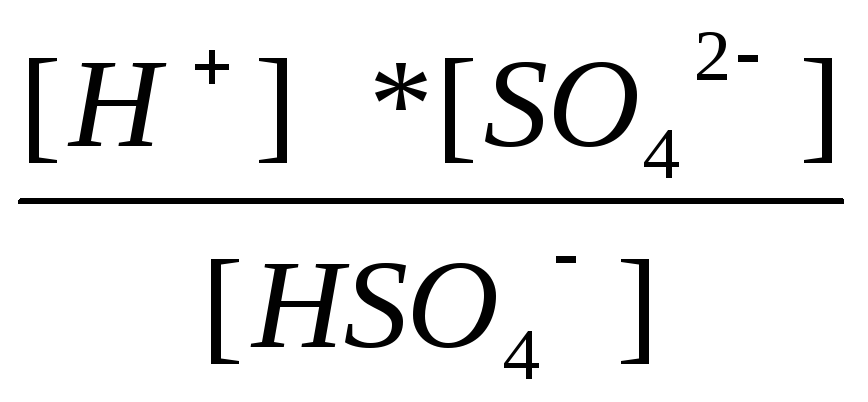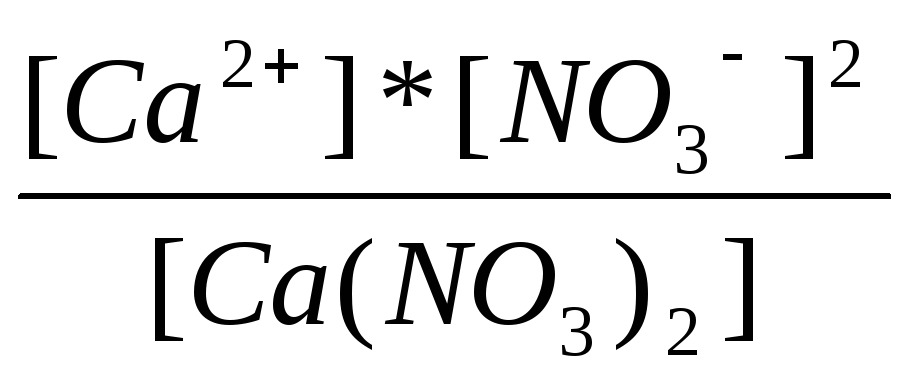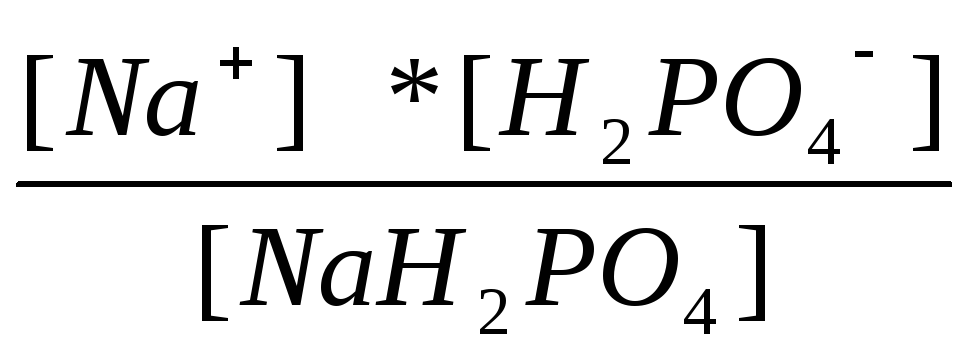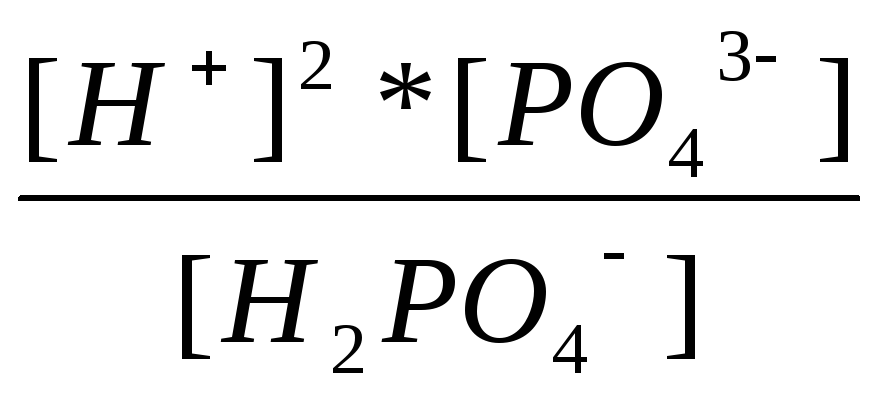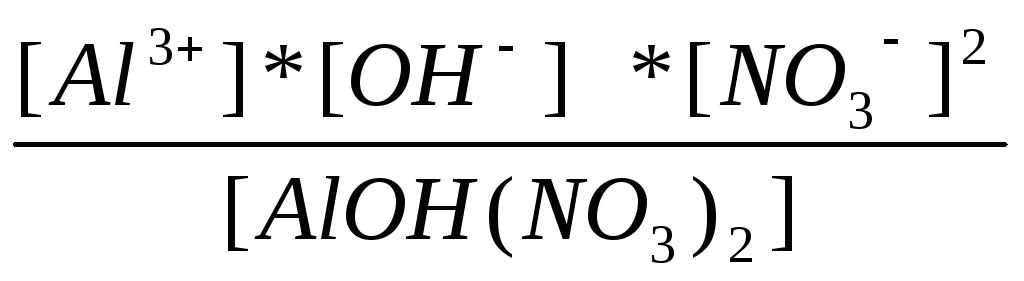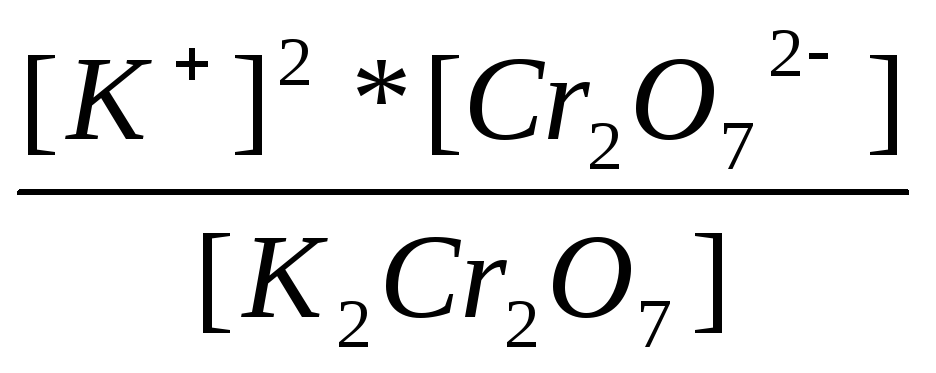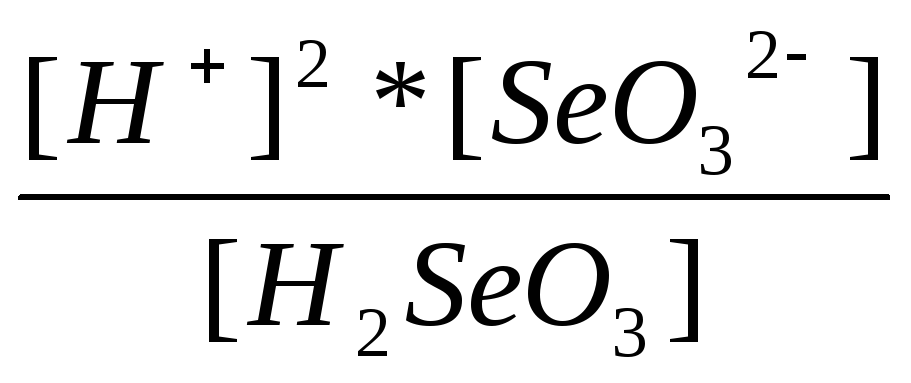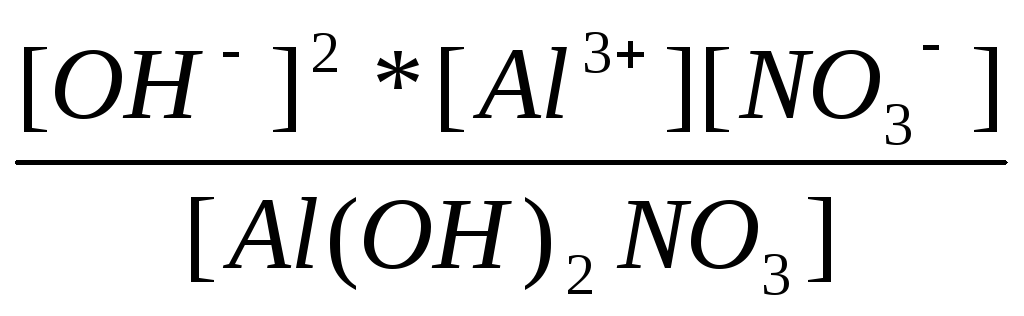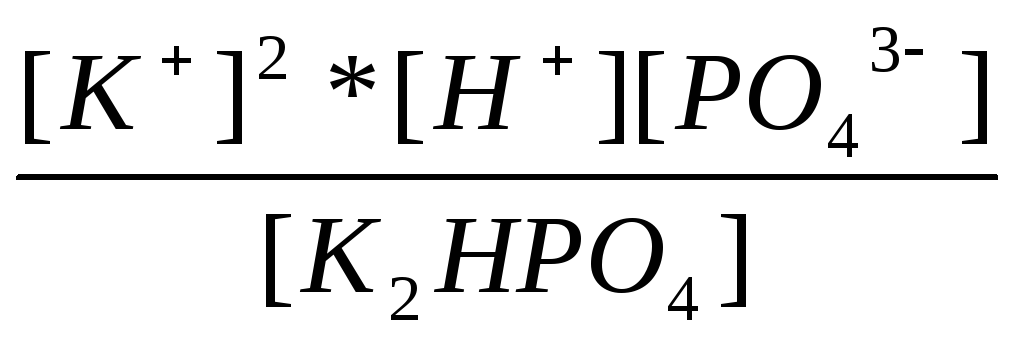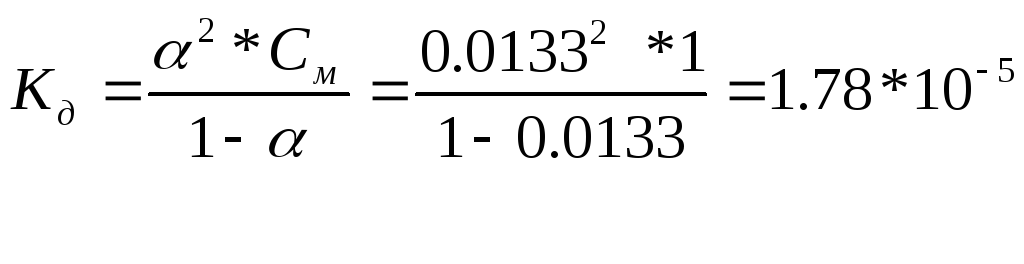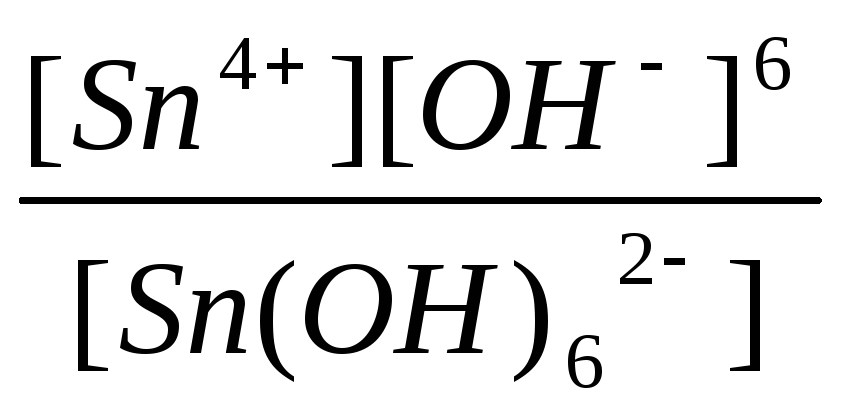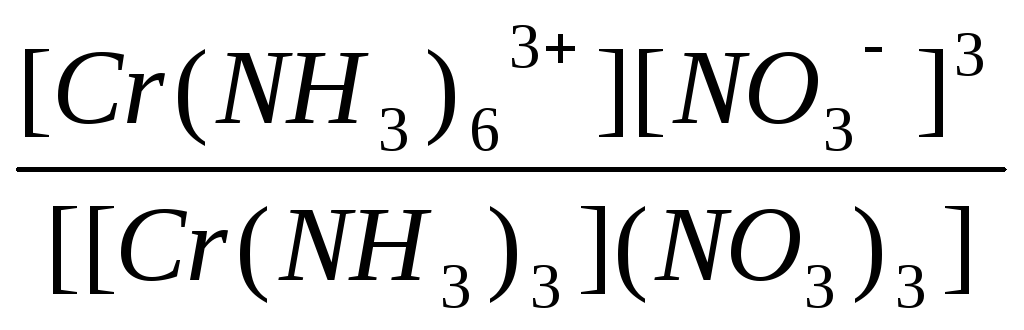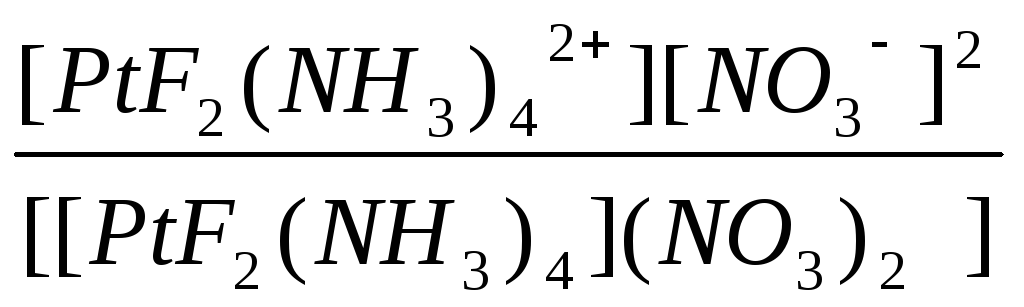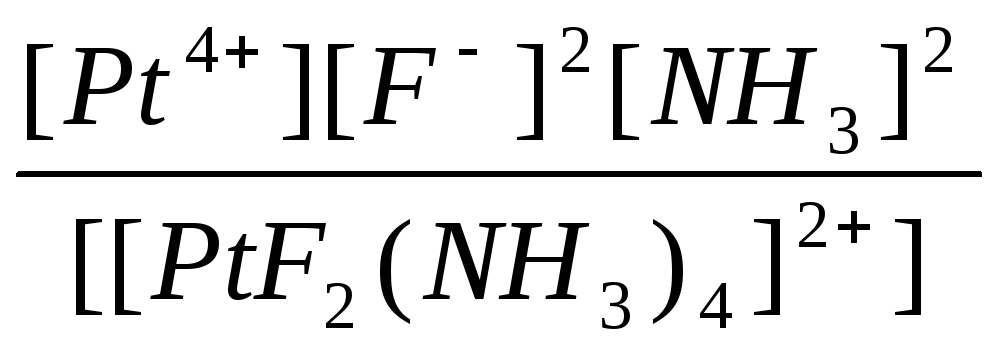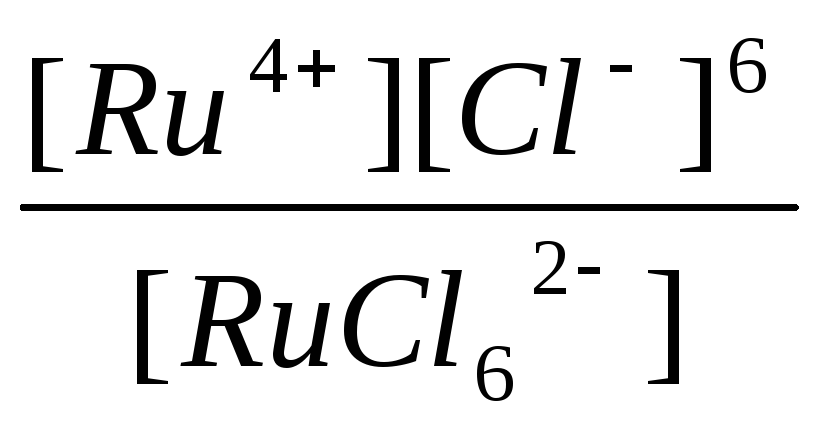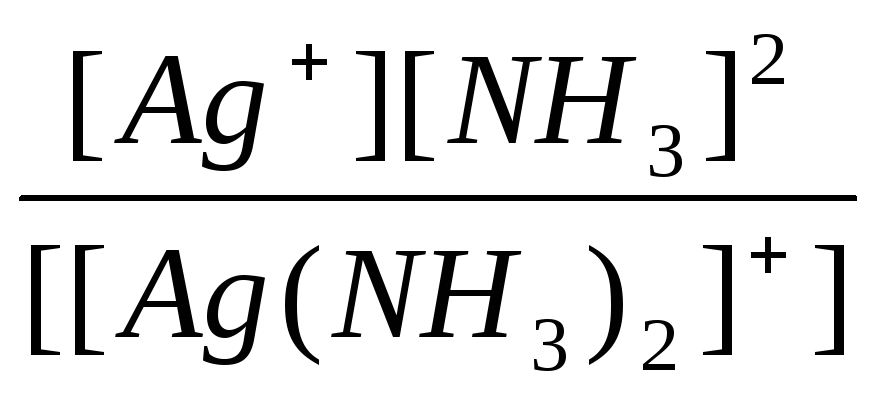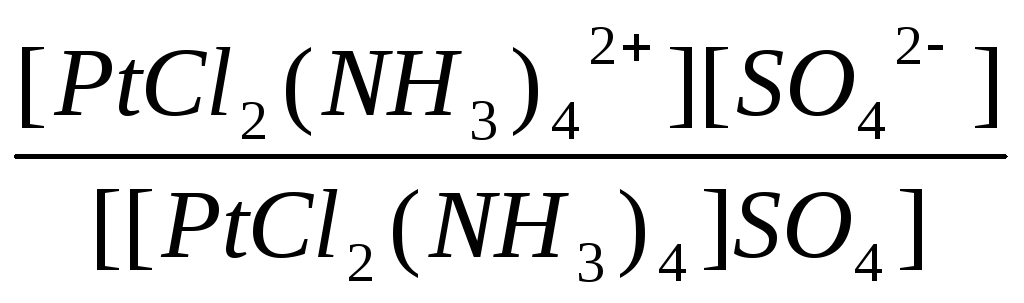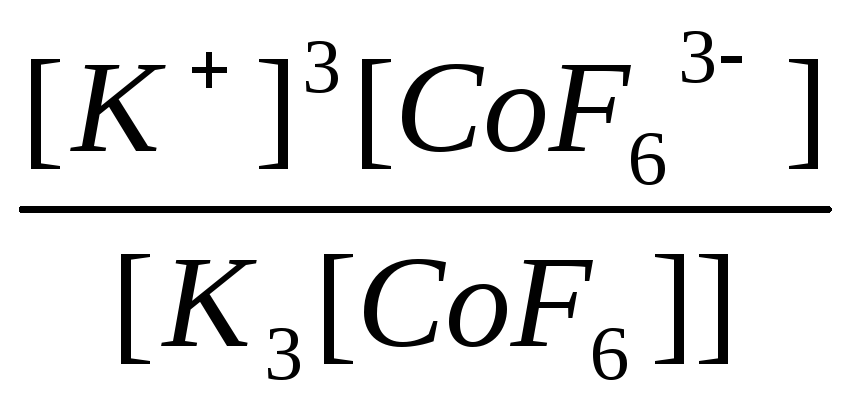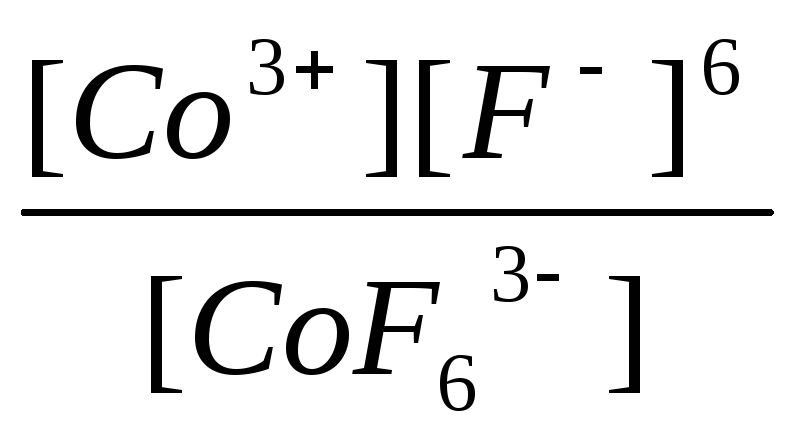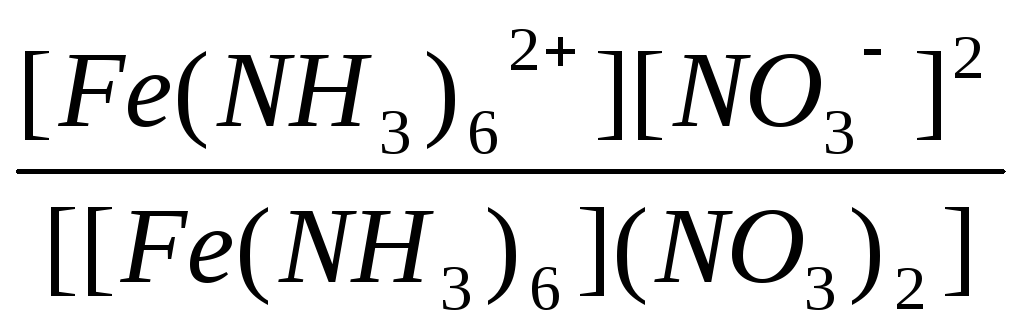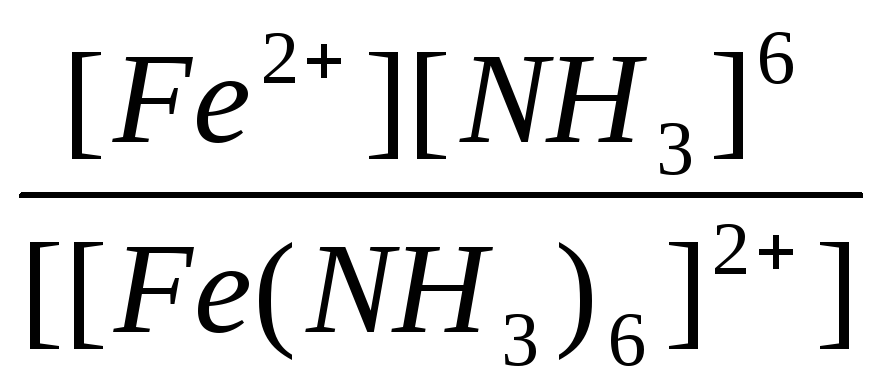501.[Cr(H2O)5Cl]2+(NO3)2 - нитрат хлорпентааквахрома(+3), к.о. - хром, с.о.= +3, к.ч.= 6.
K2[Sn(OH)4]2- - тетрагидроксостаннат(+2) калия, к.о. - олово, с.о. = +2, к.ч. = 4.
[Co(NO2)3(NH3)3]0 - тринитротриамминкобальт(+3), к.о. - кобальт, с.о. = +3, к.ч. = 6.
502.K2[Ni(CN)4]2- - тетрацианоникелат(+2) калия, к.о.= никель, с.о.= +2, к.ч.= 4. [Ti(H2O)6]1+ Cl- хлорид гексаакватитана(+1), к.о.= титан, с.о.= +1, к.ч.= 6; [Co(SCN)2(NH3)2]0 - дироданодиамминкобальт(+2), к.о.= кобальт, с.о.= +2, к.ч.= 4.
503.K2[HgCl4]2- - тетрахлоромеркурат(+2) калия, к.о.= ртуть, с.о.= +2, к.ч.=4. [Ag(NH3)2]1+ Cl- хлорид диамминсеребра(+1), к.о.=серебро, с.о.= +1, к.ч.=2. [Cu(SCN)2(NH3)2]0 - дироданодиамминмедь (+2), к.о.=медь, с.о.= +2, к.ч.= 4.
504.
|
Название комплекса |
Комплекс |
КО |
СО |
КЧ |
Заряд |
|
Тетрахлороплатинат(II) аммония |
(NH4)2[Pt(Сl)4] |
платина |
+2 |
4 |
-2 |
|
Нитрат пентаамминроданокобальта(III) |
[Co(NH3)5СNS](NO3)2 |
кобальт |
+3 |
6 |
+2 |
|
Гексабромоплатинат(IV)тетрааквацинка(II) |
[Zn(H2O)4][PtBr6] |
Цинк-платина |
+2 +4 |
4 6 |
+2 -2 |
505.
|
Название комплекса |
Комплекс |
КО |
СО |
КЧ |
Заряд |
|
Гексагидроксоалюминат калия |
K3[Al(OH)6] |
Алюминий |
+3 |
6 |
-3 |
|
Гидросульфат пентаамминнитратокобальта(III) |
[Co(NH3)5NO3](HSO4)2 |
Кобальт |
+3 |
6 |
+2 |
|
Гексахлороплатинат(IV) гексаакважелеза(II) |
[Fe(H2O)6][PtCl6] |
железо-платина |
+2 +4 |
6 6 |
+2 -2 |
506.
|
Название комплекса |
Комплекс |
КО |
СО |
КЧ |
Заряд |
|
гексацианоферрат(III) натрия |
Na3[Fe(CN)6] |
Железо |
+3 |
6 |
-3 |
|
Бромид гексааминхрома(III) |
[Cr(NH3)6]Br3 |
Хром |
+3 |
6 |
+3 |
|
Гексафтороманганат(IV) тетраакваникеля(II) |
[Zn(H2O)4][MnF6] |
Цинк-марганец |
+2 +4 |
4 6 |
+2 -2 |
507.
|
Комплекс |
Название комплекса |
Особенности |
|
[Cr(H2O)5Cl](NO3)2 |
Гексааквахлорохром(III) нитрат |
Соль, катионное, смешанное. |
|
H[AuCl4] |
Водорода тетрахлороаурат(III) |
Кислота, анионное, ацидокомплексное. |
|
[Cu(NH3)4](OH)2 |
Тетраамминмедь(II) гидроксид |
Основание, катионное, амминокомплексное |
|
[Fe(H2O)6]SO4 |
Гексаакважелезо(II)сульфат |
Соль, катионное, аквакомплекс |
508.
|
Комплекс |
Название комплекса |
Особенности |
|
H2[SiF6] |
Гексааквахлорохром(III) нитрат |
Кислота, анионное, ацидокомплексное |
|
[Zn(NH3)4](OH)2 |
Водорода тетрахлороаурат(III) |
Основание, катионное, амминокомплексное. |
|
Na[Co(NH3)2(NO2)4] |
Тетраамминмедь(II) гидроксид |
Соль, анионное, смешанное. |
|
[Fe(H2O)6]2(SO4)3 |
Гексаакважелезо(III)сульфат |
Соль, катионное, аквакомплекс |
509.
|
Комплекс |
Название комплекса |
Особенности |
|
H2[Pt(CN)6] |
Водорода гексацианоплатинат(IV) |
Кислота, анионное, ацидокомплексное. |
|
[Co(SO4)(NH3)5]NO3 |
Пентаамминсульфаткобальта(III) нитрат |
Соль, катионное, смешанное. |
|
[Pd(H2O)4]Cl2 |
Тетрааквапалладий(II)хлорид |
Соль, катионное, аквакомплекс |
|
[Cd(NH3)4](OH)2 |
Тетраамминкадмий(II) гидроксид |
Основание, катионное, амминокомплексное |
510. Сульфат медиCuSO4, водаH2O, газообразный аммиакNH3. Необходимо растворить сульфат меди, пропустить через раствор аммиак - образуется комплекс:
CuSO4(тв) + H2O = CuSO4(ж),
CuSO4(ж) + NH3(г) = [Cu(NH3)4](SO4)
511. Нитрат ртути Hg(NO3)2, вода H2O, иодид калия KI. Необходимо растворить соли в воде, к нитрату ртути добавить иодид калия - выпадет осадок. Прилить иодида до полного растворения осадка - образовалась комплексная соль:
Hg(NO3)2(тв) + H2O = Hg(NO3)2(ж),
KI(тв) + H2O = KI(ж),
Hg(NO3)2(ж) + KI(ж) = HgI2(тв) + 2KNO3.
HgI2(тв) + 2 KI(ж) = K2[HgI4]
512. Co3+, NH3, NO2-, K+
-
Комплекс
Название
[Co(NH3)6](NO2)3
Гексаамминкобальт(III) нитрит
[Co(NH3)5(NO2)](NO2)2
Пентаамминнитритокобальт(III) нитрит
[Co(NH3)4(NO2)2](NO2)
Тетраамминдинитритокобальт(III) нитрит
[Co(NH3)3(NO2)3]
Триамминтринитритокобальт(III)
K[Co(NH3)2(NO2)4]
Калия диамминтетранитритокобальтат(III)
K2[Co(NH3)(NO2)5]
Калия амминпентанитритокобальтат(III)
K3[Co(NO2)6]
Калия гексанитритокобальтат(III)
513.Поскольку из раствора комплекса осаждается сульфат бария, то барий находится во внешней сфере комплекса:Ba[Cu(SCN)2(CN)2] - бария дицианодироданокупрат(II).
Ba[Cu(SCN)2(CN)2] + H2SO4 = BaSO4 + H2[Cu(SCN)2(CN)2]
514.Поскольку комплекс реагирует с нитратом серебра в соотношении 1:1, то во внешней сфере комплекса находится 1 атом хлора: [Pt(NH3)3Cl3]Cl- триамминдихлорплатина(IV).[Pt(NH3)3Cl3]Cl + AgNO3 = AgCl + [Pt(NH3)3Cl3]NO3.
515. Данные сложные соединения представляют собой комплексные соли, различающиеся между собой устойчивостью. Первый комплексK[Fe(SO4)2] малоустойчив, т.е. в его растворе присутствуют катионы железа, а второй комплекс железаK3[Fe(CN)6] устойчив настолько, что в растворе нет катионов железа, способных реагировать с роданидом калия.Fe3++ 3CNS-=Fe(CNS)3- красный роданид железа.
516. При хранении на воздухе сульфат меди превращается в комплекс, который имеет синюю окраску (медный купорос):CuSO4+ 5H2O= [Cu(H2O)5]SO4.
517. Гексацианоферрат(II) калия и сульфат меди:K4[Fe(CN)6] +CuSO4=Cu2[Fe(CN)6]. Образуется комплексная соль - гексацианоферрат(II) меди, которая нерастворима.[Fe(CN)6]+4 + Cu+2 = Cu2[Fe(CN)6].
518. 5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O. ОбразовалсяK3[Fe(CN)6] - гексацианоферрат(III) калия.
519.Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Co(CN)6]3- , т.к.z(Co= 3) >z(Co= 2). В случае б) прочнее [Co(CN)6]4-, т.к.CN- - лиганд сильного поля. в) прочнее [ZrF6]2- , т.к.r(Ti)<r(Zr).
520. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Zn(NH3)4]2- , т.к. NH3 - лиганд сильного поля. В случае б) прочнее [Hg(CN)4]2-, т.к.CN- - лиганд сильного поля. в) прочнее [Cu(NH)3]2+ , т.к.z(Cu2+)<z(Cu+).
521. Прочность комплекса, согласно электростатической теории, определяется зарядом и радиусом комплексообразователя – чем они больше, тем прочнее комплекс; а также силой лигандов – чем сильнее лиганд, тем прочнее комплекс. Так, в случае а) прочнее [Zn(СN)4]2- , т.к. CN - лиганд сильного поля. В случае б) прочнее [BeF4]2-, т.к.F – ионы более сильные лиганды, чемCl-ионы. в) прочнее [Zr(CN)6]2- , т.к.z(Ti+4)<z(Zr4+).
522. н
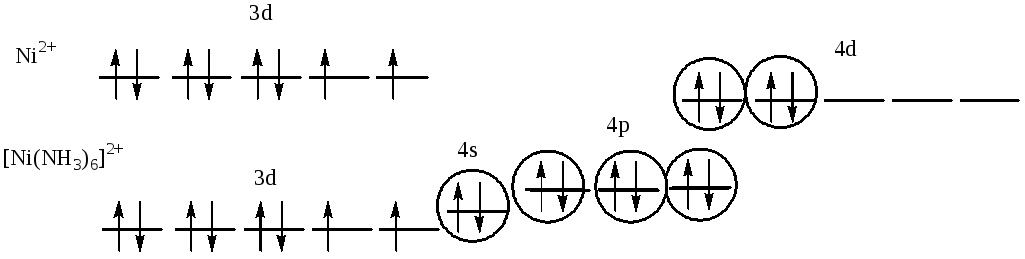
523. Взаимодействие между центральным атомомNiи лигандами (NH3) происходит по донорно-акцепторному механизму.
В образовании гибридных облаков участвуют вакантные 4s-, 4p-, 4d-орбитали ионаNi2+и электронные пары атомов азота. Т.о., гибридизуются однаs-, три р-орбитали и две 4d-орбитали, тип гибридизации комплекса:sp3d2, геометрия: октаэдр, парамагнетизм комплекса определяется наличием 2 неспаренных электронов на 3d-орбитали атома никеля.
524.
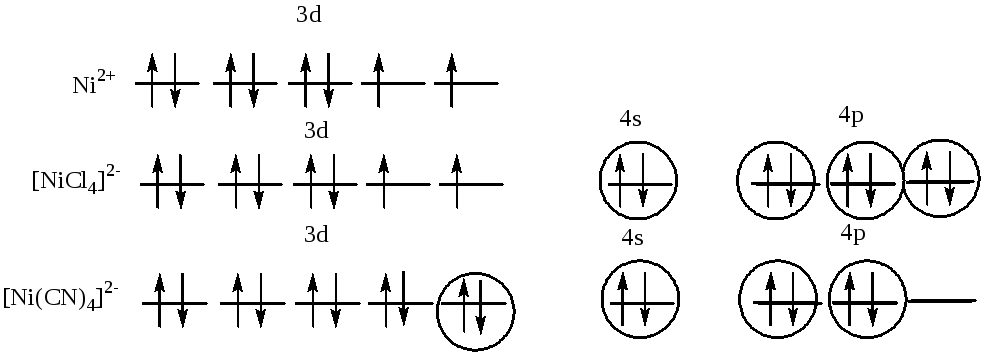
Взаимодействие между центральным атомом Niи лигандами (Cl) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные 4s- и 4p- орбитали ионаNi2+и электронные пары атомов хлора. Т.о., гибридизуются однаs- и три р-орбитали, тип гибридизации комплекса:sp3, геометрия: тетраэдр, парамагнетизм комплекса определяется наличием 2 неспаренных электронов на 3d-орбитали атома никеля.[Ni(CN)4]2- Взаимодействие между центральным атомомNiи лигандами (CN) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные 4s- и 4p- орбитали ионаNi2+и электронные пары атомов азота. Т.о., гибридизуются однаs-, две р-орбитали и одна 3d-орбиталь, тип гибридизации комплекса:dsp2, геометрия: плоский комплекс. Т.к. на 3d-орбиталях атома никеля нет неспаренных электронов, то комплекс диамагнитен.
525.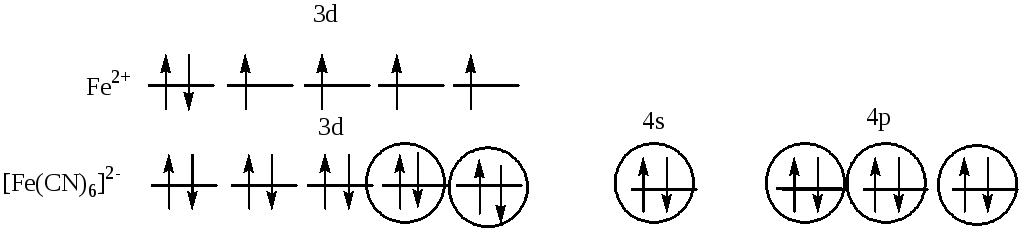 Взаимодействие
между центральным атомомFeи лигандами (CN) происходит
по донорно-акцепторному механизму. В
образовании гибридных облаков участвуют
вакантные3d-, 4s-
и 4p- орбитали ионаFe2+и электронные пары атомов азота. Т.о.,
гибридизуются однаs- ,три
р- и двеd- орбитали, тип
гибридизации комплекса:d2sp3,
геометрия: октаэдр. На 3d- орбиталях атома железа нет неспаренных
электронов, поэтому комплекс диамагнитен.
Взаимодействие
между центральным атомомFeи лигандами (CN) происходит
по донорно-акцепторному механизму. В
образовании гибридных облаков участвуют
вакантные3d-, 4s-
и 4p- орбитали ионаFe2+и электронные пары атомов азота. Т.о.,
гибридизуются однаs- ,три
р- и двеd- орбитали, тип
гибридизации комплекса:d2sp3,
геометрия: октаэдр. На 3d- орбиталях атома железа нет неспаренных
электронов, поэтому комплекс диамагнитен.
526.
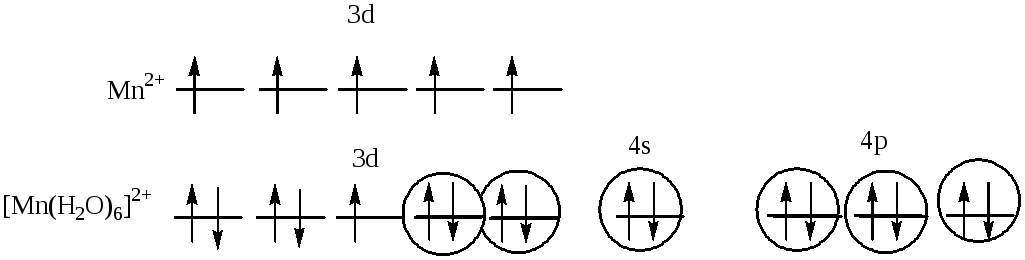
Взаимодействие между центральным атомом Mnи лигандами (Н2О) происходит по донорно-акцепторному механизму. В образовании гибридных облаков участвуют вакантные3d-, 4s- и 4p- орбитали ионаMn2+и электронные пары атомовкислорода. Т.о., гибридизуются однаs- ,три р- и двеd- орбитали, тип гибридизации комплекса:d2sp3, геометрия: октаэдр. На 3d- орбиталях атома марганца есть один неспаренный электрон, поэтому комплекс парамагнитен.
527.
528. Цветность комплексов объясняется наличием неспаренных электронов на расщепленных под действием лигандовd-орбиталях. Неспаренный электрон может возбуждаться под действием кванта света и переходить на свободную расщепленную орбиталь – соединение приобретает цветность.Так,
529. Сила лиганда в комплексе определяет его спин. Если лиганд слабого поля, как в случае с комплексом [CoF6]3-, то заполнение расщепленныхd-подуровней происходит по правилу Хунда, вкруговую. Если лиганд сильного поля, как в [Co(NH3)6]3+ , то расщепленные подуровни заполняются против правила, сначала низ, а за тем верх, и комплекс имеет низкий спин.
рисунок
530.В случае лиганда сильного поля, например СО,NH3, расщепленныеd-подуровни центрального атома заполняются против правила Хунда, сначала низ, а за тем верх. Это случай а). Например, [Fe(NH3)4]2-. В случае лиганда слабого поля, напримерF-,OH-, заполнение расщепленныхd-подуровней происходит по правилу Хунда, вкруговую. Это случай б). Например, [CoF6]3 .
4.1. Способы выражения концентрации растворов.
531.Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Массовая доля растворенного вещества - количество грамм растворенного вещества, содержащееся в 100 граммах раствора. Например, концентрация спирта 40% означает, что в 100 граммах водки содержится 40 грамм спирта. 1%-ный раствор иода означает, что 100 грамм раствора содержат 1 грамм иода.
|
Дано V(раствора)=10л. W%(KOH)= 40% ρ= 1.40 г.мл |
Найдем массу раствора: m=V*ρ= 10000*1.4 = 14000 г. В растворе должно содержаться: m(KOH) = 14000*40%/100% = 5600 грамм,m(H2O) = 14000 - 5600 = 8400 грамм. |
532.
|
Дано: m(раствора)=5 кг. W%(FeSO4)= 40% |
FeSO4*7H2O = FeSO4(раствор). 5 кг раствора с массовой долей FeSO4равной 1% содержится соли:m(FeSO4) = 5000*1%/100% = 50 грамм. n(FeSO4) = m/M = 50/152 = 0.33 моль = n(FeSO4*7H2O) m(FeSO4*7H2O) = n*M = 0.33*278 = 91.74 грамм. |
533.
|
Дано: V(раствора)=1 л W%(HCl)= 30% ρ= 1.15 г.мл |
Найдем массу раствора: m=V*ρ= 1000*1.15 = 1150 г. В растворе должно содержаться: m(HCl) = 1150*30%/100% = 345 грамм, m(H2O) = 1150 - 345 = 805 грамм. |
534. Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Молярная концентрация растворенного вещества - количество моль растворенного вещества, содержащееся в 1 литре раствора. Молярная концентрация эквивалента растворенного вещества - количество моль эквивалентов растворенного вещества, содержащееся в 1 литре раствора. Например, концентрация соли 1 моль/л или 1 моль-экв/л означает, что в 1 литре раствора содержится 1 моль или 1 моль эквивалентов соли.
|
Дано: V(H2SO4)=500 мл. m(H2SO4) = 196 г. |
n(H2SO4) = m/M = 196/98 = 2 моль nэ(H2SO4) = m/Mэ = 196/49 = 4 моль См(H2SO4) = n/V = 2/0.5 = 4 моль/л, Сн(H2SO4) = nэ/V = 4/0.5 = 8 моль-экв/л, |
535.
|
Дано: См(Al2(SO4)3)=0.1 моль/л V(раствора) = 2 литра |
m(Al2(SO4)3) = См*V*М = 0.1*2*342 = 68.4 г. Э(Al2(SO4)3) = 6, следовательно, Сэ = 6*См = 0.6 моль-экв/л |
536.
|
Дано: См(NH3) = 18 моль/л V(раствора) = 1 литр |
n(NH3) = См*V= 18*1 = 18 моль. V(NH3) =n*Vм = 36*22.4 = 806.4 литра. |
537.
|
Дано: а) Сэ(Na2CO3) = 0.25 н V(раствора) = 0.5 литра б) m(CuSO4) = 8 г. Cэ = 0.1н |
а) nэ(Na2CO3) = Сэ*V= 0.25*0.5 = 0.125 моль-экв. Мэ(Na2CO3) = 53 г/моль-экв.m(Na2CO3) =nэ*Мэ = 0.125*53 = 6.625 г. б) V=m/(Mэ*Cэ) = 8/(80*0.1) = 1 литр. |
538.Моляльность - количество моль растворенного вещества, приходящееся на 1 кг. растворителя.
|
Дано: m(глицерина) = 460 г. V(воды) = 5 л. |
n(глицерина) =m/M= 460/92 = 5 моль. Моляльность Сm(глицерина) =n/m(H2O) = 5 моль/5 кг = 1 моль/кг |
539.Способы выражения концентрации растворов: массовая, мольная и объемная доли, молярная концентрация, молярная концентрация эквивалентов, титр, моляльность. Титр - количество грамм растворенного вещества в 1 миллилитре раствора.
|
Дано: а) См(HCl) = 0.1 м б) Сэ(H2SO4) = 0.1 н в) w%(HNO3) = 31.5% p= 1.19 г/мл. |
а) Возьмем 1 литр раствора. n(HCl) = 0.1 моль.m(HCl) =n*M= 0.1*36.5 = 3.65 г. Т(HCl) =m/V= 3.65/1000 = 0.00365 г/мл. б) Возьмем 1 литр раствора. Поскольку эквивалент серной кислоты равен 2, то См(H2SO4) = 1/2Сэ(H2SO4) = 0.05 моль/л.n(H2SO4) = 0.05*1 = 0.05 моль.m(H2SO4) =n*M= 0.05*98 = 4.9 г. Т(H2SO4) =m/V= 4.9/1000 = 0.0049 г/мл в) Возьмем 1 литр раствора. Масса раствора равна V*p= 1000*1.19 = 1190 г.m(HNO3) = 1190*31.5%/100% = 374.85 г. Т(HNO3) = 374.85/1000 = 0.375 г/мл. |
541.
|
Дано: См(HNO3) = 4.65 м p= 1.15 г/мл. |
Возьмем 1 литр раствора. m(раствора) = 1000*1.15 = 1150 г. m(HNO3) = См*М(HNO3)*V= 4.65*63*1 = 292.95 г. w%(HNO3) = 292.95*100%/1150 = 25.5% |
542.
|
Дано: W%(KOH) = 26 % p= 1.24 г/мл. |
Возьмем 1 литр раствора. m(раствора) = 1000*1.24 = 1240 г. m(KOH) = 1240*26%/100% = 322.4 г. m(H2O) = 1240 - 322.4 = 917.6 г.
Моляльность Cm=n(КОH)/m(H2O) = 5.75/0.9176 = 6.27 моль/кг. Титр Т(КОН) = См*М/1000 = 5.75*56/1000 = 0.322 г/мл |
543.
|
Дано: w%(HNO3) = 36 % p= 1.22 г/мл. |
а) Возьмем 1 литр раствора. m(раствора) = 1000*1.22 = 1220 г. m(HNO3) = 1220*36%/100% = 439.2 г. m(H2O) = 1220-439.2 = 780.8 г. б)
в) Т.к. Э(HNO3) = 1, то Сэ = См = 7 моль-экв/л. г) Моляльность Cm=n(HNO3)/m(H2O) = 7/0.7808 = 8.9 моль/кг. д) Т = Сэ*Мэ/1000 = 7*63/1000 = 0.441 г/мл е) n(H2O) =m/M= 780.8/18 = 43.4 моль. Мольная
доля N=
|
544.
|
Дано: w%(H2SO4) = 11.6 % p= 1.08 г/мл. Мэ(H2SO4) = 49 г-экв/моль |
Возьмем 1 литр раствора. m(раствора) = 1000*1.08 = 1080 г. m(H2SO4) = 1220*11.6%/100% = 141.52 г.
|
545.
|
Дано: w%(NaOH) = 10 % m(раствора) = 1 кг. m(H2O) = 200 г. |
m(NaOH) =m(раствора)*w%(NaOH)/100% = 1000*10/100 = 100г. В растворе было 1000-100 = 900 грамм воды, а осталось 900-200 = 700 г. m(раствора) = 700+100 = 800 грамм. w%(NaOH) = 100*100%/800 = 12.5% |
546.
|
Дано: w%(соли) = 20 % m(раствора) = 400 г. m(вещества) = 50 г. |
m(соли) =m(раствора)*w%(соли)/100% =400*20/100 = 80 г. В растворе было 400-80 = 320 грамм воды. Осталось соли 80-50 = 30 г. m(раствора) = 320+30 = 350 гр. w%(NaOH) = 30*100%/350 = 8.57% |
547.
|
Дано: w%1(соли) = 30 % V(H2O) = 300 мл. w%2(соли) = 10 % |
Пусть масса соли, которую необходимо
добавить к воде равна х. Найдем массу
воды, приходящуюся на х грамм соли:
|
548.
|
Дано: V1(NaCl) = 500 мл w%1(NaCl) = 20 % p1 = 1.152 г/мл w%2(соли) = 4.5 % p2 = 1.029 г/мл |
А) Найдем массу сухой соли в исходном растворе: m1(раствора) =V1*p1 = 500*1.152 = 576 г. m(соли) = 576*20%/100% = 115.2 г. Б) Эта же масса соли содержится в конечном растворе: m2(раствора) =m(соли)*100%/w%2(соли) = 115.2*100/4.5 = 2560 г. V2(раствора) =m/p= 2560/1.029 = 2488 мл. |
549.
|
Дано: w%1(КOH) = 20% w%2(КOH) = 50% m(р-ра2) = 1 кг. w%3(КOН) = 25% m(р-ра1) = ? |
Выразим массу чистого гидроксида калия, содержащегося в каждом из растворов: m1(КОН) =m(р-ра1)*w%1(КОН)/100% = 0.2*m(р-ра1) m2(КОН) =m(р-ра2)*w%2(КОН)/100% = 0.5 кг. m3(КОН) =m(р-ра3)*w%3(КОН)/100% = 0.25*m(р-ра3) По смыслу задачи: m1(КОН) +m2(КОН) =m3(КОН) m(р-ра1)*0.2 + 0.5 = m(р-ра3)*0.25 m(р-ра1) + 1кг = m(р-ра3) m(р-ра1)*0.2 + 0.5 = (m(р-ра1)+1)*0.25 m(р-ра1) = 5 кг. |
550.
|
Дано: w%1(Сa(NO3)2) = 10% w%2(Сa(NO3)2) = 2% m(р-ра1) = 300 г. m(р-ра2) = 500 г. w%общ(Сa(NO3)2) = ? |
Найдем массу чистого Сa(NO3)2, в каждом из растворов: m1(Сa(NO3)2) = m(р-ра1)*w%1/100% = 300*10%/100% = 30 г. m2(Сa(NO3)2) = m(р-ра2)*w%2/100% = 500*25/100% = 10 г. w%общ(Сa(NO3)2)
=
|
551.
|
Дано: w%1(H2SO4) = 11.6% p1 = 1.08 г/мл См2 = 0.1 моль/л V2 = 250 мл. V1 = ?,V(Н2О) = ? |
Найдем массу чистой серной кислоты, содержащейся в 0.1м растворе: m(H2SO4) = См*V*М = 0.1*0.25*98 = 2.45 г. Эта же масса кислоты содержится в 11.6%-ном растворе: m(раствора) = 2.45*100%/11.6% = 21.12 г. V(р-ра) =m/p= 21.12/1.08 = 20 мл V(Н2О) = 250-20 = 230 мл. |
552.
|
Дано: w%1(HCl) = 20% p1 = 1.10 г/мл Сн2(HCl) = 0.1 моль/л V2 = 1 л. V1 = ?,V(Н2О) = ? |
Найдем массу чистой HCl, содержащейся в 0.1н растворе: m(HCl) = Сн*V*Мэ = 0.1*1*36.5 = 3.65 г. Эта же масса кислоты содержится в 20%-ном растворе: m(раствора) = 3.65*100%/20% = 18.25 г. V(р-ра) =m/p= 18.25/1.1 = 17 мл V(Н2О) = 1000-17 = 983 мл. |
553.
|
Дано: V(H2SO4) = 50 мл. Сн(H2SO4) = ? н V(щелочи) = 25 мл. Сн(щелочи) = 0.4 н |
Закон эквивалентов: Сн1*V1 = Сн2*V2
Cн(H2SO4)
=
|
554.
|
Дано: C(HCl) = 0.5н V(AgNO3) = 0.5л. Сн(AgNO3) = 0.2 н V(HCl) = ? |
Закон эквивалентов: Сн1*V1 = Сн2*V2
V(HCl)
=
|
555.
|
Дано: V(щелочи) = 20 мл. Т(щелочи) = 0.012 г/мл V(кислоты) = 24 мл. Сн(кислоты) = 0.25 н М(щелочи) = ? |
Закон эквивалентов: Сн1*V1 = Сн2*V2
Cн(щелочи)
=
|
556.
|
Дано: w%(H2SO4)=20% p= 1.10 г/мл m(Mg) = 24.3 г. V(H2SO4) = ? |
H2SO4 + Mg = MgSO4 + H2 n(Mg) =m/M= 24.3/24.3 = 1 моль. Согласно уравнению реакции, n(Mg) =n(H2SO4) = 1 моль. m(H2SO4) = n*M = 1*898 = 98 г. m(раствораH2SO4) = 98*100%/15% = 653.3 г. V(H2SO4) = m/p = 653.3/1.1 = 594 мл. |
557.
|
Дано: w%(K2СO3)=20% V(K2СO3)=650 мл p= 1.189 г/мл С(H2SO4) =2М V(H2SO4) = ? V(СO2) = ? |
H2SO4+K2СO3= К2SO4 + СО2 +H2О Найдем число моль K2СO3: m(раствора) =V*= 650*1/189 = 772.85 г. m(K2СO3)
=
n(K2СO3) =m/M= 154.57/138 = 1.12 моль. По уравнению рекции: n(K2СO3) =n(H2SO4) =n(СО2) V(H2SO4) = n/Cm = 1.12/2 = 560 мл. V(СО2) =n*Vm= 1.12*22.4 = 25 л. |
558.
|
Дано: w%(NH3)=23% p=0.916 г/мл С(HСl)=6МV(HCl) = 750мл V(NH3) = ? m(NH4Cl)= ? |
NH3+HCl=NH4Cl–образуется хлорид аммония n(HCl) =C*V= 6*0.75 = 4.5 моль. По уравнению реакции:n(HCl) =n(NH3) =n(NH4Cl). m(NH4Cl) =n*M= 4.5*53.5 = 240.75 г. m(NH3) =n*M= 4.5*17 = 76.5 г. m(раствораNH3) = V(NH3) =m(раствора)/= 332.6/0.916 = 363.1 мл.
|
559.
|
Дано: V(BaCl2) = 100 мл w% = 15% V(H2SO4)= 14.4 мл Cм, Сн, Т = ? |
H2SO4 + BaCl2 = BaSO4 + 2HCl Пусть плотность раствора BaCl2= 1. Найдемn(BaCl2) m(раствораBaCl2) =V*p= 100 г.m(BaCl2) = 100*15%/100% = 15 г. n(BaCl2) = m/M = 15/208 = 0.0721 моль. = n(H2SO4) Cм(H2SO4) = n/V = 0.0721/0.0144 = 5 моль/л Сн(H2SO4) = 2См = 10 моль/л. Мэ(H2SO4) = 49 г/моль. Т =
|
560.
|
Дано: V(BaCl2) = 100 мл w% = 20% p=1.203 г/мл m (BaSO4)= ? |
3BaCl2 + Cr2(SO4)3 = 3BaSO4 + 2CrCl3 Найдем число моль BaCl2: m(раствораBaCl2) =V*p= 100 * 1.203 = 120.3 г. m(BaCl2) = 120.3*20%/100% = 24.06 г. n(BaCl2) = m/M = 24.06 / 208 = 0.116 моль. n(BaSO4) = n(BaCl2) = 0.116 моль. m(BaSO4) = n*M = 0.116*233 = 26.9 г. |
4.2 Закономерности растворения
561.
|
Дано: m(NH4Cl) = 10 г. V(Н2О) = 233 мл. ∆T= -2.8oC Суд = 4.2 Дж/(г*К) |
n(NH4Cl) =m/M= 10*53.5 = 0.19 моль. Qраств(NH4OH) =m(раствора)*∆Т*Cуд = (10+233)*2.8*4.2 = -2.86 кДж ∆Hoраств=
|
562.
|
Дано: m(NaOH) = 10 г. V(Н2О) = 250 мл. ∆Hoраств(NaOH) = ?. ∆Т = 6.7оС Суд = 4.2 Дж/(г*К) |
n(NaOH) = m/M = 10*40 = 0.25 моль. Qраств(NaOH) =m(раствора)*∆Т*Cуд = (10+250)*6.7*4.2 = 7.32 кДж ∆Hoраств=
|
563.
|
Дано: m(CaCl2) = 10 г. Q= 6.82 кДж m(CaCl2*6H2O) = 10г. Q= -0.87 кДж ∆Hoгидр(СaCl2) = ? |
n(CaCl2) = m/M = 10/111 = 0.09 моль. ∆Hoраств(CaCl2) = -Q/n = -6.82/0.09 = -75.7 кДж/моль n(CaCl2*6Н2О) =m/M= 10/219 = 0.046 моль. ∆Hoраств(CaCl2*6Н2О) = -Q/n= 0.87/0.046 = 19.05 кДж/моль ∆Hoгидр(СaCl2) = ∆Hoраств(CaCl2) - ∆Hoраств(CaCl2*6Н2О) = -94.75 кДж/моль |
564.
|
Дано: ∆Hoраств(CuSO4*5H2O)=11.72 кДж/моль. V(Н2О) = 0.2 литра. ∆Т = 2оС Суд = 4.2 Дж/(г*К) m(CuSO4) = 4 г. |
n(CuSO4) = m/M = 4/160 = 0.025 моль Q=m(раствора)*∆Т*Cуд = (200+4)*2*4.2 = 1.71 кДж ∆Hoраств(CuSO4) = -Q/n= – 1.71/0.025 = -68.5 кДж/моль ∆Hoгидр(СuSO4) = ∆Hoраств(CuSO4) - ∆Hoраств(CuSO4*5Н2О) = -68.5 – 11.72 = -80.22 кДж/моль |
565.
|
Дано: ∆Hoрастворения(NH4NO3)=26.32 кДж/моль. V(Н2О) = 0.2 литра. ∆Т = 5оС Суд = 3.77 Дж/(г*К) m(NH4NO3) = ? |
Qраств(NH4NO3) = m(H2O)*∆Т*Cуд = 200*5*3.77 = 3.77 кДж n
=
m(NH4NO3) = n*M = 0.14*80 = 11.46 грамм. |
566.
|
Дано: m(H2O) = 25 г m(NaCl) = 8,75 г S - ? |
Решение: 8,75 г NaCl– 25 г Н2О х г NaCl- 100 г Н2О х = 8,75*100/25 = 35 г NaCl/100г Н2О |
567.
|
Дано: V(Н2О) = 50 мл. n(Zn(NO3)2) = 0.003 моль |
m(Zn(NO3)2) = n*M = 0.003*189 = 0.567 г. Растворимость
S=
|
568.
|
Дано: (K2Cr2O7) = 45.2%. S - ? |
Возьмем 100 г раствора: m(K2Cr2O7) = 45.2 г,m(H2O) = 100 –45.2 = 54.8 г. Растворимость
S=
|
569.
|
Дано: S(KNO3) = 31.6 г/100 г - ? |
Возьмем раствор, в котором m(KNO3) = 31.6 г, тогдаm(H2O)=100 г. (KNO3)
=
|
570.
|
Дано: S(KNO3) = 55 г/100 г m(р-ра) = 60 г. m(KNO3) - ? |
(KNO3)
=
В 60 г раствора : m(KNO3) = (60*35.5) / 100 = 21.3 г. |
571.
|
Дано: S1(K2CO3)= 155 г/100г S2(K2CO3)= 111 г/100г m(раствора) = 770 г. |
Найдем,
сколько грамм соли содержится в 770
граммах раствора при 100оС.m1(K2CO3)
= Т.е. при охлаждении из раствора выделится 468 – 335 = 133 гр. соли. |
572.
|
Дано: S1(Pb(NO3)2)= 90 г/100г S2(Pb(NO3)2)= 46 г/100г V(H2O) = 200 мл T = 200C |
При 60оС в 200г воды растворяетсяm1(Pb(NO3)2) = 90*200/100 = 180г При 0оС в 200г воды растворяетсяm1(Pb(NO3)2) = 46*200/100 = 92 г. В осадок выпадет m1-m2 = 180 – 192 = 92 грамма соли. |
573.
|
Дано: Т1 = 100оС, Т2 = 20оС S1(NaNO3) = 176 г/100г S2(NaNO3) = 88 г/100г m(NaNO3) = 120 г. |
Найдем массовую долю соли в растворе при обеих температурах: w1% = 176*100%/(176+100) = 63,8%;w2% = 88*100%/(88+100) = 46,8% Пусть m1(р-ра) = х,m2(р-ра) = у,m1(NaNO3) =z,m2(NaNO3) =k. По условию: х-у = 120, z-k= 120 грамм. x = z*100%/w1% = z*1.57, y = k*100%/w2% = k*2.14. Получаем систему уравнений:z*1.57 – k*2.14 = 120 и z-k =120. Решая ее, получаем х = 357,4 грамм; z= 228 грамм. |
574.
|
Дано: S(H2S) = 2.91 P= 101325 Па T= 200C W%(CO2) = ? |
В одном литре воды растворяется 2.91 литра H2S. m(H2O) = 1000 г. n(H2S) = V/Vм = 2.91/22.4 = 0.13 моль m(H2S) = n*M = 0.13*34 = 4.42 г. w%(H2S)
= |
575.
|
Дано: S(CO2) = 0.878 P = ? W%(CO2) = 1 % |
В одном литре воды растворяется 0.878 литр диоксида углерода. m(H2O) = 1000 г. n(CO2) = V/Vм = 2.91/22.4 = 0.13 моль m(CO2) = n*M = 0.13*44 = 5.72 г. |
576.
|
Дано: W%(C12H22O11) = 10% Т = 100оС Ро= 101.3*105Па Р’ = ? |
Ро-
Р’ = Ро Возьмем 1 кг раствора. m(C12H22O11) = 100 г. n(C12H22O11) =m/M= 100/342 = 0.292 моль m(H2O) = 1000-100 = 900 г. n(H2O) = 900/18 = 50 моль. 101.3*105- Р’ = 101.3*105 |
577.
|
Дано: Р0= 8199.325 Па V(H2O) = 540 мл m(C6H12O6) = 1 г. P’ = ? |
Po - P’ = P0*N(C6H12O6) n(H2O) =m/M= 540/18 = 30 моль. n(С6H12O6) =m/M= 36/180 = 0.2 моль. 8199.325 - P’
= 8199.325* |
578.
|
Дано: Р0= 23939.35 Па P’ = 21854.4 Па m(ацетона) = 200 г.m(неэлект.)=10.5 г. М = ? |
Po - P’ = P0*N2 n(ацетона) =m/M= 200/58 = 3.45 моль. . 23939.35 –
21854.4 = 23939.35* |
579.
|
Дано: Р0= 47375 Па P’ = 33310 Па n(в-ва) = 1 n(H2O) = ? |
Po-P’ =P0*N(вещества)
=> 47375 - 33310 = 47375* 1+n(H2O) = 3.37 =>n(H2O) = 2.37 моль.
|
580.
|
Дано: (С2Н5ОН)=25% Тзам-? |
КН2О*См, где См-моляльность р-ра или моль в-ва на 1кг растворителя. КН2О = 1,86. Возьмем 100 грамм раствора, тогда масса этанола будет 0,25*100 = 25 г, а количество в-ва его n=m/M= 25/46 = 0,54 моль. Масса воды тогда будет 100-25 = 75 грамм. Тогда См =n(C2H5OH)/M(H2O) = 0,543/75*10-3 = 7,25 моль/кг. Тзам = 1,86*7,25 = 13,480. Тзам = -13,480С |
581.
|
Дано: W%(C6H12O6) = 10% Т(кип) = ? |
ΔТ(кип) = Е(Н2О)*Сm, где Сm- моляльная концентрация. Найдем моляльность раствора глюкозы: возьмем 100 грамм раствора m(C6H12O6) = 10 г.n(C6H12O6) =m/M= 10/180 = 0.056 моль m(H2O) = 100-10 = 90 г. Сm=n(C6H12O6)/m(H2O) = 0.056/0.090 = 0.62 моль/кг. ΔТ(кип) = Е(Н2О)*Сm= 0.52*0.62 = 0.320. Т(кип) = 100.32 0С |
582.
|
Дано: m(x) = 1.6 г. V(H2O) = 250 мл. Т(зам) = -0.2 оС М(х) = ? |
ΔТ(зам) =
К(Н2О)*Сm= 0.2 = 1.86* |
583.
|
Дано: m(x) = 27 г. V(H2O) = 1000 мл. Т(кип) = 100.78 оС М(х) = ? |
ΔТ(кип) =
Е(Н2О)*Сm= 0.78 = 0.52* |
584.
|
Дано: m(Ix) = 9.2 г. m(CH3OH) = 100 г. То(кип) = 64.7оС Т’(кип) = 65 оС М(Iх) = ? Е(CН3ОH) = 0.84 |
Необходимо найти молярную массу иода, растворенного в метаноле ΔТ(кип) =
Е(CН3ОH)*Сm= 65 - 64.7 =
0.84* Молекула иода состоит из 257.6/127 = 2 атомов. |
585.
|
Дано: m(Sx) = 0.81 г. m(C6H6) = 100 г. ΔТ(кип) = 0.081 оС М(Sх) = ? Е(C6H6) = 2.57 |
Необходимо найти молярную массу серы, растворенной в бензоле ΔТ(кип) =
Е(C6H6)*Сm= 0.081 = 2.57* Молекула серы состоит из 257/32 = 8 атомов. |
586.
|
Дано: V(H2O) = 30 л. V(C3H5(OH)3) = 9 л. Т(зам) = ? p(глицерина) = 1,261 г/мл |
ΔТ(зам)=К(Н2О)*Сm= Масса глицерина равна m=V*p= 9000*1.261 = 11349 г. ΔТ(зам) =
1.86* |
587.
|
Дано: Т(зам) = -150С m(C2H4(OH)2)= ?
|
ΔТ(зам)=К(Н2О)*Сm= Сm= m(этил.гл.) = Сm* М(этил.гл.) *m(H2O) = 8.06*62*1 = 499.7 г = 0.5 кг. |
588.
|
Дано: Pосм= ? w%(сахара) = 4 % Т = 20оС = 293 К p= 1.014 г/мл |
Pосм= См*R*T Возьмем 1 литр раствора и найдем См сахара: m(раствора) =V*p= 1000*1.014 = 1014 г.m(сахара) = 1014*4%/100% = 40.56 г. См(сахара) = m/(M*V) = 40.56/(342*1) = 0.12 моль/л Росм= 0.12*8.31*293 = 288.8 кПа, Росм= 0.12*0.082*293 = 2.85 атм. |
589.
|
Дано: V(H2O) = 1 л. Pосм= 607950 Па m(глюкозы) = 45 г. Т = ? |
Pосм= См*R*T=
|
590.
|
Дано: W%(C) = 39.56 % W%(H) = 7.69 % W%(O) = 52.75 % V(H2O) = 1 л. Pосм= 9.00*105Па m(маннита) = 72 г. Т = 00С = 273 К |
Pосм= См*R*T=
М(маннита) = 181 г/моль Возьмем 1 моль маннита. Масса одного моль маннита 181 грамм. В них содержится: m(C) = 39.56%*181/100% = 72 г.n(С) =m/M= 72/12 = 6 моль m(Н) = 7.69%*181/100% = 14 г.n(Н) =m/M= 14/1 = 14 моль m(О) = 52.75%*181/100% = 96 г.n(О) =m/M= 96/16 = 6 моль Формула маннита: С6Н14О6 |
4.3 Растворы электролитов
591.Электролитами называются вещества, диссоциирующие в растворе. Согласно теории электролитической диссоциации, кислоты- вещества, которые при диссоциации дают катионы водорода. Основания при диссоциации дают ОН-группы. Соли диссоциируют на катион и анион кислотного остатка. Кислые и основные соли называют промежуточными соединениями, т.к. они являются продуктами неполной реакции нейтрализации.
592. Возможность электролитической диссоциации определяется природой вещества (сильный или слабый электролит), природой растворителя, температурой и т.п. Ионизирующую силу растворителя характеризует диэлектрическая проницаемость: вода – 81.0, спирт – 25.8, бензол – 2.23, фтороводород – 32.3. ДиссоциацияNaCl:
|
NaCl+H2O= |
593. В воде хлорид натрия диссоциирует на ионы практически полностью, а спирт практически не диссоциирует. Т.к. ионы, образующиеся при диссоциации, проводят электрический ток, то растворNaClпроводит электрический ток, а растворCH3CH2OHне проводит.
594. Для количественной характеристики электролитической диссоциации применяются константа диссоциации (Кд) и степень диссоциации (а). Кд – отношение произведения концентраций продуктов к произведению концентраций исходных веществ. а – отношение количества диссоциированных молекул к исходному количеству молекул. Постоянной величиной при различных концентрациях является Кд.
595. По величине электролитической диссоциации электролиты делятся на: сильные (Кд >>1), средние (1> Кд > 10-2) и слабые (Кд << 1). К первым относитсяHNO3(Кд = 43.6 ):HNO3 =H+ +NO3- . Ко вторым –HIO4(Кд = 2/3*10-2):HIO4 =H++IO4-. К слабым электролитам относятNH4OH(Кд = 1.76*10-5):NH4OH=NH4+ +OH-.
596.
|
K2SO4↔ K+ + KSO4-1
KSO4-1 ↔ K+ + SO4-2 |
K1
=
K2=
|
|
Ca(OH)2 ↔ Ca2+ + 2OH - |
K
=
|
|
H3PO4 ↔ 3H+ + PO43- |
K
=
|
|
KHCO3 ↔ K+ + H+ + CO32- |
K
=
|
|
3H+ + AlO3-3↔Al(OH)3 ↔ Al3+ + 3OH- |
K
=
|
|
Fe(OH)Cl2 ↔ Fe2+ + OH - + 2Cl - |
K
=
|
597.
|
Ba(OH)2 ↔ Ba+2 + 2OH- |
K =
|
|
H3AsO4 ↔ 3H+ + AsO4-3 |
K
=
|
|
KHSO4 ↔ K+ + HSO4 –
HSO4 – ↔ H+ + SO4 –2 |
K
1=
K
2=
|
|
Fe(OH)2Cl ↔ Fe3+ + 2OH- + Cl- |
K
=
|
|
2H+ + ZnO22-↔Zn(OH)2 ↔ Zn2+ + 2OH- |
K
=
|
598.
|
Сa(NO3)2 ↔ Ca+2 + 2NO3- |
K =
|
|
Sr(OH)2 ↔ Sr+2 + 2OH- |
K =
|
|
NaH2PO4 ↔ Na+ + H2PO4 –
H2PO4 – ↔ 2H+ + PO4 –3 |
K
1=
K
2=
|
|
2H+ + BeO22-↔Be(OH)2 ↔ Be+2 + 2OH- |
K =
|
|
AlOH(NO3)2 ↔ Al3+ + OH- + 2NO3- |
K
=
|
599.
|
K2Cr2O7 ↔ 2K+ + Cr2O72- |
K =
|
|
H2SeO3 ↔ 2H+ + SeO32- |
K
=
|
|
NaHS ↔ Na+ + HS-
HS- = H+ + S2- |
K1
=
K2
=
|
|
Al(OH)2NO3 ↔ Al3+ + 2OH- + NO3- |
K
=
|
|
2H+ + SnO22-↔Sn(OH)2 ↔ Sn2+ + 2OH- |
K
=
|
600.
|
LiOH ↔ Li+ + OH- |
K =
|
|
H2S ↔ H+ + HS-
HS- ↔ H+ + S2- |
K1
=
K2
= |
|
K2HPO4 ↔ 2K+ + H+ + PO43- |
K
=
|
|
Cr(OH)2Cl ↔ Cr3+ + 2OH- + Cl- |
K
=
|
|
4H+ + SnO44-↔Sn(OH)4 ↔ Sn4+ + 4OH- |
K=
|
601. Тип диссоциации гидроксида зависит от соотношения энергии связи металл-кислород и кислород-водород. ВNaOHрадиус атома натрия относительно большой, поэтому энергия связиNa-OнижеO-Hи он диссоциирует по типу основанияNa-O-H=Na++OH-; ВHNO3радиус атома азота относительно небольшой, поэтому энергия связиN-OвышеO-Hи он диссоциирует по типу кислотыH-O-NO2=H++NO3- ; ВZn(OH)2радиус атома цинка средний между азотом и натрием, поэтому энергии связиZn-OиO-Hпримерно равны, в результате соединение диссоциирует и по типу кислоты и по типу основанияZn2++ 2OH-=Zn(OH)2= 2H++ZnO22-. В сильно кислой среде азотная кислота способна проявлять основные свойства:H-O-NO2= ОH-+NO2+.
602. Сила кислоты определяется константой ее диссоциации. Чем сильнее диссоциирует кислота, тем сильнее кислота. Чем слабее связь атома водорода с атомом кислорода в молекуле кислоты, тем сильнее кислота. Чем выше степень окисления центрального атома в однотипных кислотах, тем сильнее кислота. Чем больше атомов кислорода, связанных только с центральным атомом приходится на атомы водорода, тем сильнее кислота.
|
А) HNO2–HNO3 |
Сила HNO3выше, т.к. степень окисления азота в ней +5, а вHNO2cтепень окисления азота +3 |
|
Б) H2SO4 – H2SeO4 |
Радиус атома Seбольше радиуса атомаS, поэтому связь Н-О в серной кислоте слабее связи Н-О в селеновой кислоте, т.е. серная кислота сильнее селеновой. |
|
В) HPO3–H3PO4 |
Т.к. в HPO3количество атомов кислорода, связанных только с центральным атомом, приходящихся на атомы водорода, больше, чем вH3PO4, то сильнееHPO3. |
603.Сила кислоты определяется константой ее диссоциации. Чем сильнее диссоциирует кислота, тем сильнее кислота.
|
А) HF – HCl – HBr – HI |
В данном ряду сила кислот увеличивается от HFкHI, т.к. с ростом радиуса атома галогена связь галоген–водород ослабевает и кислота легче диссоциирует:HCl=H++Cl- |
|
Б) HClO4 – HClO3 – HClO2 – HClO |
Согласно правилу, чем больше атомов кислорода, связанных только с центральным атомом приходится на атомы водорода, тем сильнее кислота. Поэтому в данном ряду сила кислот уменьшается. HClO = H+ + ClO- |
|
В) HClO – HBrO – HIO |
С ростом радиуса атомов галогенов от ClкIослабевает связь галоген-кислород, т.е. увеличивается константа диссоциации по основному типу. Следовательно, сила кислот уменьшается.HBrO = H+ + BrO- |
|
Г) HPO3 – H4P2O7 – H3PO4 |
Как и в случае (б), в данном ряду количество атомов кислорода, связанных только с центральным атомом слева направо уменьшается, следовательно уменьшается сила кислот. H3PO4 = 3H+ + РО43- |
604. Чем слабее связь Ме—ОН в основании, тем выше сила основания. Т.е., чем больше радиус атома металла, чем меньше степень окисления металла, чем меньше поляризующая способность катиона металла, тем сильнее соответствующее основание. Т.о., в рядуLiOH-…-CsOHсила оснований увеличивается (растет радиус металла),Fe(OH)2сильнее, чемFe(OH)3(степень окисления железа +2 и +3),Ca(OH)2сильнее, чемZn(OH)2(поляризующая способность кальция меньше, чем цинка).
605.
![]() ,поскольку величина константы
диссоциации небольшая, то степенью
диссоциации - а по сравнению с 1 в
знаменателе можно пренебречь, тогда
,поскольку величина константы
диссоциации небольшая, то степенью
диссоциации - а по сравнению с 1 в
знаменателе можно пренебречь, тогда![]() =
2.2*10-5.
=
2.2*10-5.
606.
|
Дано: 1= 0.42 %, С1= 1М 2= 1.33 %, С2= 0.1М 3= 4.22%, С3= 0.01М Кд- ? |
С увеличением разбавления возрастает степень диссоциации, а константа диссоциации остается неизменной, т.е. она не зависит от концентрации раствора. |
607.
|
Дано: = 0.1 % См= 1М. Кд- ? |
|
608.
|
Дано: Кд1 = 1.3*10-2 Кд2 = 0.6*10-7 См= 0.1м |
А)H2S=H++HS-
См(HS-) = α1*См(H2S) = 0.3*0.1 = 0.03 моль/л Б) HS-=H++S2-
= |
609.
|
Дано: Кд = 1.8*10-5 См1 = 0.1 м См2 = 0.001 м |
Закон
Оствальда: Б) 1.8*10-5= |
610. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита.
|
Дано: Cm(KCl) = 1моль/кг Т(зам) = -3.360С i,a(каж) = ? |
a(каж) = (i-1)/(m-1) = (1.8-1)/(2-1) = 0.8 = 80% |
611. В
растворе сильные электролиты диссоциируют
нацело, образуя ионы. Т.к. молекулы воды
полярны, то они окружают ионы электролита,
что приводит к кажущемуся уменьшению
концентрации и степени диссоциации
электролита. Т.к. раствор глюкозы См =
0.44м изотоничен растворуNaClСн = 0.25м, то изотонический коэффициентi= 0.44/0.25 = 1.76. Степень
диссоциации![]() ,
гдеm– число ионов, на
которые диссоциирует электролит.
,
гдеm– число ионов, на
которые диссоциирует электролит.
612. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита.
|
Дано: m(NH4Cl) = 1.07 г V(H2O) = 200 мл. Т(кип) = 100.09 0С a(каж) = ? |
0.09 = i*0.52*0.1 =>i= 1.73 a(каж) = (i-1)/(m-1) = (1.73-1)/(2-1) = 0.73 = 73%, гдеm– количество ионов, на которые диссоциирует электролит. |
613. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита.
|
Дано: Р0= 101.3 кПа V(H2O) = 450 мл n(Na2SO4) = 0.05моль P’ = 100.8 кПа a(каж) = ? |
Po - P’ = i*P0*N(Na2SO4) n(H2O) =m/M= 450/18 = 25 моль. 101.3 – 100.8 =
101.3*i* a(каж) = (i-1)/(m-1) = (2.47-1)/(3-1) = 0.73 = 73 %, гдеm– количество ионов, на которые диссоциирует электролит. |
614.
|
Дано: Cм(Х) = 0.04моль/л Т = 00С = 273 К Pосм= 217.8 кПа А = 70% m= ? |
Pосм=iСм(Х)*R*T= i*0.04*8.31*273 = 217.8 кПа i= 2.4 Степень диссоциации а = (i-1)/(m-1) = 0.70, следовательно,m= 3. Вещество диссоциирует на три иона. Примеры электролитов: CaCl2,H2SO4и т.д. |
615. Теоретическиi=2,=100 %, Тзам.= -3.720 С, практически Тзам.= -3.360 С,m= 1моль/кг.
В растворе KClдиссоциирует на ионы:KCl=K++Cl-. Полярные молекулы воды окружают эти ионы, что приводит к кажущемуся изменению концентрации.(практич.) = (3.36/3.72)*100% = 90%. i=1 + (-1)* = 1+(2-1)*0.9 = 1.9
616.
|
Na2[Sn(OH)6] = 2Na+ + [Sn(OH)6]2- |
Кд
=
|
Кн
= |
|
[Cr(NH3)6](NO3)3 = [Cr(NH3)6]3+ + 3NO3- |
Кд
=
|
Кн
= |
617.
|
K2[NiCl4] = 2K+ + [NiCl4]2- |
Кд
=
|
Кн
= |
|
[PtF2(NH3)4](NO3)2 = [PtF2(NH3)4]2+ + 2NO3- |
Кд
=
|
Кн
= |
618.
|
(NH4)2[RuCl6] = 2NH4+ + [RuCl6]2- |
Кд
=
|
Кн
= |
|
[Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- |
Кд
=
|
Кн
= |
619.
|
Na2[Ni(CN)4] = 2Na+ + [Ni(CN)4]2- |
Кд
=
|
Кн
= |
|
[PtCl2(NH3)4]SO4 = [PtCl2(NH3)4]2+ + SO42- |
Кд
=
|
Кн
= |
620.
|
K3[CoF6] = 3K+ + [CoF6]3- |
Кд
=
|
Кн
= |
|
[Fe(NH3)6](NO3)2 = [Fe(NH3)6]2+ + 2NO3- |
Кд =
|
Кн = |
4.4 Равновесие и обменные реакции в растворах электролитов
621. Ионное
произведение воды - это тривиальное
название константы диссоциации воды:![]() (при
220С). Константа диссоциации по
определению не зависит от концентрации
веществ, входящих в реакцию - ионное
произведение воды не зависит от количества
добавленной щелочи или кислоты.
(при
220С). Константа диссоциации по
определению не зависит от концентрации
веществ, входящих в реакцию - ионное
произведение воды не зависит от количества
добавленной щелочи или кислоты.
622. Водородный (рН) и гидроксильный (рОН) показатели вычисляются через логарифмы концентраций соответствующих ионов:pH= -lg[H+],pOH= -lg[OH-].
|
Среда |
Кислая |
Щелочная |
Нейтральная |
|
[H+] |
<10-7 |
=10-7 |
>10-7 |
|
рН |
<7 |
=7 |
>7 |
|
рОН |
>7 |
=7 |
<7 |
623. рН = -lg[H+], рН = 14 – рОН.
|
[H+] |
10-4 |
10-11 |
4*10-6 |
1.78*10-7 |
4.92*10-3 |
|
pН |
4 |
11 |
5.4 |
6.7 |
2.3 |
|
pOH |
10 |
3 |
8.6 |
7.3 |
11.7 |
624. рН = 14 – рОН. рН = -lg[H+], [H+]*[OH-] = 10-14
|
pН |
3.2 |
5.8 |
9.1 |
11.4 |
|
[H+] |
6.3*10-4 |
1.6*10-6 |
7.9*10-10 |
4.0*10-12 |
|
[OH-] |
1.6*10-11 |
6.3*10-9 |
1.3*10-5 |
2.5*10-3 |
625.
|
Дано: m(NaIOH) = 2 г. V(раствора)= 1л. pH,pOH- ? |
См(NaOH) =m/(M*V) = 2/(40*1) = 0.05 моль/л рОН = -lg[OH-] = -lg0.05 = 1.3 pH = 14 – pOH = 14 – 1.3 = 12.7 |
626. Степнь диссоциации азотной кислоты (a) составляет 82 %, следовательно [H+] =a*Cм = 0.82*1 = 0.82 моль/л. рН = -lg[H+] = -lg[0.82] = 0.086. рОН = 14 – рН = 13.914.
627. СН3СООН
= СН3СОО- + Н+ .Кд= 1.754*10-5 , С(СН3СООН) = 0.1 моль/л,
[H+] = [CH3COO-]
= х,
![]() ,х2 = 1.754*10-6 , х = [H+]
= 1.32*10-3 моль/л.
,х2 = 1.754*10-6 , х = [H+]
= 1.32*10-3 моль/л.
рН = -lg[H+], pH = -lg1.32*10-3 = 2.9, pOH = 14 – pH = 14 – 2.9 = 11.1
628.
|
Дано: V(NH3) = 2.24 л V(H2O) = 1 л. pH,pOH- ? |
Количество аммиака n(NH3) =V/Vм = 2.24/22.4 = 0.1 моль, следовательно, концентрация См(NH3) =n/V= 0.1/1 = 0.1 моль/л. Найдем
концентрацию ОН-групп в растворе:
степень диссоциации аммиака равна
|
629.
|
Дано: V(HNO3) = 1 л Cм(HNO3) = 1м m(NaOH) = 38 г. рH - ? |
HNO3 + NaOH = NaNO3 + H2O Определим количества обоих соединений: n(NaOH) = m/M =38/40 = 0.95 моль. n(HNO3) = Cм*V = 1 моль. В растворе останется 1 – 0.95 = 0.05 моль азотной кислоты, т.е. [H+] = 0.05 моль.pH= -lg[H+] = 1.3 |
630.
|
Индикатор |
Окраска |
В среде |
рH, при котором Изменяется окраска |
|
|
Кислой |
Щелочной |
|
|
Лакмус |
Красный |
Синий |
6,0-7,0 |
|
Фенолфталеин |
Бесцветный |
Малиновый |
8,0-10,0 |
|
Метиловый оранжевый |
Желтый |
Красный |
3,1-4,4 |
631. ПР рассчитывается, как произведение растворимостей ионов, где растворимость – концентрация вещества в его насыщенном растворе. Зная растворимость, можно рассчитать ПР, и наоборот. Трифосфат серебра диссоциирует:Ag3PO4= 3Ag++PO4-3, тогда
S 3*3.8*10-5 3.8*10-5, n(AgNO3) = m/M = 6.5*10-3 / 170 = 3.8*10-5 моль/л.
Тогда ПР будет S3(Ag+)*S(PO4-3) =1.3*10 –20 .
632. ПР рассчитывается, как произведение растворимостей ионов, где растворимость – концентрация вещества в его насыщенном растворе. Зная растворимость, можно рассчитать ПР, и наоборот. Иодид свинца диссоциируетPbI2=Pb2++ 2I-, тогда
S 6,5*10-4 2*6,5*10-4,
Тогда ПР будет S(Pb2+)*S2(I-) = 8,45*10-7
633. Ag2CO3 = 2Ag+ + CO32-
ПР(Ag2CO3)
= 6.15*10-12.
ПР(Ag2CO3)
= [Ag+]2*[CO32-]
= (2S)2*S
= 4S3.
S- растворимость.![]() =
1.15*10-4моль/л. Коэффициент
растворимости выражается в граммах
вещества, растворяющегося в 100 граммах
воды. В одном литре воды растворяется
1.15*10-4моль соли, следовательно, в
100 граммах растворитсяS= 1.15*10-4*М(Ag2CO3)/10
= 1.15*10-4*276/10 = 0.003 г/100г.
=
1.15*10-4моль/л. Коэффициент
растворимости выражается в граммах
вещества, растворяющегося в 100 граммах
воды. В одном литре воды растворяется
1.15*10-4моль соли, следовательно, в
100 граммах растворитсяS= 1.15*10-4*М(Ag2CO3)/10
= 1.15*10-4*276/10 = 0.003 г/100г.
634. Zn(OH)2 = Zn2+ + 2OH-
ПР(Zn(OH)2)
= 4.0*10-16.
ПР(Zn(OH)2)
= [Zn2+]*[OH-]2
= S*(2S)2
= 4S3.
S- растворимость.![]() =
4.64*10-6
моль/л.
[Zn2+]
= S = 4.64*10-6
моль/л,
[OH-]=
2S = 2*4.64*10-6
= 9.28*10-6
моль/л.
=
4.64*10-6
моль/л.
[Zn2+]
= S = 4.64*10-6
моль/л,
[OH-]=
2S = 2*4.64*10-6
= 9.28*10-6
моль/л.
635.
|
Дано: ПР(FeS) = 3.7*10-19 m(FeS) = 1г. V(H2O) = ? |
Найдем
растворимость (S)данной
соли: ПР(FeS) = [Fe2+]*[S2-]
=S2, следовательно,S= V(H2O) = n/S = 0.011/6.08*10-10 = 1.7*107 литров |
636.
|
Дано: ПР(AgBr)=6.3*10-13 m(AgBr) = 1г. V(H2O) = ? |
Найдем
растворимость (S)данной
соли: ПР(AgBr) = [Ag+]*[Br
-] =S2,
следовательно,S= V(H2O) = n/S = 5.3*10-3 / 7.94*10-7 = 6.7*103 литров |
637.
|
Дано: ПР(MgS) = 2*10-15 Cн(Mg(NO3)2) = 4*10-3 н Cн(Na2S) = 6*10-4н
|
ПР = [Mg2+]*[S2-] При смешивании двух растворов одинакового объема их концентрация уменьшается в два раза: [Mg2+] = ½Cн(Mg(NO3)2) = 1/4Cм(Mg(NO3)2) = 1/4*0.0004 = 0.0001 моль/л [S2-] = 1/2Cн(Na2S) = 1/4Cн(Na2S) = 1/4*6*10-4 = 1.5 *10-4 моль/л [Mg2+]*[S2-] = 0.0001*0.00015 = 1.5*10-8< ПР, следовательно, осадок не выпадет. |
638.
|
Дано: Cм(Cd(NO3)2) = 10-3 м Cм(Na2CO3) = 0.1 м ПР(CdCO3) = 2.5*10-14 |
ПР = [Cd2+]*[CO32-] При смешивании двух растворов одинакового объема их концентрация уменьшается в два раза: [Cd2+] = Cм(Cd(NO3)2) = ½*0.001 = 0.0005 моль/л [CO32-] = Cм(Na2CO3) = ½*0.1 = 0.05 моль/л [Cd2+]*[CO32-] = 0.0005*0.05 = 2.5*10-5>> ПР, следовательно, осадок выпадет. |
639.
|
Дано: ПР(BaCO3) = 7*10-9 ПР(PbCO3) = 1.5*10-13 [Ba2+] / [Pb2+] = ? |
XCO3 = X2+ + CO32- , ПР = [X2+]*[CO32-]
[Ba2+]/[Pb2+] = ПР(BaCO3)/ПР(PbCO3) = 7*10-9/1.5*10-13 = 4.6*104 |
640.
|
Дано: ПР(BaCrO4) = 2.3*10-10 ПР(SrCrO4) = 3.6*10-5 [Ba2+] = 5*10-4моль/л [Sr2+] = 5*10-1 моль/л |
XCO3 = X2+ + CO32- ПР = [X2+]*[CrO42-], [CrO42-] = ПР/[X2+] Найдем концентрацию CrO42-- ионов, необходимую для выпадения осадков: а) [CrO42-] = ПР(BaCrO4)/[Ba2+] = 2.3*10-10/5*10-4= 4.6*10-7 моль/л б) [CrO42-] = ПР(SrCrO4)/[Sr2+] = 3.6*10-5/5*10-1= 7.2*10-5 моль/л Поскольку для выпадения осадка SrCrO4требуется меньшая концентрацияCrO42-, то он выпадет первым |
641.
|
А) Na2S + 2HCl = 2NaCl + H2S S2-+ 2H+=H2S– бесцветный газ |
В) Sn(OH)4 + 2H2SO4 = Sn(SO4)2 + 4H2O Sn(OH)4 + 4H+ = Sn2+ + 4H2O |
|
Б) Pb(NO3)2 + 2NaI = PbI2 + 2NaNO3 Pb2++ 2I-=PbI2– желтый осадок |
Г) Sn(OH)4 + 2KOH = K2[Sn(OH)6] Sn(OH)4 + 2OH- = [Sn(OH)6]2- |
642.
|
А) Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2OH- + 2H+ = 2H2O |
В) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3 H2O 3OH- + 3H+ = 3H2O |
|
Б)NaHSO4 + NaOH = Na2SO4 + H2O HSO4- + 2OH- = SO42- + H2O |
Г) Al(OH)3 + 3KOH = K3[Al(OH)6] Al(OH)3 + 3OH- = [Al(OH)6]3- |
643.
|
a) CaCO3 + 2HCl = CaCl2 + H2O + CO2 Ca2+ + 2H+ = H2O + CO2 |
Б) Na2S + FeSO4 = FeS + Na2SO4 S2- + Fe2+ = FeS |
|
B) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Zn(OH)2 + 2OH- = [Zn(OH)4]2- |
Г) Zn(OH)2 + 2HCl = ZnCl2 + 2H2O 2OH- + 2H+ = 2H2O |
644.
|
Hg2+ + S2- = HgS |
CO32- + 2H+ = H2O + CO2 |
|
HgCl2 + K2S = HgS + 2KCl Hg(NO3)2 + H2S = HgS + 2HNO3 |
Na2CO3 + 2HCl = 2NaCl + H2O + CO2 (NH4)2CO3 + 2HNO3 = 2NH4NO3 + H2O + CO2 |
645.
|
Ca2+ + SiO32- = CaSiO3 |
Al(OH)3 + 3OH- = [Al(OH)6]3- |
|
CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl Ca(NO3)2 + K2SiO3 = CaSiO3 + 2KNO3 |
Al(OH)3 + 3NaOH = Na3[Al(OH)6] Al(OH)3 + 3KOH = K3[Al(OH)6] |
646.
|
2NO2- + 2H+ = NO + NO2 + H2O |
Ag+ + Br- = AgBr |
|
2KNO2 + 2HCl = NO + NO2 + 2KCl + H2O 2NH4NO2 + 2HCN = NO + NO2 + 2NH4Cl + H2O |
AgNO3 + KBr = AgBr + KNO3 AgNO3 + NaBr = AgBr + NaNO3 |
647. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
|
а) 2AgCl+Na2CrO4=Ag2CrO4 + 2NaCl, ПР(Ag2CrO4) = 1.1*10-12< ПР(AgCl) = 1.73*10-10, следовательно реакция протекает в сторону образованияAg2CrO4 |
|
б) H2S+ 2KNO2= 2HNO2+K2S, Кд(HNO2) = 6.9*10-4> Кд(H2S) = 1.0*10-7, следовательно реакция протекает в сторону образования сероводорода. |
|
в) [HgBr4]2-+ 4Cl-= [HgCl4]2-+ 4Br-, Кн([HgCl4]2-)=8.5*10-16 > Кн([[HgBr4] ]2-) = 2.0*10-22, следовательно реакция протекает в сторону образования [HgBr4]2- |
648. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
|
а) Ba3(PO4)2+ 3Na2SO4=BaSO4+ 2Na3PO4, ПР(Ba3(PO4)2) = 6*10-39< ПР(BaSO4) = 1.1*10-10, следовательно реакция протекает в сторону образования фосфата бария. |
|
б) NH4OH+HCl=NH4Cl+H2O, Кд(NH4OH) = 7.5*10-14 > Кд(H2O) = 1*10-14, следовательно реакция протекает в сторону образования воды. |
|
в) [Cu(Cl)4]2-+ 4CN-= [Cu(CN)4]2-+ 4Cl-Кн([Cu(Cl)4]2-)=6.3*10-6> Кн([Cu(CN)4]2-) = 5*10-28, следовательно реакция протекает в сторону образования [Cu(Cl)4]2- |
649. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
|
а) Cd(OH)2+Na2CO3=CdCO3+ 2NaOHПР(Cd(OH)2) = 2.2*10-14< ПР(CdCO3) = 1.0*10-12, следовательно реакция протекает в сторону образования гидроксида кадмия |
|
б) CH3COOH+NaCN=CH3COONa+HCNКд(CH3COOH) = 1.74*10-5> Кд(HCN) = 5*10-10, следовательно реакция протекает в сторону образованияHCN |
|
в) [Zn(OH)4]2-+ 4CN-= [Zn(CN)4]2-+ 4OH-Кн([Zn(OH)4]2-) = 3.6*10-16> Кн([Zn(CN)4]2-)=1.3*10-17, следовательно реакция протекает в сторону образования [Zn(CN)4]2- |
650. Реакция протекает в сторону более слабого электролита, т.е. в сторону образования вещества с наименьшей ПР, Кд, Кн
|
а) CaSO4+Na2CO3=CaCO3+Na2SO4ПР(CaSO4) = 2.5*10-5> ПР(CaCO3) = 3.8*10-9, следовательно реакция протекает в сторону образования карбоната кальция |
|
б) Fe(OH)3 + 3NH4Cl=FeCl3+ 3NH4OHПР(Fe(OH)3) = 6.3*10-29< Кд(NH4OH) = 1.8*10-5, следовательно реакция протекает в сторону образования гидроксида железа |
|
в) [Ni(NH3)4]2++ 4CN-= [Ni(CN)4]2-+ 4NH3Кн([Ni(NH3)4]2+) = 1.12*10-8< Кн([Ni(CN)4]2-) = 1.8*10-14, следовательно реакция протекает в сторону образования [Ni(CN)4]2- |