
Химия / 4_лаба_растворы
.docxЛабораторная работа № 4 «Растворы»
Цель работы: научиться
-
определять концентрации растворов
-
рассчитывать и готовить растворы различных концентраций и значений рН среды
Опыт 1. Определение концентрации кислоты методом титрования
Перед началом титрования бюретку сполосните раствором щелочи, выданным для работы. Нормальность раствора щелочи указывается на этикетке склянки.
Налейте раствор щелочи в бюретку несколько выше нулевого деления. Установите уровень щелочи (по нижнему мениску) на нулевом делении бюретки. Если нулевая отметка находится значительно выше уровня глаз, титрование можно вести от другого деления, например, от 10мл.
Проведите ориентировочное титрование. Для этого в пипетку с помощью груши наберите 10мл приготовленного раствора кислоты. Из пипетки кислоту вылейте в коническую колбу для титрования, внесите туда 2-3 капли индикатора фенолфталеина. Из бюретки небольшими порциями (по 0,2-0,3 мл) прилейте щелочь, постоянно перемешивая содержимое колбы кругообразными движениями. Титрование проведите на белом фоне, подложив под колбу лист белой бумаги. Как только раствор станет розовым, добавление щелочи прекратите, и запишите объем щелочи, пошедший на титрование. Этот объем может быть неточным, поэтому титрование надо будет повторить еще два-три раза. Каждый раз перед титрованием новой пробы кислоты подливайте щелочь в бюретку до нулевой отметки или до того уровня, с которого начали титровать в первом опыте. После каждого титрования объем щелочи с точностью до десятых долей миллилитра записывайте в таблицу. Эти объемы не должны отличаться более, чем на 0,1мл. Если результаты титрования отличаются на большую величину, титрование следует повторить.
Результаты опыта занесите в таблицу 1
Рассчитайте нормальную концентрацию раствора кислоты, используя закон эквивалентов:
"вещества взаимодействуют друг с другом в эквивалентных количествах", т.е. число моль-эквивалентов щелочи, пошедшее на титрование (Nщ), равно числу моль-эквивалентов кислоты, взятой для анализа (Nк): Nщ = Nк.
Число моль-эквивалентов растворенного вещества в данном объеме раствора V равно произведению объема раствора на его нормальность, т.е.
N = V Сн,
где V - объем раствора, Сн- нормальность раствора,
тогда Vщ Сн(щ)= Vк Сн(к), отсюда:
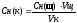 ,
моль/л,
,
моль/л,
где Сн(к) и Сн(щ) - нормальные концентрации кислоты и щелочи, моль/л;
Vщ - средний объем щелочи, пошедший на титрование, мл;
Vк - объем кислоты, взятой для титрования (объем пипетки) мл.
Расчет концентрации кислоты произведите с точностью до второго знака после запятой.
Таблица 1
Результаты титрования
|
№ п/п |
Объем щелочи, пошедшей на титрование, мл |
Средний объем щелочи, мл |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
Сделайте вывод.
Опыт 1. Приготовление раствора кислоты с заданным значением рН
Рассчитайте концентрацию уксусной кислоты (Ка(CH3COOH)=1,85∙10-5), имеющую значение рН равное 3. Рассчитайте, как необходимо разбавить исходный 0,1М раствор уксусной кислоты, для получения указанного значения рН.
Для расчетов воспользуйтесь формулами:
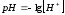
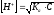
Результаты расчетов занесите в таблицу 2.
Используя, мерную пипетку и грушу приготовьте необходимый раствор в подготовленном стеклянном стаканчике. рН полученного раствора проверьте, используя индикаторную бумагу.
Таблица 2
Приготовление раствора кислоты с заданным значением рН
|
Исходная концентрация CH3COOH, С0, моль/л |
Характеристики CH3COOH, необходимой для приготовления |
|||
|
|
Концентрация CH3COOH С, моль/л |
Объем воды, VН2О, мл |
Объем CH3COOH V, мл |
Экспериментальное значение рН |
|
|
|
|
|
|
Сделайте вывод.
