
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля:
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •1.2. Механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •1.3. Специфичность действия ферментов
- •1.4. Кинетика ферментативных реакций
- •1.4.1. Зависимость скорости реакции от концентрации субстрата
- •1.4.2. Зависимость скорости реакции от концентрации фермента
- •1.4.3. Зависимость скорости реакции от температуры
- •1.4.4. Зависимость скорости реакции от величины рН среды
- •2. Классификация, номенклатура и регуляция ферментов
- •2.1. Классификация и номенклатура ферментов
- •2.1.1. Характеристика отдельных классов ферментов
- •2.2. Регуляция работы фермента
- •2.2.1. Активация энзима
- •1. Аллостерическая регуляция
- •2.2.2. Особенности строения и функционирования аллостерических ферментов:
- •2.2.4. Регуляция путём ковалентной модификации
- •2.2.5. Частичный протеолиз – как способ активации энзима (активация зимогена)
- •2.3. Ингибирование ферментов
- •2.4. Использование ферментов в медицине.
- •Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля:
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
1.4.1. Зависимость скорости реакции от концентрации субстрата
В случае постоянной концентрации энзима
скорость процесса постепенно увеличивается,
достигая определенного максимума
(рис.1), при котором дальнейшее увеличение
количества субстрата практически не
оказывает влияния на ход реакции. В
таких случаях принято считать, что
субстрат находится в избытке, а фермент
полностью насыщен, то есть все его
молекулы связаны с исходным веществом.
Отсюда фактором, ограничивающим скорость
реакции, при
этом становится количество биокатализатора.
случае постоянной концентрации энзима
скорость процесса постепенно увеличивается,
достигая определенного максимума
(рис.1), при котором дальнейшее увеличение
количества субстрата практически не
оказывает влияния на ход реакции. В
таких случаях принято считать, что
субстрат находится в избытке, а фермент
полностью насыщен, то есть все его
молекулы связаны с исходным веществом.
Отсюда фактором, ограничивающим скорость
реакции, при
этом становится количество биокатализатора.
1.4.2. Зависимость скорости реакции от концентрации фермента
Скорость любой каталитической реакции непосредственно зависит от уровня содержания фермента (рис.2). Линейная зависимость между этими величинами, когда скорость реакции прямопропорциональна количеству присутствующего энзима, справедлива только в определенных условиях, например на начальном этапе процесса, так как в этот период практически не происходит обратной реакции, а количество продукта оказывается недостаточным для обратимости реакции. Именно в этом случае начальная скорость реакции (v) будет пропорциональна концентрации фермента.

1.4.3. Зависимость скорости реакции от температуры
И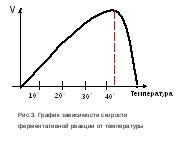 нтенсивность
химических реакций зависит и от
температуры, поэтому катализируемые
ферментами процессы также чувствительны
к её изменениям. Установлено, что скорость
большинства биохимических взаимодействий
увеличивается в 2 раза при повышении
температуры на 10°С и, наоборот, уменьшается
в 2 раза при понижении температуры на
10°С. Этот показатель получил названиетемпературного
коэффициента.
Однако вследствие белковой природы
фермента повышении температуры будет
снижать эффективную концентрацию энзима
с соответствующим снижением скорости
реакции. Оптимальной для действия
большинства ферментов теплокровных
животных является температура 38-39°С.
При увеличении её до 42-43°С, скорость
реакции снижается, потому что число
эффективных столкновений молекул
субстрата и фермента уменьшается
(рис.3). При понижении температуры
замедляется движение частиц, а
следовательно сокращается число
образующихся энзим-субстратных
комплексов, значит и скорость процесса
идёт на спад.
нтенсивность
химических реакций зависит и от
температуры, поэтому катализируемые
ферментами процессы также чувствительны
к её изменениям. Установлено, что скорость
большинства биохимических взаимодействий
увеличивается в 2 раза при повышении
температуры на 10°С и, наоборот, уменьшается
в 2 раза при понижении температуры на
10°С. Этот показатель получил названиетемпературного
коэффициента.
Однако вследствие белковой природы
фермента повышении температуры будет
снижать эффективную концентрацию энзима
с соответствующим снижением скорости
реакции. Оптимальной для действия
большинства ферментов теплокровных
животных является температура 38-39°С.
При увеличении её до 42-43°С, скорость
реакции снижается, потому что число
эффективных столкновений молекул
субстрата и фермента уменьшается
(рис.3). При понижении температуры
замедляется движение частиц, а
следовательно сокращается число
образующихся энзим-субстратных
комплексов, значит и скорость процесса
идёт на спад.
1.4.4. Зависимость скорости реакции от величины рН среды
Для каждого энзима
своя оптимальная рН среды. Ферменты
обычно наиболее активны в пределах
узкой зоны концентрации водородных
ионов, соответствующей для животных
тканей в основном выработанным в процессе
эволюции физиологическим значениям рН
среды 6,0–8,0. При графическом изображении
на кривой колоколообразной формы имеется
определенная точка, в которой б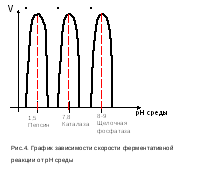 иокатализатор
максимально эффективен; эту точку
называютоптимумом
рН среды для
действия данного фермента (рис.4). Даже
незначительные (в сотых долях) изменения
величин рН приводят к резким сдвигам в
соотношениях нуклеофильных и электрофильных
группировок активного центра, что резко
сказывается на его комплементарности
к субстрату и впоследствии на его
эффективности.
иокатализатор
максимально эффективен; эту точку
называютоптимумом
рН среды для
действия данного фермента (рис.4). Даже
незначительные (в сотых долях) изменения
величин рН приводят к резким сдвигам в
соотношениях нуклеофильных и электрофильных
группировок активного центра, что резко
сказывается на его комплементарности
к субстрату и впоследствии на его
эффективности.
