
3. Закономерности протекания химических процессов Законы и формулы
Процессы в термодинамических системах
Термодинамика изучает свойства макроскопических систем на основе возможных превращений энергии без рассмотрения их микросостояний.
Для анализа этого аспекта химических процессов используют понятие «система».Системойназываетсясовокупность тел, находящихся во взаимодействии и мысленно выделенных из окружающей среды.
Систему характеризуют параметрами состояния (например, внутренней энергией U, температуройT, давлениемp, объемомV, концентрациейСи др.). Параметр состояния, изменение которого в ходе процесса не зависит от пути его протекания, называютфункцией состояния системы.
Систему называют изолированной, если она не обменивается с окружающей средой энергией и веществом.Закрытыесистемы не обмениваются веществом с окружающей средой, но могут обмениваться энергией. Воткрытых системах осуществляется обмен с окружающей средой как энергией, так и веществом.
Первый закон термодинамикисоответствует закону сохранения энергии:изменение внутренней энергии термодинамической системы (U) равно количеству теплоты (Q), сообщенной ей, за вычетом работы (А), совершенной системой. В химических процессах работа против внешних сил представляет собой работу расширенияА = p · V. Тогда:
U = Q – p · V. (3.1)
Для процесса, протекающего при постоянном объеме: V = 0. Тепловой эффект такого процесса (Qv) равен изменению внутренней энергии системы и, следовательно, обладает свойствами функции состояния:
Qv = U. (3.2)
Если процесс протекает при постоянном давлении, то из (3.1) следует
Q = (U2 + pV2 ) – (U1 + pV1) = H2 – H1 = H. (3.3)
Полученная функция (Н) называетсяэнтальпией(теплосодержанием) системы и по определению является функцией состояния. Таким образом, тепловой эффект реакции, протекающей при постоянном давлении и данной температуре, равен изменению энтальпии системы и также обладает свойствами функции состояния
Qp=H. (3.4)
Соотношения (3.2) и (3.4) служат обоснованием закона Гесса:тепловой эффект химической реакции не зависит от пути ее протекания.
В термохимии принято считать, что тепловой эффект реакции равен изменению энтальпии по абсолютной величине, но отличается по знаку: Q= –H. Поэтому тепловой эффектэкзотермическихреакций (протекающих свыделениемтеплоты) положителен:Q 0, аН < 0. Соответственно дляэндотермических реакций (протекающих споглощением теплоты):Q < 0, аН > 0.
В термодинамических расчетах широко применяется понятие энтальпия образования соединения Нo298 – этотепловой эффект получения одного моля сложного вещества из простых. Для простых веществ энтальпия образования равна 0. Обсуждаемая величина зависит от условий протекания процесса, поэтому в справочниках приводится для стандартного состояния (pо = 101325 Па иТ о= 298 К).
Второй закон термодинамикиучитывает не только изменение энтальпии в ходе процесса, но и общее изменение ее структуры (степени хаотичности). Мерой хаотичности строения системы является функция состоянияэнтропия(S). Больцман показал, что
S = k · ln W, (3.5)
где k = R / NA– постоянная Больцмана; W–термодинамическая вероятностьсистемы (число микросостояний, которыми реализуется данное макросостояние).
Критерием самопроизвольности процесса является изменение функции состояния системы – энергии Гиббса (G).
G = H – T ·S. (3.6)
Для самопроизвольных процессов
Н – Т · S ≤ 0. (3.7)
Уравнение (3.7) является формальным выражением второго закона термодинамики: невозможен процесс, единственным результатом которого является передача теплоты от тела менее нагретого к телу более нагретому.
В термодинамических расчетах наряду со значениями энтальпии образования соединений Но298широко применяются стандартные величины энтропииS о298 и энергии Гиббса образованияGо298. Многие расчеты основаны на применении следствия из закона Гесса: для функций состояния системы их изменение в ходе процесса можно рассчитать следующим образом:
![]() ,
(3.8)
,
(3.8)
где i, j– индексы соответственно исходных веществ и продуктов, аνi , νj– соответствующие коэффициенты из уравнения реакции.
Таким образом, изменение энтальпии в ходе реакции равно разности между суммой энтальпий образования продуктов и суммой энтальпий образования исходных веществ. Аналогичные уравнения справедливы для изменения энтропии и энергии Гиббса в ходе процесса
![]() ,
(3.9)
,
(3.9)
![]() .
(3.10)
.
(3.10)
Кинетика химических реакций
Средняя скорость реакции соответствует изменению количества вещества nза промежуток времени в единице объема или на единице площади поверхности:
![]() (для гомогенных реакций); (3.11)
(для гомогенных реакций); (3.11)
![]() (для гетерогенных реакций).
(3.12)
(для гетерогенных реакций).
(3.12)
Влияние концентрации реагентовна скорость реакции.Основной постулат химической кинетики (закон действующих масс для скорости реакции) гласит:скорость реакции, протекающей необратимо, пропорциональна произведению молярных концентраций реагентов. Для реакции
а А + b В продукты
![]() (3.13)
(3.13)
где k–константа скорости реакции; [A], [B] – молярные концентрации реагентов;a, b–порядок реакциисоответственно по реагентамАиB.Физический смысл константы скорости:k = W, если [А] = [В] = 1 моль/дм3. Величинаkзависит от природы реагентов и температуры.
Влияние температуры.Согласноправилу Вант-Гоффа,увеличение температуры на 10 градусов приводит к возрастанию скорости в раз:
 ,
(3.14)
,
(3.14)
где = 2…4 – температурный коэффициент скорости реакции (температурный коэффициент Вант-Гоффа).
Более строго влияние температуры на величину константы скорости химической реакции выражает уравнение Аррениуса
![]() ,
(3.15)
,
(3.15)
где B иA– константы. Уравнению Аррениуса отвечает зависимость
![]() ,
(3.16)
,
(3.16)
где Ea–энергия активацииреакции – избыточная по сравнению с имеющимся запасом энергия, которая необходима для того, чтобы перевести все исходные молекулы в реакционноспособное состояние.
Равновесие обратимых химических процессов. Обратимые химические реакциипротекают как в прямом, так и в обратном направлении:
а А + b В с С + d D.
Для равновесия обратимой реакции справедлив закон действующих масс – для обратимых реакций в состоянии равновесия отношение произведений концентраций продуктов к произведению концентраций реагентов есть величина постоянная:
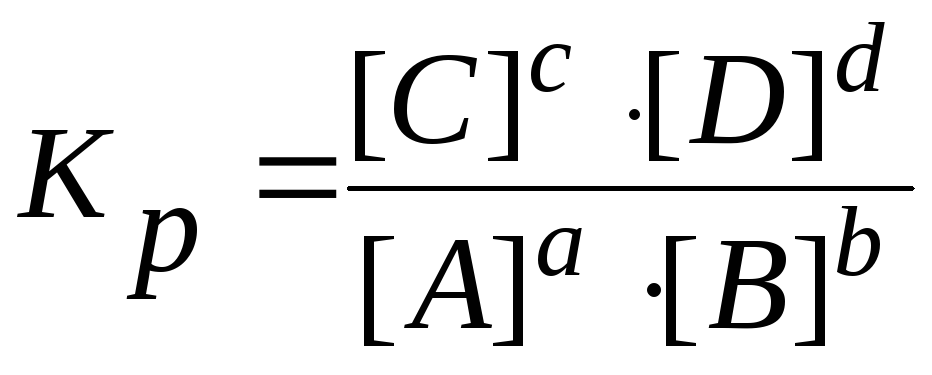 ,
(3.17)
,
(3.17)
где Kр– константа равновесия обратимой химической реакции.
Величина Kр связана с изменением энергии Гиббса в ходе реакции
![]() .
(3.18)
.
(3.18)
Равновесие обратимых процессов подчиняется принципу Ле Шателье:если на обратимую систему, находящуюся в состоянии динамического равновесия, оказать воздействие (изменить параметр), то равновесие сместится так, чтобы оказанное воздействие ослабить.
