
пособие по физике формат pdf / Глава 6. Атомная и ядерная физика
.pdf
энергетический уровень. С возрастающим главным квантовым числом возрастают радиус орбиты (размеры электронного облака) и энергия электрона (а по модулю она, наоборот, уменьшается).
Квантование момента импульса электрона осуществляется через
орбитальное (азимутальное) квантовое число
l 0,1,2,..., n 1:
L |
l(l 1) момент импульса. |
(6.11) |
l |
|
|
Это число определяет форму электронного облака и определяет энергетический подуровень данного энергетического уровня. В зависимости от величины орбитального квантового числа выделяют
такие состояния: s состояние при l 0, |
p состояние при l 1, |
|||
d состояние при l 2, d состояние при l 3 и т.д. |
|
|||
Квантование проекции на ось Oz момента импульса L |
m |
|||
|
|
|
|
Z |
осуществляется |
через |
магнитное |
квантовое |
число |
m 0, 1, 2,..., l. |
Оно характеризует ориентацию в пространстве |
|||
орбитального момента количества движения электрона или
пространственное расположение электронной орбитали. |
Каждое из |
|||||
2l 1 возможных значений магнитного квантового числа определяет |
||||||
проекцию вектора |
орбитального |
момента |
на |
данное |
направление |
|
(обычно ось Oz ). |
|
|
|
|
|
|
С помощью |
этого числа |
можно |
определять |
возможные |
||
|
|
|
|
|
|
|
направления вектора момента импульса электрона L. Он может иметь |
||||||
лишь такие ориентации в пространстве, при которых его проекция L |
||||||
|
|
|
|
|
|
z |
на направление Oz |
внешнего магнитного поля принимает квантовые |
|||||
значения, кратные : L |
m , где m – магнитное квантовое число, |
|||||
|
Z |
|
|
|
|
|
принимающее значения: |
m 0, 1, 2,..., l, |
где l |
орбитальное |
|||
квантовое число.
Собственный механический момент импульса определяется
через спиновое квантовое число |
s. |
Спин |
s |
(от англ. spin — |
вертеть[-ся], вращение) – собственный момент импульса (или магнитный момент) элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спин измеряется в полуцелых единицах постоянной Дирака (приведенной постоянной Планка). Для электрона и ядра водорода
спин равен |
1 |
, |
для фотона – |
|
2 |
||||
|
|
|
.
Спином называют также
собственный момент импульса атомного ядра или атома. Собственный момент импульса имеет две степени свободы. Поэтому электрон может находиться в зависимости от спина в двух разных
220

квантовых состояниях: в состоянии со спином вверх либо со спином вниз.
Подсчитаем сначала общее число квантовых состояний электрона без учёта его спина в атоме. Для n-го энергетического
уровня существует |
n |
орбитальных квантовых чисел, и, |
соответственно, n электронных облаков. Для каждого l-облака
существует |
2l 1 |
пространственных расположений электронных |
|||||
орбиталей. Поэтому для каждого главного квантового числа |
n |
||||||
существует различных состояний электрона: |
|
|
|
|
|||
|
n1 |
n1 |
n(n 1) |
|
2 |
|
|
|
2l 1 2 l n 2 |
|
n n |
. |
|
||
|
2 |
|
|
||||
|
l 0 |
l 0 |
|
|
|
|
|
|
|
|
|
|
|
||
Тогда без учёта спина электрона общее число электрона в атоме задаётся главным квантовым числом
состояний
n |
и равно |
n n |
2 |
n |
3 |
, |
а с учётом спина электрона его квантовых состояний |
||
|
|
||||||
будет в два раза больше, т.е. 2n |
3 |
. |
|||||
|
|||||||
Согласно запрету Паули1 никакие два электрона не могут в атоме находиться в одном и том же квантовом состоянии.
Отсюда следует, что любой атом в невозбуждённом состоянии на энергетическом уровне n 1 с минимальной энергией E1 13,6эВ
может иметь не более двух электронов. Уже третий электрон атома займёт следующую орбиталь с энергетическим уровнем n 2. После
того, когда и этот уровень будет заполнен |
2 2 |
3 |
16 |
электронами, то |
|
19-й электрон атома вынужден будет размещаться уже на третьей орбитали (n 3) и т.д.
Переход электрона с одного энергетического уровня на другой сопровождается испусканием или поглощением квантов энергии. Но и для этих переходов имеют место свои запреты, т.е. не всякие переходы возможны.
Правило отбора гласит, что возможны только такие
переходы, при которых орбитальное квантовое число l меняется на единицу: Δl = ±1. Это правило есть следствие закона сохранения момента количества движения. Переход означает обязательное
изменение главного квантового числа |
n. Это любое |
n 0. |
Иначе |
|||
говоря, переход |
nl nl |
|
невозможен, |
переходы 4s 1s, 4d 1s |
||
|
||||||
невозможны, а |
переход |
|
4 p 1s возможен, т.к. |
только |
в этом |
|
1 Вольфганг Эрнст Паули (Wolfgang Ernst Pauli; 1900 – 1958) – австрийский физик, лауреат Нобелевской премии по физике за 1945 год.
221

переходе
l l( p) l(s) 2 1 1
и, следовательно, выполняется
условие правила отбора. Возможные переходы в возбуждённом атоме, в котором электроны рассеяны до четвёртого энергетического уровня, представлены на рис. 6.6.
l = 0 |
l = 1 |
l = 2 |
l = 3 |
s |
p |
d |
f |
n = 4
n = 3
Серия Лаймана
n = 2
 Серия Бальмера
Серия Бальмера
 Серия Пашена
Серия Пашена
n = 1
Рис. 6.6
Переход атома из возбуждённого состояния в стационарное осуществляется посредством возможных переходов электронов на энергетические уровни с наименьшими полными энергиями при наличии там вакантных мест. При каждом таком переходе электрона происходит испускание квантов энергии, равных разности энергий между начальным и конечным уровнями такого перехода.
Вопросы для самоконтроля
1.Что такое непрерывные и линейчатые спектры? Какой спектр испускают раскалённые твёрдые вещества?
2.Что такое электрон-вольт?
222

3.Какие переходы электрона образуют серию Лаймана?
4.Какая серия переходов лежит в инфракрасной области?
5.Дайте определение квантовым числам.
6.Что такое квантовое состояние электрона, и в чём суть запрета Паули?
7.Сформулируйте правило отбора для переходов электронов в атоме.
§6.4. Атомное ядро. Ядерные силы. Ядерные реакции
Согласно Д.Д. Иваненко1 и В. Гейзенбергу2 ядро состоит из протонов и нейтронов. Протон (обозначается p+) имеет положительный заряд e, а нейтрон (обозначается n0) не имеет электрического заряда, т.е. электрически нейтрален. Время жизни в свободном состоянии у протона более 2,9·1029 лет, а у нейтрона 886 секунд. Массы этих частиц приблизительно равны и в 1800 раз превышают массу электрона. Поэтому на массу атома масса электронов практически не влияет. Протон и нейтрон имеют общее название – нуклон. Число протонов в ядре (обозначается Z) равно порядковому номеру соответствующего этому ядру элемента в периодической системе Менделеева и называется зарядовым числом. Заряд ядра равен Ze. Число нуклонов ядра (обозначается А) называется массовым числом ядра. Атомы (ядра) с одинаковым числом протонов Z, но разным числом нейтронов А -Z называются
изотопами.
Все изотопы одного и того же элемента имеют очень близкие химические свойства, поскольку их ядра имеют одинаковый заряд и одинаковое строение электронных оболочек.
Нуклоны в ядре сильно спрессованы, т.к. между ними действуют силы притяжения неэлектрической природы – ядерные силы. Ядерные силы действуют на очень коротких расстояниях, на которых между нуклонами имеет место ядерное взаимодействие, которое называют ещё сильным взаимодействием. Особенностью сильного взаимодействия является то, что оно происходит только на очень
1Дмитрий Дмитриевич Иваненко (1904 – 1994) — российский и советский физиктеоретик. Первым предложил протон-нейтронную модель ядра (1932), впоследствии развивавшуюся также Вернером Гейзенбергом.
2Вернер Карл Гейзенберг (Werner Karl Heisenberg; 1901 – 1976) – немецкий физик-теоретик, один из создателей квантовой механики, лауреат Нобелевской премии по физике (1932), член ряда академий и научных обществ мира.
223

малых расстояниях, порядка 2·10-15 м. Для двух протонов, находящихся на расстоянии, оно примерно в 100 раз больше электромагнитного взаимодействия. Именно поэтому ядро не распадается.
Ядерные силы притяжения между протоном и протоном, протоном и нейтроном, нейтроном и нейтроном одинаковые, но обладают насыщением – могут удерживать друг возле друга не любое количество нуклонов, а лишь определённое.
Чтобы расщепить ядро на свободные нуклоны необходимо затратить определённую работу по преодолению ядерных сил. Эту работу называют энергией связи атомного ядра.
По закону сохранения энергии численно равны энергия связи и энергия синтеза ядра из свободных нуклонов. Экспериментально установлено, что масса синтезированного ядра меньше суммарной массы нуклонов, из которых оно синтезировано:
M |
я |
Zm |
|
|
p |
|
( A Z )m |
0 . |
n |
|
Это явление получило название дефекта
массы. Дефектом массы
M Zm |
( A Z )m |
0 M |
p |
n |
|
называют |
положительную величину |
||
я |
. |
Она, |
как показали эксперименты, |
|
|
|
|
пропорциональна энергии связи
2 |
M , |
E c |
где коэффициент
пропорциональности есть квадрат скорости света. Последнее равенство называют формулой Эйнштейна1.
Ядерной реакцией называют процесс образования новых ядер или частиц при столкновениях ядер или частиц. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота. Ядра и частицы в ядерных реакциях обозначаются общей формулой:
|
A |
|
|
|
|
Z |
X , |
|
|
где X |
|
|
|
|
обозначение атома согласно периодической |
системе |
|||
элементов Менделеева, Z, A зарядовое и массовое числа ядра этого |
||||
атома соответственно. |
|
|
|
|
|
|
|
14 |
|
Например, ядро атома азота будет обозначаться как |
|
7 N , ядро |
||
атома гелия
дейтерия –
(α-частица) –
2 |
H , |
трития – |
|
1 |
|||
|
|
4 |
|
|
|
1 |
|
1 |
2 He, |
водорода (протона) – |
1 H |
или |
1 p, |
||
3 |
|
|
1 |
|
|
|
1 H , |
нейтрона |
0 n и т.д. Ядерная реакция, |
||||
которую |
|
наблюдал |
Резерфорд, |
будет |
иметь |
вид: |
||||
14 |
N |
4 |
17 |
1 |
|
|
|
|
||
7 |
2 |
He |
8 |
O H. |
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|||
1 Альберт Эйнштейн (Albert Einstein, 1879 – 1955) – физик-теоретик, один из основателей современной теоретической физики.
224
4 |
He |
|
2 |
||
|
В результате бомбардировки ядер атома азота |
14 |
N |
α-частицами |
||||
7 |
|||||||
|
|
|
|
|
|
||
|
17 |
|
|
|
|
1 |
|
получались ядра изотопа кислорода |
8 O, |
и ядра водорода |
1 H |
||||
(протоны).
Для всех ядерных реакций выполняется закон сохранения массы и заряда. В приведённом примере сумма массовых чисел частиц до реакции равна сумме массовых чисел после реакции: АΣ = 14 + 4 = 17+1=18, и суммы зарядовых чисел до и после реакции также равны:
ZΣ = 7 + 2 = 8 + 1 = 9.
Вопросы для самоконтроля
1.Из чего состоят ядра атома? Какими числовыми характеристиками они обладают?
2.Назовите основные свойства ядерного взаимодействия.
3.Что такое энергия связи и дефект массы? Какова связь между ними?
4.Что называют ядерными реакциями? Как проявляют себя законы сохранения массы и заряда в этих реакциях?
§6.5. Альфа-, бета-, гамма-излучения. Методы регистрации радиоактивности
Радиоактивность – это некоторых атомов (изотопов радия
самопроизвольный
226 |
235 |
88 Ra, урана |
92U , |
распад
углерода
ядер
14 |
C |
|
6 |
||
|
и т.д.) с испусканием особого рода излучения, которое называют
радиоактивным излучением.
Классический опыт, позволивший обнаружить сложный состав радиоактивного излучения, состоял в следующем. Радиоактивный препарат помещался на дно узкого канала в куске свинца. Против канала находилась фотопластинка. На выходившее из канала излучение действовало сильное магнитное поле, линии индукции которого перпендикулярны лучу (рис. 6.7).
Вся установка размещалась в вакууме. В отсутствии магнитного поля на фотопластинке после проявлялось одно темное пятно, точно против канала. В магнитном поле луч распадался на три пучка. Два пучка отклонялись в противоположные стороны. Это указывало на наличие у этих излучений электрических зарядов противоположных знаков. При этом отрицательная компонента излучения отклонялась магнитным полем гораздо больше, чем положительная. Третья составляющая не отклонялась магнитным полем. Положительно
225
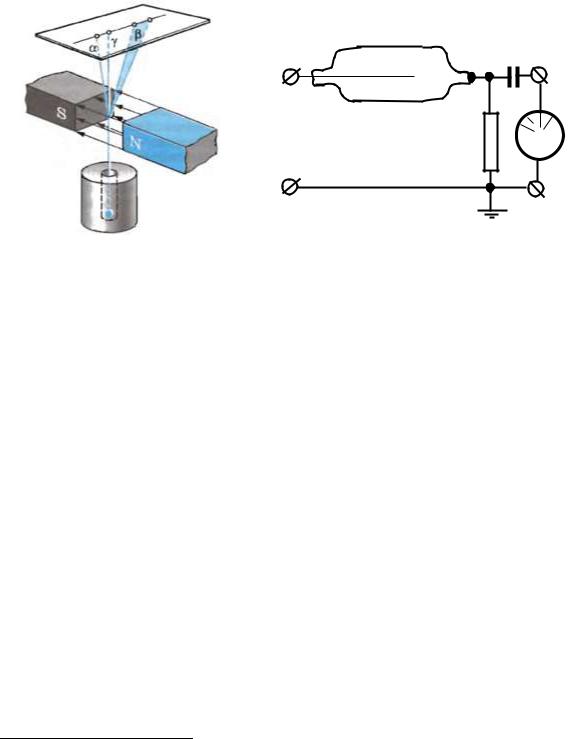
заряженная компонента получила название альфа-лучей, отрицательно заряженная – бета-лучей и нейтральная – гамма-лучей (α-лучи, β-лучи,γ-лучи).
+ |
С |
R V 
Рис. 6.7 Выделение α-, β-, γ-лучей |
Рис. 6.8. Схема счётчика |
|
Гейгера |
Позже было установлено, что α-лучи – это поток ядер гелия, β- лучи – поток электронов, а γ-лучи представляют собой жесткое электромагнитное излучение с длинами волн в диапазоне 10-10 – 10-13
м.
|
При испускании ядром α-частицы его массовое число |
||||||||
уменьшается |
|
на четыре единицы, а |
|
зарядовое |
|
– на две: |
|||
A |
X |
A 4 |
Y |
4 |
X |
элемент |
Y |
смещается в |
|
Z |
|
2 |
H. Относительно элемента |
||||||
|
Z 2 |
|
|
|
|
|
|||
таблице Менделеева на две клеточки к её началу. При испускании ядром β-частицы (β-распаде) массовое число не меняется, а зарядовое
увеличивается на единицу:
A |
X |
A |
0 |
е, |
Z |
Y |
1 |
||
|
Z 1 |
|
и элемент смещается на
одну клеточку в противоположном направлении.
В 1903 году Фредериком Содди1 и Эрнестом Резерфордом экспериментальным путём был открыт закон радиоактивного распада. Его современная формулировка имеет вид:
dN |
N , |
(6.12) |
|
dt |
|||
|
|
1 Фредерик Содди (Frederick Soddy; 1877 – 1956) – английский радиохимик, член Лондонского королевского общества (1910), лауреат Нобелевской премии по химии (1921).
226

что означает, что число распадов |
dN |
за интервал времени |
dt |
в |
произвольном веществе пропорционально числу имеющихся в
образце атомов N. |
постоянная распада, |
В этом математическом выражении |
которая характеризует вероятность радиоактивного распада за единицу времени и имеющая размерность с-1. Знак минус указывает на убыль числа радиоактивных ядер со временем.
Этот закон считается основным законом радиоактивности, из него было извлечено несколько важных следствий, среди которых формулировки характеристик распада — среднее время жизни атома
и период полураспада.
Разделив переменные, проинтегрируем уравнение (6.12),
полагая, что в момент |
t 0 |
|
число атомов радиоактивного элемента |
|||||||||||
было N0 N (0) : |
|
|
|
|
|
|
|
|
|
|||||
N |
dN |
|
t |
dt, ln |
N |
t, N (t) N |
|
|
t |
|
|
|||
|
|
|
e |
. |
(6.13) |
|||||||||
N |
N |
|
0 |
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||
N |
0 |
|
0 |
|
|
0 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Время, за которое исходное количество атомов радиоактивного элемента уменьшается вдвое, называется периодом полураспада T.
Выразим закон (6.13) через эту характеристику. Из последнего
равенства имеем |
|
|
|
|
|
|
|
e |
|
|
|
|||
N (T ) |
|
1 |
e |
T |
, T ln 2, |
|
ln 2 |
, N (t) N |
|
ln 2 |
t T |
, |
||
N |
|
2 |
|
T |
0 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
откуда
|
|
|
|
t |
N (t) N |
|
|
T . |
|
0 |
2 |
|
||
|
|
|
|
(6.14)
Уравнение (6.14) определяет математическую формулировку
закона радиоактивного распада через параметр |
T |
период |
полураспада. |
|
|
При облучении вещества происходит его |
ионизация. Это |
|
явление используется в различных устройствах регистрации радиоактивного излучения. Простейшим из них является счётчик Гейгера1 (рис. 6.8), используемый для регистрации β- и γ-излучения. Он состоит из стеклянной трубки, заполненной газом, покрытой изнутри металлическим слоем (катод), и тонкой металлической нити (анод). Под действием излучения газ в стеклянной трубке ионизируется, и образовавшиеся ионы и электроны замыкают цепь.
1 Ганс Вильгельм Гейгер, (Hans Geiger, 1882 – 1945) – немецкий физик, первым создавший детектор альфа-частиц и других ионизирующих излучений. Изобрёл в 1908 г. счётчик Гейгера. В 1911 г. с Дж. Нэттолом открыл закон Гейгера-Нэттола.
227

На сопротивлении R под действием протекания тока образуется импульс напряжения, который через конденсатор С подаётся на вход регистрирующего устройства V.
Дозиметр (прибор для регистрации ядерных излучений) представляет собой заряженный конденсатор, который разряжается в результате ионизации пространства между его пластинами под действием излучения.
Действие камеры Вильсона1 основано на конденсации пересыщенного пара на ионах, образовавшихся вдоль траекторий движения заряжённой частицы.
Действие пузырьковой камеры основано на образовании пузырьков в перегретой жидкости вдоль траектории частицы. Из-за большой плотности рабочего вещества в пузырьковой камере пробеги частиц оказываются достаточно короткими. Следы, оставляемые в пузырьковой камере или камере Вильсона, называют треками. По форме трека можно определить заряд частицы, её энергию и другие параметры.
Метод толстослойных эмульсий позволяет регистрировать редкие явления. Быстрая заряжённая частица при своём движении в фотоэмульсии создаёт центры скрытого изображения. При проявке цепочка зёрен серебра создаёт трек частицы. Радиоактивное излучение, попадая на атомы серебра, содержащегося на фотоплёнке, выбивает из них электроны. Это явление называется внутренним фотоэффектом.
Ещё одним свойством радиоактивного излучения, которое используют для наблюдения, является способность некоторых веществ светиться под действием этого излучения. Для регистрации-частиц Резерфорд использовал светящийся экран. Экран телевизора и осциллографа (см. подраздел 4.5) светится под ударами электронов.
Вопросы для самоконтроля
1.Что представляют собой -, β- и γ-излучения?
2.Запишите закон радиоактивного распада в дифференциальном виде.
3.Что такое период полураспада? Как записать закон радиоактивного распада в интегральном виде через этот параметр?
1 Чарлз Томсон Риз Вильсон (Charles Thomson Rees Wilson; 1869 – 1959) –
шотландский физик, лауреат Нобелевской премии по физике за 1927 год (совместно с А. . Комптоном).
228

4.Какие устройства регистрации радиоактивности вы знаете?
5.На каком явлении основано действие счётчика Гейгера?
§6.6. Цепная реакция деления ядер урана
Цепная ядерная реакция — последовательность единичных ядерных реакций, каждая из которых вызывается частицей, появившейся как продукт реакции на предыдущем шаге последовательности. Примером цепной ядерной реакции является реакция деления ядер тяжёлых элементов при бомбардировке их нейтронами, полученными при делении ядер в предыдущих актах деления.
Втяжёлых ядрах, перегруженных нейтронами, энергия связи много меньше, чем в легких и средних ядрах. Энергии взаимодействия с одним нейтроном, врезающимся в ядро с определённой скоростью, может оказаться достаточным, чтобы преодолеть ядерные силы притяжения нуклонов ядра. Поэтому для цепных ядерных реакций деления используются тяжёлые элементы.
В1938 году немецкие учёные Отто Ган1 и Фриц Штрассман2 открыли ядерную реакцию деления ядер изотопа урана, возвестив тем самым наступление ядерной эры. Эта реакция имеет такую запись
235 |
1 |
145 |
Ba |
88 |
|
1 |
n 200МэВ . |
||||
92 |
U |
0 |
n |
56 |
36 |
Kr 3 |
|
||||
|
|
|
|
|
0 |
|
|||||
Ядро
235 |
|
92 |
U |
|
|
урана, поглотив нейтрон, возбуждается и начинает
деформироваться (рис. 6.9). Оно растягивается из стороны в сторону до тех пор, пока кулоновские силы отталкивания между протонами не начнут преобладать над ядерными силами притяжения. После этого ядро разрывается на две части и осколки разлетаются со скоростью 1/30 скорости света. При делении ядра образуются 3 (или 2) нейтрона. Появление нейтронов объясняется тем, что число нейтронов в осколках оказывается больше, чем это допустимо.
1Отто Ган (Otto Hahn - Отто Хан; 1879 – 1968) – немецкий химик, радиохимик, открывший ядерную изометрию (Уран Z) и расщепление урана. Получил Нобелевскую премию по химии за 1944 год. Назван учёным сообществом «отцом ядерной химии».
2Фриц (Фридрих Вильгельм) Штрассман (Fritz Straßmann; 1902 – 1980)
немецкий химик и физик. В 1938 г. открыл совместно с О. Ганом процесс деления ядра при бомбардировке атомов урана нейтронами.
229
