
пособие по физике формат pdf / Глава 2. Молекулярная физика
.pdf
Глава 2. Молекулярная физика и термодинамика
Молекулярная физика – раздел физики, изучающий физические свойства тел на основе рассмотрения их молекулярного строения. Задачи молекулярной физики связаны с изучением взаимодействия и движения частиц (молекул), составляющих физические тела. Решение этих задач ведётся с помощью методов физической статистики, термодинамики и физической кинетики. Теоретической основой молекулярной физики является возникшая в XIX веке
молекулярно-кинетическая теория (МКТ).
§2.1. Основные положения молекулярнокинетической теории
Любая научная теория содержит в своей основе ряд принимаемых на веру положений – постулатов.
1)любое вещество состоит из атомов и молекул,
2)молекулы находятся в непрерывном тепловом движении,
3)между молекулами существуют силы взаимодействия (притяжения и отталкивания).
Опытными подтверждениями этих положений являются:
1)броуновское движение,
2)диффузия (процесс самопроизвольного смешивания молекул
разных веществ).
Французский физик Перрен1 установил, что масса молекулы
кислорода
mO2
почти в 200 млн. раз меньше массы броуновской
частицы и составляет порядка 5 10 |
26 |
кг (по уточненным данным |
|||||
|
|||||||
mO |
5,31 10 |
26 |
кг ). |
|
|
|
|
|
|
|
|
||||
2 |
|
|
|
|
|
|
|
|
За атомную единицу массы принимается 1/12 массы атома |
||||||
углерода mС : |
|
|
|
|
|
|
|
|
|
|
|
1 |
m 1 а.е.м. 1,66 10 27 кг . |
||
|
|
|
|
|
|||
|
|
|
12 |
C |
|
|
|
|
|
|
|
|
|
||
|
Масса любой молекулы mо может быть выражена через |
||||||
молекулярную массу этого физического вещества M o |
, приводимую в |
1 Жан Батист Перрен (1870 – 1942) – французский физик, ин. член АН СССР с
1929 года.
58
периодической таблице Д.И. Менделеева1 в а.е.м., согласно формуле:
mо
M |
o |
|
1,66 10 |
27 |
кг |
|
. Например, масса атома углерода
m |
12 1,66 10 |
27 |
кг 1,992 10 |
26 |
кг. |
|
|
||||
C |
|
|
|
|
|
За единицу количества вещества моль принимают такое его количество, в котором содержится число частиц, равное числу атомов в 12 г углерода. Число этих частиц равно
|
|
|
0,012кг |
|
|
10 |
3 |
|
||
N |
|
|
|
|
|
|
||||
A |
12 1,66 10 |
27 |
кг |
1,66 10 |
27 |
|||||
|
|
|
||||||||
|
|
|
|
|
|
|||||
6,0241 10 |
23 |
|
1 моль
.
Данное число частиц называется числом Авогадро1. Такое число частиц содержится в 1 моле любого вещества.
Масса одного моля (молярная масса М) любого вещества определяется по периодической таблице Менделеева и в СИ имеет
размерность
кг моль
|
1 |
кг |
|
1000г |
103 |
|
|
|
|
а.е.м. . |
|||
|
|
|
|
|
|
|
|
|
моль |
|
моль |
|
|
Например,
молярная масса водяного пара (вещества, состоящего из молекул Н2О)
будет
M |
O |
H |
|
2 |
|
2 а.е.м. + 16 а.е.м. = 18 а.е.м. = 0,018
кг |
. |
|
моль |
||
|
Вопросы для самоконтроля
1.Назовите основные положения МКТ.
2.Какие опытные данные эти положения подтверждают?
3.Что принимается за атомную единицу массы?
4.Найдите молярную массу углекислого газа.
§2.2. Макропараметры идеального газа. Основное уравнение МКТ для идеального газа
Сделаем следующие допущения:
1Дмитрий Иванович Менделеев (1834 – 1907) – русский химик, физик, метролог, прогрессивный общественный деятель. Труды по метеорологии и воздухоплаванию. Открыл в 1869 году периодический закон химических элементов. С 1876 года член-корр. Петербургской АН. В 1880 году выдвигался в академики, но был забаллотирован.
1 Амедео Авогадро (1776 – 1856) – итальянский физик и химик.
59
1) молекулы |
взаимодействуют друг с другом лишь путём |
|
абсолютно |
упругих |
столкновений, а силы взаимного |
притяжения и отталкивания другой природы малы, 2) размеры молекул можно не учитывать (считать их точками,
не имеющими объёма).
Гипотетический газ с такими свойствами называется идеальным газом. В нём молекулы ведут себя как твердые шарики малого размера, которые в процессе хаотического движения соударяются между собой и со стенками, ограничивающими объём газа. При ударе о стенку молекулы изменяют свой импульс, оказывая силовое действие на единицу площади стенки. Такая усредненная по времени сила на единицу площади называется абсолютным давлением.
Пусть р абсолютное давление идеального газа. Оно зависит
от кинетической энергии движущихся частиц. Эта зависимость описывается основным уравнением МКТ:
|
|
p |
2 |
n E |
|
, |
|
|
|
к |
|||
|
|
|
3 |
o |
|
|
|
|
|
|
|
|
|
где E |
к |
среднее значение кинетической энергии частицы газа, |
||||
|
|
|
|
|
|
|
концентрация (число молекул в единице объёма).
(2.1)
n |
|
o |
|
|
|
|
m |
v |
2 |
|
|
|
|
|
|
|
|
||
Очевидно E |
|
|
o |
|
, где |
v |
2 |
|
|
|
|||||
к |
|
2 |
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
скорости молекул. Тогда из (2.1) имеем
среднее значение квадрата
p |
1 |
n m v2 |
, |
(2.2) |
|
||||
|
3 o o |
|
|
|
т.е. давление идеального газа пропорционально среднему значению квадрата скорости молекул.
Еще один макропараметр газа – абсолютная температура T – это мера интенсивности теплового движения молекул, которая связана
со средним значением кинетической энергии
E |
к |
|
поступательного
движения частицы газа соотношением
|
|
|
E |
|
|
3 |
kT , |
|
|
|
|
к |
2 |
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
23 Дж |
|
|
|
|
1 |
|
|
где k 1,38 10 |
|
|
постоянная Больцмана |
. |
||||
|
К |
|||||||
|
|
|
|
|
|
|
|
|
(2.3)
1 Людвиг Больцман (Boltzmann, 1844 – 1906) – австрийский физик, основоположник статистической физики, дал теоретическое обоснование и истолкование второго начала термодинамики. С 1899 года иностранный членкорр. Петербургской АН.
60
Из (2.1) и (2.3) определяется связь между макропараметрами газа – абсолютной температурой и абсолютным давлением:
p
no kT
.
(2.4)
Температура, при которой прекращается всякое движение молекул, называется абсолютным нулем. Шкала отсчета абсолютной температуры начинается с абсолютного нуля, а масштаб деления этой шкалы совпадает со шкалой Цельсия. Абсолютная температура измеряется в кельвинах (К): T (t 273,15)K , где t температура в
градусах Цельсия (
0 |
o |
C 273,15K, |
|
0K
273,15o C
).
Из (2.2) и (2.4) средний квадрат скорости молекул
откуда
v |
2 |
|
3kT mo
,
v |
|
|
v |
2 |
|
3kT |
, |
|
|
||||||
кв |
|
m |
|||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
|
где величина vкв называется средней квадратичной |
||||||||
теплового |
движения молекул. |
При |
T 273,15K |
|||||
vкв (N2 ) |
500 |
м |
, для водорода vкв |
(H2 ) |
1800 |
м |
. |
|
с |
с |
|||||||
|
|
|
|
|
|
|||
(2.5)
скоростью
для азота
Вопросы для самоконтроля
1.Что такое абсолютное давление?
2.Напишите основное уравнение МКТ.
3.Что такое абсолютная температура?
4.Напишите формулы, связывающие среднюю кинетическую энергию частицы (атома) с абсолютными давлением и температурой.
5.Как средняя квадратичная скорость частицы связана с абсолютной температурой?
§2.3. Уравнение состояния идеального газа
Умножим левую и правую части уравнения (2.4) на объём V , занимаемый рассматриваемым идеальным газом, тогда будем иметь
pV noVkT NkT , |
(2.6) |
61 |
|

где |
N n V число молекул в объёме V . Уравнение (2.6) связывает |
|
|
o |
|
три основных макропараметра газа |
p,V ,T (параметры его состояния) |
|
и называется уравнением состояния.
Число молекул N N A , где число молей в объёме V газа.
Его можно определить, если массу газа m поделить на массу одного моля M . Тогда
pV N |
kT |
m |
RT , |
(2.7) |
|
||||
A |
|
M |
|
|
|
|
|
|
где
R
N |
k |
A |
|
6,0241 10 |
23 |
|
1 моль
1,38 10 |
23 |
Дж |
|
|
К |
||
|
|
|
8,3145 |
Дж |
|
|
моль |
|||
|
К |
новая константа, называемая универсальной
газовой постоянной.
Уравнение состояния в форме (2.7) называется уравнением
Менделеева-Клапейрона1. Величина |
R |
R |
называется удельной |
|
M |
||||
|
|
|
газовой постоянной. Для разных газов она разная. Например, для
кислорода |
молярная |
|
масса |
|
|
MO |
2 16а.е.м. 0,032 |
|
кг |
, и |
||||||||||
|
|
|
|
моль |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
удельная газовая постоянная будет иметь значение |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
8,3145 |
Дж |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Дж |
|
|
|
|
|
|||||||
|
|
R |
|
|
|
|
|
|
моль К |
260 |
. |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
O |
2 |
|
|
|
|
|
|
кг |
|
кг |
К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,032 |
моль |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Аналогично для |
углекислого |
газа |
(молекула СО2) молярная |
|||||||||||||||||
масса M |
|
12 2 16 44 |
|
|
кг |
|
, и R |
189 |
Дж |
. |
|
|
||||||||
СO2 |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
кмоль |
CO2 |
|
кг К |
|
|
|
|
|||||
|
|
|
V |
|
м |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Величина v |
m |
|
|
|
называется удельным объёмом. Поделив |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
уравнение (7) на массу газа |
m , с учетом, что R |
R |
, получим |
|
||||||||||||||||
M |
|
|||||||||||||||||||
|
|
|
|
|
pv RT |
|
|
p RT , |
|
|
|
|
|
|
||||||
|
|
|
|
|
или |
|
|
|
|
|
|
(2.8) |
||||||||
1 Бенуа Поль Эмиль Клапейрон (1799 – 1864) – французский физик и инженер. В 1820 -30 гг. работал в России. С 1830 года член-корр. Петербургской АН.
62

где величина, обратная удельному объёму,
1 кг3
vм
называется
плотностью.
Уравнения (2.8) есть уравнения состояния для одного килограмма идеального газа. Их называют уравнениями Клапейрона.
Вопросы для самоконтроля
1.Какими основными параметрами характеризуется состояние газа?
2.Что такое уравнение состояния?
3.Запишите уравнения состояния одного килограмма идеального газа.
4.Определите удельную газовую постоянную для водорода.
§2.4. Термодинамические процессы в идеальном газе
Состояние идеального макропараметрами v , p и T .
газа полностью определяется его Под действием окружающей среды эти
параметры могут измениться. В этом случае газ из некоторого своего |
||||||||
состояния 1 с |
параметрами |
v |
, p |
,T |
перейдёт в |
состояние 2 с |
||
|
v |
|
,T . |
1 |
1 |
1 |
|
|
параметрами |
, p |
|
Этот |
переход |
называют |
|||
|
2 |
2 |
2 |
|
|
|
|
|
термодинамическим процессом. Математически он может быть описан пространственной кривой в трехмерной системе координат
v, p,T .
Но эти процессы могут протекать и так, что один из параметров будет оставаться неизменным. Можно выделить следующие частные
случаи термодинамических процессов.
1. Изотермный процесс (T const ). При этом из (2.8) имеем
pv RT const
или
p
const v
. Эта обратно пропорциональная
зависимость давления от удельного объёма на vp-диаграмме отобразится гиперболой 1→2 (рис 2.1). Из этой зависимости вытекает
соотношение |
p v |
p v |
2 |
, называемое законом Бойля-Мариотта. |
|
|
1 |
1 |
2 |
|
|
Кривую, описывающую изотермный процесс, называют изотермой. Если на vp-диаграмме построить несколько изотерм для различных значений абсолютной температуры, то они будут представлять собой непересекающееся семейство гипербол, и такую
63
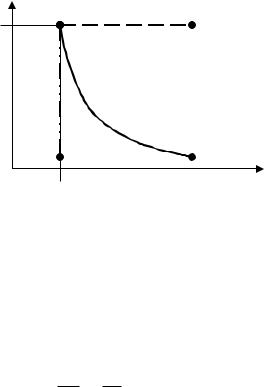
диаграмму можно будет использовать для определения по двум известным параметрам состояния значение третьего параметра.
p
p1
1 |
3 |
4 |
2 |
v
v1
Рис. 2.1
2. Изобарный процесс
(
p
const
). При этом из (2.8) имеем
v const T . Эта прямо пропорциональная зависимость удельного объёма от абсолютной температуры (при нагревании газ расширяется), которая на vp-диаграмме отображена пунктирной прямой 1→3, параллельной оси v (рис 2.1). Из этой зависимости
вытекает соотношение
v |
|
|
1 |
v |
2 |
|
|
T1 T2
, называемое законом Гей-Люссака.
На vT-диаграмме этот процесс будет представлен наклонной прямой с положительным угловым коэффициентом, т.к. удельный объём и абсолютная температура не могут принимать отрицательные значения. Линии, отображающие изобарный процесс на диаграммах в
различных координатах, называются изобарами.
3. Изохорный процесс ( v const ). При этом из (2.8) имеем
p const T . |
Эта |
прямо |
пропорциональная |
зависимость |
абсолютного давления от абсолютной температуры (при нагревании газа давление растёт). На vp-диаграмме этот процесс будет представлен штрих-пунктирной вертикальной прямой 1→3 (рис 2.1).
Из этой зависимости вытекает соотношение |
p1 |
|
T1 |
, называемое |
|
p2 |
T2 |
||||
|
|
|
законом Шарля.
На pT-диаграмме этот процесс будет представлен наклонной прямой с положительным угловым коэффициентом, т.к. абсолютное давление и абсолютная температура не могут принимать
64

отрицательные значения. Линии, отображающие изохорный процесс на диаграммах в различных координатах, называются изохорами.
Вопросы для самоконтроля
1.Что такое термодинамический процесс?
2.Что такое уравнение состояния?
3.На vp-диаграмме две изотермы. Объясните, почему эти две кривые не могут пересекаться.
4.Какая из двух изотерм на vp-диаграмме находится выше – та, которая соответствует более высокой температуре или более низкой?
§2.5. Уравнение Ван-дер-Ваальса
В реальных газах при высоких давлениях и низких температурах существенно начинают сказываться силы взаимодействия между молекулами и конечность объёма молекулы. В 1873 году Ван-дер- Ваальс1 предложил простое уравнение для неидеального газа
|
a |
|||
p |
|
2 |
(v b) RT |
|
|
v |
|
||
|
||||
(2.9)
В отличие от уравнения Клапейрона (2.8) в (2.9) имеются две
поправки. Поправка |
a |
учитывает |
уменьшение давления, |
|||
v |
2 |
|||||
|
|
|
|
|||
|
|
|
|
|
||
обусловленное взаимным |
|
притяжением |
молекул. Поправка |
b |
||
учитывает конечный объём молекул и силы отталкивания, возникающие между ними.
Уравнение Ван-дер-Ваальса является уравнением 3-й степени
относительно |
v и |
при различных |
постоянных значениях |
p и T |
|
может иметь |
либо |
один, либо |
три вещественных корня. Поэтому |
||
изотермы Ван-дер-Ваальса |
на |
vp диаграмме качественно |
|||
различны (рис. 2.2).
При высоких температурах
T1,
T |
, |
2 |
|
T3
,
которые выше
критической
Tk
,
изотермы являются монотонно убывающими
функциями. Чем выше температура, тем ближе такая кривая к гиперболе (изотерме идеального газа). Такие кривые имеют только
1 Ян Дидерик Ван-дер-Ваальс (1837 – 1923) – нидерландский физик, нобелевский лауреат 1910 года.
65
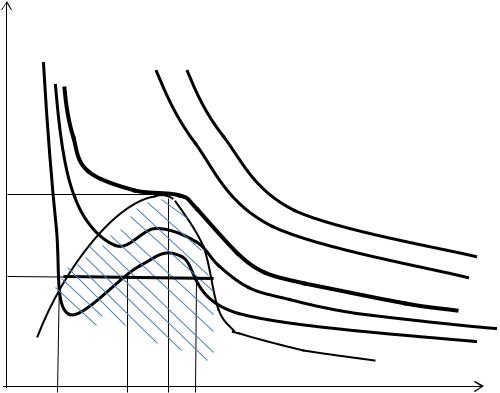
одну точку пересечения с прямыми
p
const
. Здесь уравнение (2.9)
при |
p const |
и T const |
относительно неизвестной действительный корень.
Tk v ,
становится кубическим уравнением у которого будет только один
p Па
a
|
|
Tk |
|
|
|
|
|
|
|
pk |
|
|
|
k |
|
|
|
|
|
вода |
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
T1 |
|
p5 |
a |
b |
|
c |
пар |
|
|
T2 |
|
|
|
смесь пара |
|
|
Tk |
|
|
||
|
e |
с кипящей |
|
|
|
T4 |
|
||
|
1 |
жидкостью |
|
c |
|
T5 |
|
||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
v1 |
v2 |
vk v3 |
|
|
м3/кг |
|
||
Рис. 2.2. Изотермы Ван-дер-Ваальса: T1 T2 T3 |
Tk T4 |
T5 |
|
||||||
При |
температурах |
T |
, T , которые |
ниже |
критической |
T |
, |
||
|
|
|
4 |
5 |
|
|
|
k |
|
изотермы уже не будут монотонно убывающими функциями. Их графики изгибаются, образуя волнообразный участок с одним
локальным минимумом (на рис. 2.2 для изотермы T5 этот минимум
отмечен точкой |
e ) и одним локальным максимумом (на рис. 2 для |
|
изотермы T5 |
это точка d ). Докритические изотермы с |
|
горизонтальными прямыми p const могут иметь уже три точки |
||
пересечения. При этом уравнение Ван-дер-Вальса при |
p const и |
|
T const Tk |
будет иметь уже три действительных |
корня для |
неизвестной величины v . Например, изотерма T5 (рис. 2.2) с прямой
66

p5 const |
пересекается |
в |
точках |
a, b |
и |
c . Следовательно, |
|||
неизвестная |
v будет иметь сразу три действительных корня: |
v a , |
|||||||
|
|
|
|
|
|
|
|
|
1 |
v |
b и v |
c . |
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
Между минимумом |
и |
максимумом |
|
волнообразного |
участка |
|||
любой докритической изотермы величина |
|
p |
0 . Однако, рост |
||||||
|
|
||||||||
|
|
|
|
|
|
|
v |
T |
|
|
|
|
|
|
|
|
|
|
|
давления с увеличением удельного объёма физически не возможен. Эксперимент показывает, что волнообразный участок aebdc докритической изотермы в реальности будет являться отрезком ac прямой, параллельной оси абсцисс. На этом участке вещество не может оставаться в виде гомогенной среды и распадается на две фазы: жидкую и газообразную. Этот распад идёт при постоянном давлении (по прямой p const ), то есть отрезок ac одновременно является
частью изобары и изотермы.
Положение этой прямой (изотермы-изобары) определяется правилом Максвелла1, согласно которому площади фигур aeba и bdcb (рис. 2.2) должны быть равны друг другу.
Следовательно, реальная изотерма будет иметь вид ломаной a acc . её левая ветвь a a, круто спадающая вниз, соответствует жидкому состоянию вещества, а правая пологая ветвь cc – газообразному. Переход вещества из жидкого состояния в газообразное и обратно происходит по прямому отрезку abc. Границы двухфазной области на рис. 2.2 показаны пунктирными линиями 1 и 2. Пограничная кривая 1 есть геометрическое место точек начал кипения жидкости и отделяет жидкую фазу от двухфазной области, а пограничная кривая 2 отделяет двухфазную область от газообразной. Эти пограничные кривые имеют общую верхнюю точку k , через которую проходит изотерма с температурой Tk .
Волнообразный участок (для изотермы T5 это участок aebdc) по мере увеличения докритической температуры будет уменьшаться, а по достижении Tk сольется в точку k . Это и будет та критическая точка, в которой критические параметры конкретного вещества
можно определить экспериментально. Поскольку точка k является точкой перегиба кривой Tk (критической изотермы), то в ней первая и вторая производные от функции будут равны нулю. Эти два
1 Джеймс Клерк Максвелл (1831 – 1879) – английский физик, создатель классической электродинамики (знаменитые уравнения Максвелла), один из основоположников статистической физики (распределение Максвелла).
67
