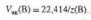- •1 Билет
- •Кислотные оксиды
- •Основные оксиды
- •Амфотерные оксиды
- •Кислоты
- •2 Билет
- •Основные свойства химических оксидов
- •Химические свойства кислотных оксидов
- •Химические свойства амфотерных оксидов
- •Химические свойства
- •3 Билет
- •Химические свойства оснований
- •Классификация:
- •Получение оснований:
- •Применение оснований:
- •4 Билет
- •5 Билет
- •Получение
- •Применение:
- •6 Билет
- •Классификация:
- •Химич.Свойства:
- •Получение солей:
- •Применение солей:
- •7 Билет фактор эквивалентности и молярная масса простых и сложных веществ
- •8 Билет фактор эквивалентности и молярная масса
- •9 Билет
- •10 Билет Принцип Паули
- •Правило Гунда
- •Принцип минимума энергии
- •11 Билет
- •12 Билет
- •Виды окислительно-восстановительных реакций
- •13 Билет
- •14 Билет
- •15 Билет
- •Следствия закона Гесса
- •16 Билет
- •17 Билет
- •18 Билет
- •Зависимость скорости реакции от концентрации веществ
- •19 Билет Энергия активации
- •Уравнение Аррениуса
- •20 Билет
- •Гомогенный катализ
- •Гетерогенный катализ
Применение солей:
хлорид кальция CaCl2 В быту можно получить нагреванием хлорной извести (хлорки). Он растворим в воде. Применяют для получения металлического кальция, для осушки и понижения точки росы технологического и импульсного газа на: В холодильном деле, медицине и т. д.; Ускоритель схватывания цемента; Как противогололёдное средство; Для обеспыливания гравийных дорог
Хлорид железа 3 FeCl3 Применяется как удаление верхнего слоя (протравка) при крашении тканей. Применяется для очистки воды.
Нитрат натрия Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придании огню желтого цвета.
Сульфат кальция CaSO4 В пищевой промышленности. CaCO3 – в природе встречается в виде мела, мрамора, известняка. Мел - применяют в цементной, стекольной, резиновой и др. отраслях промышленности. Мрамор — горная порода - разнообразен по окраске, нередко с красивым узором, хорошо принимает полировку. Декоративный и поделочный камень. Известняк - используется в металлургии, строительстве, химической промышленности и др.
7 Билет фактор эквивалентности и молярная масса простых и сложных веществ
Эквивалент- это реальная или условная частица которая может присоединять или замещать 1 ион водорода в кислотно-основных реакциях а в окислительно-восст. Реакциях присоединять или освобождать 1 электрон.
Фактор- это число обозначающее какая доль реальной частицы вещества эквивалента одному иону водорода в кислотноосновых реакциях или одному электрону в окислительно- вост-х реакциях.
F=1/B
Молярная масса- кг/моль это масса одного моля эквивалента равна произведению молярной массы вещества на фактор эквивалентности.
V=22,4*Mэ/M(Л/моль)
Закон эквивалентов- массы реагирующих веществ пропорциональны молярным массам эквивалентов этих веществ.
m1/m2 =M(э)/M(э)
m1/v=M1/v
Молярная масса эквивалента(МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
|
МЭ = М×fЭ. |
Молярная масса эквивалента вещества (Мэ) - это масса 1 моля эквивалента этого вещества (г/моль). Молярные массы эквивалентов простых и сложных веществ зависят от стехиометрии реакций, в которых участвуют эти вещества. Нахождение молярных масс эквивалентов:
1. Кислоты (общая формула кислот НnА)Мэ = Молярная масса кислоты/Число ионов Н+, замещенных в реакции.
2. Гидроксиды (общая формула Me(ОН) n) .Мэ = Молярная масса гидроксида/Число ионов ОН-, замешенных в реакции.
3. Соли ( общая формула МеmАn).Мэ = Молярная масса соли/(Число атомов Me · Валентность Me)
молярный объем эквивалента(![]() илиVЭ) –
объем, занимаемый молярной массой
эквивалента или объем одного моль
эквивалента.Размерность «л/моль». При
н.у. получаем:
илиVЭ) –
объем, занимаемый молярной массой
эквивалента или объем одного моль
эквивалента.Размерность «л/моль». При
н.у. получаем:
|
|
Объем химического эквивалента газообразного вещества В - VЭК(B) представляет собой отношение объема данного газа VВ к количеству вещества химического эквивалента вещества В:

Единица
измерения VЭК(В)
- л/моль. Поскольку для газов, принимаемых
условно за идеальные, nв =
VB/Vn, где
Vп =22,414
л/моль, то