
Дворецкий - Основы проектирования химических производств - 2005
.pdf
ВChemCAD широко представлены модули для осуществления проектного и поверочного расчетов кожухотрубчатых теплообменников, колонных аппаратов (тарельчатых и насадочных колонн ректификации и абсорбции нефтяных смесей, хемосорбции и др.), химических реакторов (идеального вытеснения (RFR) и смешения (CSTR)), аппаратов высокого давления, трубопроводов, нормально сужающих устройств (диафрагм) и регулирующих клапанов.
ВChemCAD имеются также средства для исследования и оптимизации статических и динамических режимов функционирования как отдельных химико-технологических аппаратов, так и всей химикотехнологической схемы; чувствительности выходных переменных этих аппаратов по отношению к входным переменным и возмущающим воздействиям.
4.6.2. ПРИМЕРЫ МАТЕМАТИЧЕСКИХ МОДЕЛЕЙ ПРОСТЕЙШИХ ТИПОВЫХ ПРОЦЕССОВ БИО- И ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
1. Модель процесса смешения потоков (рис. 47). Пусть в смеситель поступают два потока веществ, характеризующихся расходом Gj , вектором концентраций веществ cj,i и температурой tj .
cr1,G1,t1 |
|
|
|
Исходные |
|
данные: |
|
|
|
|
|
||||
|
|
cr,G ,t |
|
концентрации |
cj,i |
веществ |
|
cr2,G2,t2 |
|
|
|
во входных потоках, рас- |
|||
|
|
|
ходы G1 и G2 |
и температу- |
|||
|
|
|
|
ры t1 и t2 входных пото- |
|||
|
|
|
|
||||
|
|
|
|
ков. |
|
|
|
|
|
|
|
Требуется |
построить |
||
Рис. 47. Структурная схема |
математическую |
модель, |
|||||
позволяющую |
по |
исход- |
|||||
смесителя потоков |
|
||||||
|
ным данным рас- |
|
|||||
|
|
|
|
|
|||
считывать концентрации ci |
веществ и температуру t потока на выходе из смесителя. |
||||||
Примем следующие допущения: 1) внутри аппарата реализуется режим идеального смешения и отсутствуют источники (стоки) вещества и теплоты; 2) удельные теплоемкости компонентов j-го потока в зависимости от температуры tj рассчитываются по формуле
cpj,i = ai +bi tj + di t2j + ei t3j ,
где ai, bi, di, ei− эмпирические коэффициенты, найденные для каждого i-го вещества.
Составим общее уравнение материального баланса при смешении двух потоков веществ в смесителе и уравнения покомпонентного материального баланса:
G1 +G2 −G = 0;
c1,i G1 + c2,i G2 −ci G = 0, i =1, m,
где c1,i, c2,i,ci − массовые доли i-го вещества в потоках; m−число веществ в потоке.
Из последнего балансового уравнения можно рассчитать концентрации ci веществ на выходе из смесителя
ci = (c1,i G1 +c2,i G2)/G.
Далее составим уравнение теплового баланса для смесителя:
cp1G1t1 + cp2 G2 t2 − cp Gt = 0,
где cp − удельная теплоемкость потока рассчитывается по формуле

m
cpj = ∑cpj,i cj,i, j =1, 2. i=1
Из последнего балансового уравнения можно рассчитать температуру выходного потока
t = (cp1G1t1 + cp2 G2 t2)/(cp G).
Обратим внимание на нелинейность последнего уравнения, поскольку удельная теплоемкость выходного потока нелинейным образом зависит от температуры. Для его решения можно воспользоваться методом простой итерации:
t(ν+1) = (cp1(t1)G1 t1 + cp2(t2)G2 t2)/(cp(t(ν)) G),
где ν = 0, 1, 2,...− номер итерации.
В качестве условия окончания итерационного процесса (счета) можно использовать следующее условие t(ν+1) −t(ν) ≤ ε, а в качестве начального приближения принять
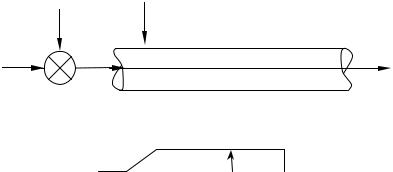
2. Модель процесса теплообмена, осуществляемого в кожухотрубчатом теплообменнике (рис. 48). В трубном пространстве одноходового кожухотрубчатого теплообменника охлаждается жидкость от температуры tн до температуры tк . Охлаждающая жидкость (хладагент) проходит противотоком по
межтрубному пространству с расходом Gх и начальной температурой txн .
Исходные данные: поверхность F теплообмена кожухотрубчатого теплообменника, коэффициенты
теплоотдачи α1 и α2 |
в трубном и межтрубном пространствах, толщина δi , теплопроводность λi стенки |
||
и слоев загрязнений, |
i = |
|
; расход G , начальная и конечные |
1,n |
|||
|
|
Рис. 48. Структурная схема теплообменника |
||||
|
температуры tн |
и tк , удельные теплоемкости сp и cpx охлаждаемой жидкости и хладагента, расход |
||||
Gx |
|
нGк,tк,crк |
|
|
||
и начальная температура tx |
хладагента. |
|||||
tx |
Требуется построить математическую модель, позволяющую рассчитывать температуру хладагента |
|||||
на выходе из теплообменника. |
|
|
rк |
|||
к |
н |
r |
|
к |
к |
|
|
Gх , tх , |
cх |
|
Gх |
, tх |
, cх |
|
Примем следующие допущения: 1) теплопередача не сопровождается изменением агрегатного со- |
|||||
стояния теплоносителей; 2) схема движения теплоносителей – противоток; 3) потери теплоты в окружающее пространство не учитываются.
Составим общее уравнениентепловогн rн о баланса для кожухотрубчатого теплообменника:
Gг ,tг ,cг
cp G(tн −tк)−сpx Gx (txк −txн) = 0.
Из последнего уравнения можно выразить величину tк :
|
tк −tн |
|
tк = tн − |
x x |
. |
|
||
|
cp G/cpx Gx |
|

Запишем теперь уравнение теплового баланса с учетом процесса теплопередачи через стенки труб теплообменника:
cp G(tн −tк)− KтF |
(t |
н |
−tк ) |
−(t |
к |
−t |
н ) |
|
= 0. |
||||||||
|
|
x |
|
|
|
|
x |
|
|||||||||
ln[(tн −tкx )/(tк −tнx )] |
|
||||||||||||||||
Если теперь в последнее |
уравнение |
|
|
подставить |
|
|
tк , то с учетом обозначений |
||||||||||
χ1 = сp G/(cpx Gx ), χ2 = KтF /(cp G) получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
tк = tн + (t |
|
|
−tн)χ |
|
exp(χ2(1−χ1))−1 |
. |
||||||||||
|
|
|
|
|
|
||||||||||||
|
x x |
н |
x |
1 exp(χ |
2 |
(1−χ ))−χ |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
||
Коэффициент теплопередачи Kт |
рассчитывают по формуле |
|
|
|
|
||||||||||||
|
Kт = |
|
|
|
|
|
1 |
|
|
|
|
|
, |
|
|
|
|
|
1/α1 + ∑δi /λi +1/α2 |
|
|
|
|
||||||||||||
i
где α1, α2 − коэффициенты теплоотдачи в трубном и межтрубном пространствах [Вт/м2 К]; δi и λi – толщина и теплопроводность стенки и слоев загрязнений, i =1,n ; λ ~ [Вт/м К].
Значения коэффициентов теплоотдачи зависят от гидродинамической и тепловой обстановки около теплообменной поверхности и в общем случае определяются на основе экспериментальных исследований, обобщаемых в виде корреляционных соотношений между критериями подобия: Нуссельта, Пекле, Прандтля, Рейнольдса, Галилея, Грасгофа [52].
3. Модель периодического процесса растворения смеси полидисперсных частиц [53]. Предпо-
ложим, что начальные значения массы непористых сферических частиц различны, растворение частиц не сопровождается тепловым эффектом, а кинетика растворения отдельной частицы описывается уравнением вида
|
dm |
= f (m,cy ) = −kр χ(cун − cy )m23 |
; |
(4.61) |
|
|
|||
|
dt |
|
|
|
m(0) = m0 , |
|
|
||
где m– масса частицы; kр − эмпирический коэффициент растворения, kр = a1 [∆ρD2 /µ ]1/3 ; |
a1 − эмпириче- |
|||
ская константа; ∆ρ− разность плотностей твердого материала и растворителя; D − коэффициент диффузии; µ− коэффициент динамической вязкости; cун, cу – концентрация насыщения и фактическая концентрация основной массы раствора; χ – коэффициент формы частицы (для шарообразной частицы
χ = 3 36π/ρ2 ).
Исходные данные: плотность распределения Р(m0) массы m0 частиц в начальный момент времени,
общая начальная масса М0 частиц, загруженных в аппарат, объем Vy растворителя в аппарате, концентрация су раствора в начальный момент времени, константа kр растворения и концентрация сун насыщения.
Требуется построить математическую модель, позволяющую по исходным данным рассчитывать зависимости концентраций су (t) раствора и общей массы М(t) нерастворившихся частиц от времени.
Запишем уравнение кинетики состояния среды, которое при сделанных выше допущениях сводится к уравнению материального баланса

Vy dcy = − ∫Р0(m0) f [m(m0,t),cy]dm0 =
dt
(m0)
∞ |
|
|
|
|
∫ |
|
|
1 |
/3 |
= kрχ(cyн −cy) P0(m0) |
|
|||
m0 |
|
|||
m0 |
|
|
|
|
|
1 |
t |
2 |
|
|
− |
kр χ ∫ [cyн −cy(t1)]dt1 |
|
dm0; (4.62) |
||
3 |
|||||
|
0 |
|
|
||
|
|
|
|
cy(0) = c0y ,
где |
|
частиц в начальный момент времени, |
|
P0(m0)− ненормированная плотность распределения массы m0 |
|||
|
|
|
∫m0 P0(m0)dm0. |
P0(m0) = N0 P0(m0), N0 − число частиц, поступивших в аппарат, N0 = M0 / |
|||
|
|
|
(m0 ) |
При решении этого уравнения необходимо учитывать, что масса m частицы может быть отрицательной, что эквивалентно условию
t
m1/0 3 ≥ 13kр χ∫ [cyн −сy(t1)]dt1.
0
Поскольку масса вещества в растворе увеличивается только за счет уменьшения массы частиц при их растворении, то общая масса частиц, находящихся в аппарате в момент времени t , рассчитывается по формуле
M(t) = M0 −Vy [cy(t)−cy(0)]. |
(4.63) |
Приведенная модель (4.61) – (4.63) периодического процесса растворения относится к классу динамических нелинейных моделей с сосредоточенными координатами. Для определения зависимости су (t) необходимо вначале одним из численных способов, например, методом Рунге-Кутта четвертого порядка, решить нелинейное дифференциальное уравнение (4.62). При этом на каждом шаге интегрирования системы также численным способом, например, методом Симпсона, вычисляются значения определенных интегралов. После этого по соотношению (4.63) можно рассчитать М(t).
4. Модель непрерывного процесса растворения монодисперсных частиц [3]. Предположим, что на вход аппарата подаются частицы одинаковой массы m0, их растворение не сопровождается тепловым эффектом, а кинетика растворения частиц описывается уравнением (4.61).
Исходные данные: Gxвх, Gy, m0, cвхy – соответственно расходы твердой фазы и растворителя, масса от-
дельной частицы, концентрация раствора на входе в аппарат; kр – константа растворения; сун – концентрация насыщения и Vу – объем растворителя, находящегося в аппарате.
Требуется построить математическую модель, позволяющую по исходным данным рассчитывать концентрацию су раствора, плотность распределения массы P(m) и общую массу Gxвых частиц, выгру-
жаемых из аппарата в единицу времени.
Запишем уравнение материального баланса, описывающее состояние среды:
m0 |
|
|
Gy (cy −cвхy ) = ∫ |
P [α(m)]dm , |
(4.64) |
0 |
|
|
где P (α ) – ненормированная плотность распределения возраста α частиц в аппарате. Для режима идеального смешения имеем
|
(4.65) |
P (α) = n0 exp(−α/Θ), |
где Θ =Vy /Gy – среднее время пребывания частиц в аппарате, n0 = Gxвх /m0 – число частиц, поступающих в
аппарат в единицу времени.
Массовый расход частиц, покидающих аппарат, можно определить из соотношения
Gвых = Gвх +G |
y |
(cвх −c |
) . |
(4.66) |
|
x |
› |
y y |
|
|
|
Плотность распределения массы частиц на выходе из аппарата удовлетворяет при 0 < m < m0 соотношению
|
|
P[α(m)] |
= [Θkр χ(cyн −сн)m2/3]−1 |
|
1/3 |
1/3 |
|
|
P(m) = |
|
×exp − |
3(m0 |
− m |
. |
|||
|
|
|
|
|||||
|
|
f (m, c |
) |
|
|
Θkр χ(cyн −cy) |
||
|
|
y |
|
|
|
|
|
|
Приведенная модель (4.61), (4.64) – (4.66) относится к классу статических нелинейных моделей с сосредоточенными координатами.
5. Модель химического процесса конверсии оксида углерода. В каталитическом трубчатом реакто-
ре (рис. 49) осуществляется экзотермическая обратимая химическая реакция
W
CO+H2O CO2 + H2 + h(T)↑ ,
где h(T)− тепловой эффект реакции.
Скорость химической реакции W описывается выражением вида
|
|
|
|
|
|
|
|
|
|
|
|
|
c c |
H2O |
− k−1(T)c |
c |
||
|
|
|
|
|
|
|
|
|
|
|
W = k(T) |
CO |
р |
|
H2 CO2 |
, |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
A(T)cH2O + cCO2 |
|||||
где cCO, cH2O, cH2 , cCO2 , cи.г − концентрации оксида углерода, |
воды, водорода, двуокиси углерода и инерт- |
|||||||||||||||||
ных газов, соответственно; |
k(T), A(T), kр−1(T)− кинетические параметры, зависящие от температуры T : |
|||||||||||||||||
|
|
|
|
|
|
2240 |
|
|
|
|
|
|
|
|
|
|
||
kр−1 |
(T) = exp 2,3 |
|
|
+ 0,62 |
10−3 |
T + 0,1 10−6 T2 |
− 2,62 ; |
|
|
|
|
|||||||
T |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
r(0) |
|
(0) |
|
(0) |
|
|
|
|
r |
|
|
|
d R |
|
|
|
|
|
c |
,G |
|
,t |
|
|
|
|
|
c,G,t |
|
сco,t |
|
сco + dсco , t + dt |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Рис. 49. Структурная схема химического реактора и элемента каталитического трубчатого реактора
для железохромового катализатора имеем:
lgk = −34 000/(4,57T)+10,2, lg A = −8800/(4,57T)+3/32;
для цинкохроммедного катализатора:
lgk = −34 000/(4,57T)+12,98, lg A = −8800/(4,57T)+3,48.
Температурные зависимости теплового эффекта реакции h(T) и удельной теплоемкости cp(T) описываются следующими уравнениями:
h(T) =10 000+ 0,219T − 2,845 10−3 T2 + 0,967 10−6 T3;
cp(T) = ∑m (ai +bi T + di T2 + ei T3).
i=1
Исходные данные: концентрации cCO(0) , cH(0)2O, cH(0)2 , cCO(0) 2 , cи(0).г оксида углерода, воды, водорода, двуокиси углерода и инертных газов на входе в реактор; плотность ρi и концентрация (объемные доли) ci i-го компонента; массовый расход G потока веществ; температура T(0) потока на входе в реактор; тепловой эффект реакции h , удельная теплоемкость cp потока веществ в реакторе, кинетические параметры k(T), A(T), kр−1(T).
Требуется построить модель химического процесса, осуществляемого в каталитическом реакторе конверсии оксида углерода (рис. 49), позволяющую рассчитывать температуру и концентрации веществ в каждой точке и на выходе реактора.
Примем следующие допущения: 1) химический процесс осуществляется в адиабатическом трубчатом каталитическом реакторе; 2) режим движения газовой смеси в слое катализатора соответствует режиму идеального вытеснения.
Выберем в качестве ключевого компонента оксид углерода CO и составим по этому компоненту уравнение материального баланса:
|
|
c |
|
|
|
G |
−(с + dc |
CO |
) |
G |
|
−W(c , T) dV = 0 , |
||||||||||||
|
|
|
|
|
|
ρ |
|
|
||||||||||||||||
|
|
|
CO ρ |
г.с |
CO |
|
г.c |
|
CO |
|
|
|
р |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где ρг.с = ∑ρi ci − плотность парогазовой смеси; |
ρi − плотность i-го компонента; сi − концентрация (объ- |
|||||||||||||||||||||||
i=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
емные доли) i-го компонента; G/ρг.с − объемный расход потока; Vр − объем реактора. |
||||||||||||||||||||||||
Учитывая, что |
dτ = |
dVр |
|
− условное время контакта в слое объемом dVр и выполнив предель- |
||||||||||||||||||||
(G/ρг.с) 3600 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
ный переход, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
dc |
|
c |
|
c |
H |
O |
− k−1c |
H |
|
c |
|
|
||||||
|
|
|
|
|
|
|
CO |
|
p |
|
2 |
CO |
2 |
|||||||||||
|
|
|
|
|
|
|
CO |
|
|
|
|
2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
= k(T) |
|
|
|
|
|
|
|
, |
||||||||
|
|
|
|
|
|
|
dτ |
|
A(T)c |
H2O |
+ c |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2 |
|
|
||||
cCO(0) = cCO(0) .
Далее составим уравнение теплового баланса
c |
G |
T +W (c , T) h(T)d |
Vр |
−c |
G |
(T + dT) = 0 |
|
|
|||||
V |
CO |
V |
|
|||
|
ρг.с |
|
|
|
ρг.с |
|
и, осуществляя предельный переход, получим
dT |
= |
h(T) |
= |
|
|
|
h(T) |
|
|
|
|
|
, |
||
dτ |
cV W(cCO, T) |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
c c |
H2O |
− k−1c |
H2 |
c |
CO2 |
|
||||||
|
|
|
|
c k(T) |
CO |
|
|
p |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
V |
|
A(T) cH |
|
O + cCO |
|
|
|||||
|
|
|
|
|
2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|||
T(0) =T(0).
Концентрации водяного пара, водорода, двуокиси углерода и инертных газов рассчитываются из уравнений материального баланса концентраций веществ по известной концентрации ключевого компонента:
c |
H2O |
= c(0) |
|
−(c(0) |
−c |
CO |
) = c |
(0) |
− ∆c ; |
|||||
|
H2O |
|
CO |
|
|
|
|
|
|
H2O |
CO |
|||
|
|
|
c |
H2 |
= c(0) |
− ∆c |
CO |
; |
|
|
||||
|
|
|
|
|
H2 |
|
|
|
|
|
|
|||
|
|
c |
CO2 |
= c(0) |
|
− ∆c |
CO |
; |
|
|||||
|
|
|
|
CO2 |
|
|
|
|
|
|||||
cи.г=1−(cCO + cH2O +cH2 + cCO2 ).
Таким образом, математическая модель химического процесса конверсии оксида углерода представляет собой статическую модель с распределенными по длине реактора концентрациями веществ с и температурой T и выражается системой нелинейных дифференциальных уравнений в обыкновенных производных с начальными условиями, решение которой можно получить, например, методом РунгеКутта четвертого порядка точности.
6. Математическая модель непрерывного процесса диазотирования ароматических аминов в производстве азопигментов. Перечень наиболее вероятных реакций, протекающих при диазотировании ароматических аминов нитритом натрия, и уравнения кинетики процесса диазотирования приведены ниже.
Диазотирование (реакция экзотермическая)
растворение твердой фазы амина в среде соляной кислоты
[ArNH2]s W1→ArNH2 ;
образование диазотирующего агента (HNO2)
W =∞ |
+ NaCl ; |
NaNO2 + HCl →HNO2 |
целевая реакция диазотирования
ArNH2 + HNO2 + HCl W2 →ArN2Cl + 2H2O + h (T) ↑ ;
разложение азотистой кислоты
3HNO2 W3→ 2NO + HNO3 + H2O ;
образование диазосмол
ArN2Cl + HNO2 W4 → χ1 ;
разложение диазосоединения с образованием диазосмол
ArN2Cl W5→ χ2 ;
образование диазоаминосоединений
ArN2Cl + ArNH2 W6→Ar2N3H + HCl.
5. Уравнения кинетики и кинетические константы процесса диазотирования
|
ре- |
Предэкспо- |
Энергия |
|||||
|
|
ненци- |
||||||
Кинетиче- |
Порядок акции |
|
активации, |
|||||
альный мно- |
||||||||
ское уравнение |
|
|
|
|
|
3 n- |
Дж/моль 1 |
|
|
|
житель, (м ) |
0 |
–3 |
||||
|
|
1 |
/моль |
n-1 |
/с |
|
||
|
|
|
|
|
|
|
||
W2 = |
2 |
|
3,75 10 |
5 |
46,82 |
|||
k2(T) [ArNH2] [HNO2] |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
W3 = k3(T) [HNO2]4 / PNO2 |
4 |
7,17 1021/(9,81 1 |
119,65 |
|||||
|
|
|
04)2 |
|
|
|
|
W4 |
= |
2 |
0,32 10 |
5 |
|
63,69 |
|
k4(T) [ArN2Cl] [HNO2] |
|
|
|
||||
|
|
|
|
|
|
||
W5 |
= k5(T) [ArN2Cl] |
1 |
1,10 1010 |
|
87,15 |
|
|
|
Обозначения: А – ArNH2 (амин); АК – HNO2; |
СК – HCl; σ – NO; D – ArN2Cl (диазосоединение); |
|||||
χ = (χ1, χ2) ; PNO – парциальное давление нитрозных газов; r – радиус частицы амина; l – текущая координата длины реактора; c*A – равновесная концентрация амина; ρA, MA – плотность и молекулярная масса
амина; ψ (r, l) – ненормированная плотность распределения числа N частиц амина по размеру, т.е.
ψ = dN/dr; Gl,GS,GN – расходы жидкой и твердой фаз суспензии амина и нитрита натрия; Sтр – площадь поперечного сечения трубы реактора; cp – теплоемкость; ϑ – скорость потока; K – коэффициент тепло-
передачи; h – тепловой эффект реакции; индексы: (0) – вход в реактор; х – хладагент; (i) – точка распределенного по длине ввода реагентов в реактор.
На рис. 50 представлены трубчатые турбулентные аппараты, позволяющие осуществлять процессы тонкого органического синтеза с твердой фазой в высокотурбулентных потоках.
Схема материальных потоков в трубчатом реакторе приведена на рис. 51.
При составлении уравнений математической модели примем следующие допущения: 1) реакция диазотирования протекает в растворе и диазоаминосоединение в процессе диазотирования не образуется, т.е. W6 = 0; 2) гидродинамические режимы течения реакционной смеси и хладагента близки к режиму
идеального вытеснения; 3) реактор является объектом с распределенными только по длине l координатами, скорость потока ϑ(l) = const; 4) потери тепла в окружающую среду пренебрежимо малы;
5) теплофизические характеристики принимаются постоянными в рабочем диапазоне температур; 6) форма кристаллов амина близка к сферической.
II |
|
III |
|
I |
|
|
IV |
|
|
|
а) |
|
B |
α |
D |
|
|
d/2 |
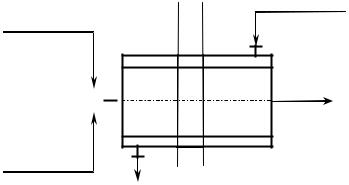
Рис. 50. Малогабаритные турбулентные трубчатые реакторы:
а – цилиндрического типа; б – диффузор-конфузорного типа; в – комбинированного типа;
dL – диаметр диффузора, d – диаметр конфузора; I, II, III, IV – потоки веществ
c(A0), cCK(0) , Gl(0) GS(0),ψ(0,r),T(0)
cолянокислая суспензия амина 

cN(0)GS(0),TN(0)
водный раствор |
G |
|
l1 l2 |
нитрита натрия |
x |
,T0 |
|
|
|
x |
Gx,TxL
хладагент
Ge(L),GS (L), cD(L),cAK (L)
cN(0),GN(0),TN(0)
раствор
диазосоединения
Рис. 51. Схема материальных потоков
втрубчатом реакторе диазотирования:
ψ(r) – гранулометрический состав; х – хладагент; l – жидкая фаза; S – твердая фаза; σ, χ – нитрозные газы и диазосмолы, соответственно
С учетом принятых обозначений и допущений составим уравнения материального покомпонентного баланса на участке трубы (l1, l2 ) за промежуток времени (t1,t2 ) например, по растворенному амину:
t2 |
[cA(l2)−cA(l1)]dt + S |
t2 l2 |
|
|
|
|
|
||||||
Gl ∫ |
∫∫ |
W2(cA, cAK ,T)− |
|
|
|||||||||
t |
|
|
|
|
|
|
t |
l |
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
MA |
∞ |
|
|
|
|
|
l2 |
|
|
|
|
|
|
∫ |
|
|
|
|
|
|
∫ |
|
|
|
|
|
− |
1 |
|
ψ(ξ, r) W (c |
A |
,T) dr dξdt = S |
|
[C(ξ, t |
2 |
)−C(ξ, t )]dξ. |
|||
|
|
|
|
||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
1 |
||
|
|
|
0 |
|
|
|
|
|
l1 |
|
|
|
|
Пользуясь теоремой о среднем, получим равенство
|
[c |
|
|
|
|
|
|
|
|
(l )] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
(l |
|
)−c |
|
|
|
∆t + S W (c |
|
, c |
|
,T)− |
|
|
|
|
||||||||
t |
A |
|
2 |
|
|
|
A |
1 |
|
t=t3 |
|
|
|
2 |
A |
|
AK |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
∞ |
|
|
|
|
|
|
|
|
|
|
∆l∆t = S[c(ξ,t |
|
)−c(ξ,t )] |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
− |
|
|
∫ |
ψ(ξ, r)W (c |
A |
,T)dr |
|
|
|
|
|
∆l, |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
M |
|
|
|
|
|
1 |
|
|
|
ξ=l4 |
|
|
|
2 |
1 |
|
ξ=l3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
A 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t=t4 |
|
|
|
|
|
|
|
|
которое при помощи теоремы о конечных приращениях можно преобразовать к виду
G |
∂cA(l,t) |
|
|
∆t∆l + S |
|||
|
|
||||||
∂l |
|||||||
l |
|
l=l5 |
|
|
|||
|
|
|
t=t3 |
|
∞ |
||
|
|
|
|
1 |
|
||
|
|
− |
|
∫ψ(ξ, |
|||
|
|
M |
|
||||
|
|
|
|
A 0 |
|||
|
|
|
|
|
|||
Переходя к пределу при l1, l2 → l |
и t1,t2 |
||||||
|
|
|
, c |
|
,T)− |
|
|
|
||
W (c |
A |
AK |
|
|
|
|||||
|
2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
r) W (c |
|
|
|
|
|
∆l∆t = S∂c(l,t) |
|
∆l∆t. |
||
|
|
|
|
|
||||||
|
|
|
|
|
||||||
A |
,T)dr |
|
|
|||||||
|
1 |
|
|
|
|
|
∂t |
|
l=l3 |
|
|
|
|
|
|
|
|
ξ=l4 |
|
|
t=t5 |
|
|
|
|
|
|
|
t=t4 |
|
|
|
→t , получим уравнение
|
∂cA |
|
1 |
|
∞ |
∂c |
|
|
ϑ |
|
+W2 (cA, cAK ,T)− |
|
|
∫ψ(l, r) W1(cA,T)dr = |
∂t |
; |
(4.67) |
∂l |
M |
|
||||||
|
|
|
|
A 0 |
|
|
|
|
cA(l, 0) = cA0(l); |
cA(0, t) = c(A0)(t). |
|
|
|
|
|
|
|
Аналогичным образом можно получить уравнения динамики трубчатого реактора и для других компонентов реакционной смеси:
• по азотистой кислоте (АК):
ϑ |
∂cAK |
+W |
(c |
A |
, c |
AK |
,T)+W |
(c |
AK |
,T)+W |
(c |
AK |
, c |
D |
,T) = |
∂cAK |
; |
(4.68) |
|
|
|||||||||||||||||
|
∂l |
2 |
|
|
3 |
|
4 |
|
|
|
∂t |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
cAK (l, 0) = cAK0(l); cAK (0, t) = cN(0)GN(0)(t)/Gl(0)(t);
•по диазосоединению (D):
ϑ |
∂cD |
|
−W2(cA, cAK ,T)+W4(cAK , cD,T)+W5(cD,T) = |
∂cD |
; |
(4.69) |
∂l |
|
|||||
|
|
∂t |
|
|||
cD (l, 0) = cD0(l); |
cD (0, t) = cD(0)(t); |
|
|
|
||
• по продуктам разложения (σ, χ) :
