- •Предисловие
- •В результате изучения дисциплины студент должен:
- •1. Общая характеристика дисциплины
- •1.1. Общая характеристика курса
- •1.2. Профиль специальности
- •1.3. Назначение специалиста
- •1.4. Основные требования, предъявляемые к специалисту
- •1.5. Три аспекта энергетики
- •1.6. Значение энергетики в техническом прогрессе
- •Контрольные вопросы:
- •2. Энергетические ресурсы земли и их использование
- •2.1. Использование энергетических ресурсов
- •2.2. Виды энергоресурсов и их запасы
- •Контрольные вопросы:
- •3. Современные способы получания электрической энергии
- •3.1. Основные законы, на которых базируется современная наука и техника (законы сохранения материи и энергии)
- •3.2. Рабочее тело и его основные параметры
- •3.3. Процессы изменения состояния газа изотермические, адиабатические
- •3.4. Цикл Ренкина
- •3.5. Тепловые конденсационные электрические станции
- •3.6. Теплоэлектроцентрали
- •3.7. Газотурбинные установки
- •3.8. Парогазовые установки
- •3.9 Гидравлические электростанции
- •3.10. Гидроаккумулирующие электростанции
- •3.11. Приливные электростанции
- •3.12. Атомные электрические станции
- •Контрольные вопросы:
- •4. Возможные способы преобразования различных видов энергии в электрическую
- •4.1. Необходимость в развитии способов преобразования энергии в электрическую
- •4.2. Магнитогидродинамическое преобразование энергии
- •4.3. Термоэлектрические генераторы
- •4.4. Радиоизотопные источники энергии
- •4.5. Термоэмиссионные генераторы
- •4.6. Электрохимические генераторы
- •4.7. Геотермальные электростанции
- •4.8. Использование морских возобновляющихся ресурсов
- •4.9. Солнечные электростанции
- •4.10. Использование энергии реакторов-размножителей и термоядерных реакций
- •4.11. Новые способы получения электроэнергии
- •Контрольные вопросы:
- •5. Потребление электрической энергии
- •5.1. План гоэлро
- •5.2. Использование электрической энергии в народном хозяйстве
- •5.3. Энергетика и общество
- •5.4. Понятие об электроэнергетической системе
- •5.5. Принципы работы и конструктивное выполнение основных элементов электроэнергетической системы
- •5.6. Развитие энергетических систем и электрических сетей в России
- •5.7. Развитие электрических сетей за рубежом
- •5.8. Классификация передовых технических решений в сфере передачи электроэнергии
- •Контрольные вопросы:
- •6. Передача энергии на расстояние
- •6.1. Преимущества объединения энергетических систем
- •6.2. Управление энергетическими системами
- •Контрольные вопросы:
- •5. Назовите основные преимущества объединенной энергетической системы
- •7. Влияние техники и энергетики на биосферу
- •7.1. Энергетика и окружающая среда
- •7.2. Охрана природы
- •7.3. Биосфера и технический прогресс
- •7.4. Развитие энергетической техники и ее влияние на окружающую среду
- •Контрольные вопросы:
- •Заключение библиографический список
- •Содержание
- •Валиуллина Дилия Мансуровна Зимняков Сергей Андреевич Козлов Владимир Константинович
- •140400 «Электроэнергетика и электротехника»
4.5. Термоэмиссионные генераторы
Явление термоэлектронной эмиссии было открыто Т. Эдисоном в 1883 г. Работая над созданием электрической лампы, Эдисон помещал в колбе две нити. Когда перегорала одна из них, он поворачивал лампу и включал другую. Во время испытания ламп обнаруживалось, что некоторое количество электричества переходит к холодной нити, т. е. электроны «испаряются» с горячей нити — катода — и движутся к холодной нити — аноду — и далее во внешнюю электрическую цепь. При этом часть тепловой энергии, расходуемой на нагревание катода, переносится электронами и отдается аноду, а часть энергии электронов выделяется во внешней электрической цепи при протекании электрического тока.
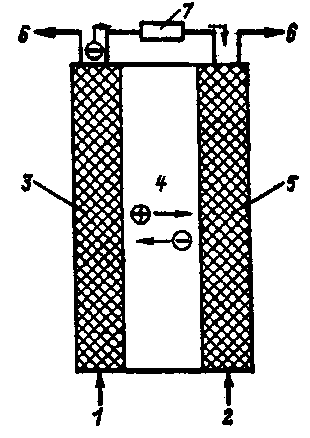
Анод разогревается за счет теплоты, приносимой электронами. Если бы температуры катода и анода были одинаковыми, то теплота «испарения» электронов с катода в точности была бы равна теплоте «конденсации» электронов на аноде и не было бы преобразования теплоты в электрическую энергию. Чем меньше температура анода по сравнению с температурой катода, тем большая часть тепловой энергии превращается в электрическую. Простейшая схема термоэмиссионного преобразователя энергии показана на рис. 4.5.
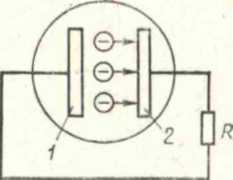
Рис. 4.5. Устройство схема термоэмиссионного преобразователя энергии: 1 – катод; 2 – анод
В процессе термоэлектронной эмиссии с поверхности металлов происходит выход свободных электронов. В металлах содержится большое число свободных электронов — около 6-1021 в 1 см3.
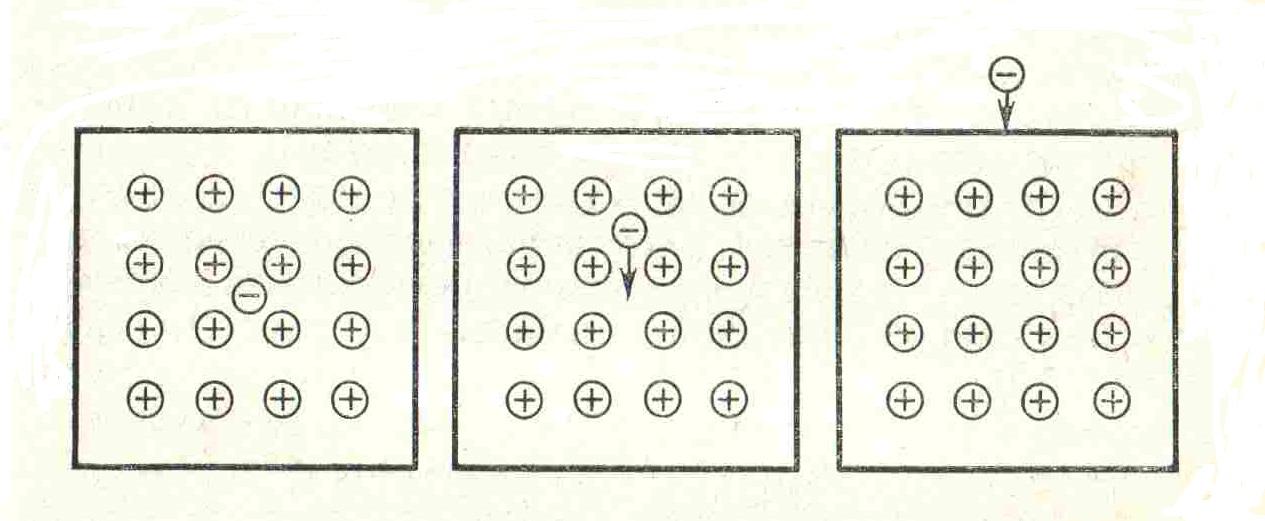
Рис. 4.6. Возникновение результирующих сил, действующих на электрон в металле и вблизи его поверхности
Внутри металла силы притяжения электрона сбалансированы положительно заряженными ядрами (рис. 4.6). Непосредственно у поверхности на электроны действуют результирующие силы притяжения, для преодоления которых и выхода за пределы металла электрону нужно обладать достаточной кинетической энергией. Увеличение кинетической энергии происходит при нагревании металла.
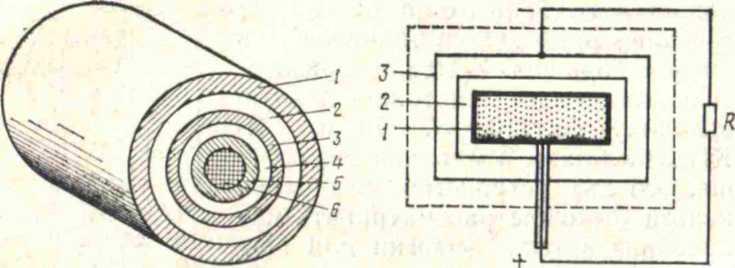
В энергетических термоэмиссионных генераторах для нагревания катода можно воспользоваться теплотой, получаемой в результате ядерной реакции. Схема ядерного термоэмиссионного преобразователя приведена на рис.4.7. КПД первых таких преобразователей был равен примерно 15%; по существующим прогнозам его можно довести до 40%.
|
Рис. 4.7. Ядерный термоэмиссионный преобразователь: 1 — защита; 2 — охладитель; 3 — анод; 4 — вакуум; 5 — катод; 6 — ядерное горючее
|
Рис. 4.8. Схема установки прямого преобразования ядерной энергии в электрическую: 1 — (β-радиоактивный излучатель; 2 — металлическая ампула; 3 — металлический сосуд |
Испускание электронов в термоэмиссионных генераторах вызывается нагреванием катода. При радиоактивном распаде электроны (β-лучи) испускаются вследствие естественного свойства элементов. Непосредственно используя это свойство, можно осуществить прямое преобразование ядерной энергии в электрическую (рис. 4.8).
4.6. Электрохимические генераторы
Электрохимическим генератором (рис. 4.9) или топливным элементом (ТЭ) называется устройство, в котором происходит преобразование химической энергии окислителя и топлива (восстановителя), непрерывно поступающих извне к электродам, в электрическую энергию. Суммарная химическая реакция, протекающая в ТЭ, называется токообразующей реакцией.
В топливном элементе не происходит прямого взаимодействия молекул окислителя и восстановителя, а реакция осуществляется в виде двух сопряженных процессов:
1) электрохимического окисления топлива с отдачей электронов;
2) электрохимического восстановления окислителя.
Из исходных веществ получается тот же продукт, что и при химической реакции горения, однако в ТЭ возникает электрический ток, т. е. химическая энергия превращается в электрическую. Для осуществления процессов суммарной реакции необходимо отделить окислитель от восстановителя, обеспечить направленное движение ионов и электронов. Эти функции выполняет ТЭ: на одном из электродов ТЭ — аноде — происходит электрохимическое окисление топлива, на втором — катоде — электрохимическое восстановление окислителя.
|
|
|
Рис. 4.9. Электрохимический генератор: 1 - Подвод топлива, 2 - Подача окислителя, 3 – анод, 4 - Ионный проводник, 5 – катод, 6 – отвод продуктов реакции, 7 – нагрузка |
В разработанных в настоящее время топливных элементах нашли практическое применение лишь два восстановителя: водород и гидразин.
Основным окислителем в ТЭ служит кислород воздуха или чистый кислород и лишь в некоторых ТЭ — пероксид водорода.
Ионный проводник обеспечивает движение ионов и разделение окислителя и восстановителя. В качестве ионных проводников ТЭ нашли применение водные растворы электролитов, ионообменные мембраны, расплавленные и твердые электролиты. Наиболее высокую электрическую проводимость в водных растворах имеют щелочи и кислоты. Поэтому в качестве ионного проводника применяются растворы КОН, Н2S04 и Н3Р04.
Химические источники тока — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
По возможности или невозможности повторного использования химические источники тока делятся на:
гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).