
- •КИНЕТИКА
- •Основные понятия
- •МОЛЕКУЛЯРНОСТЬ
- •МОНОМОЛЕКУЛЯР
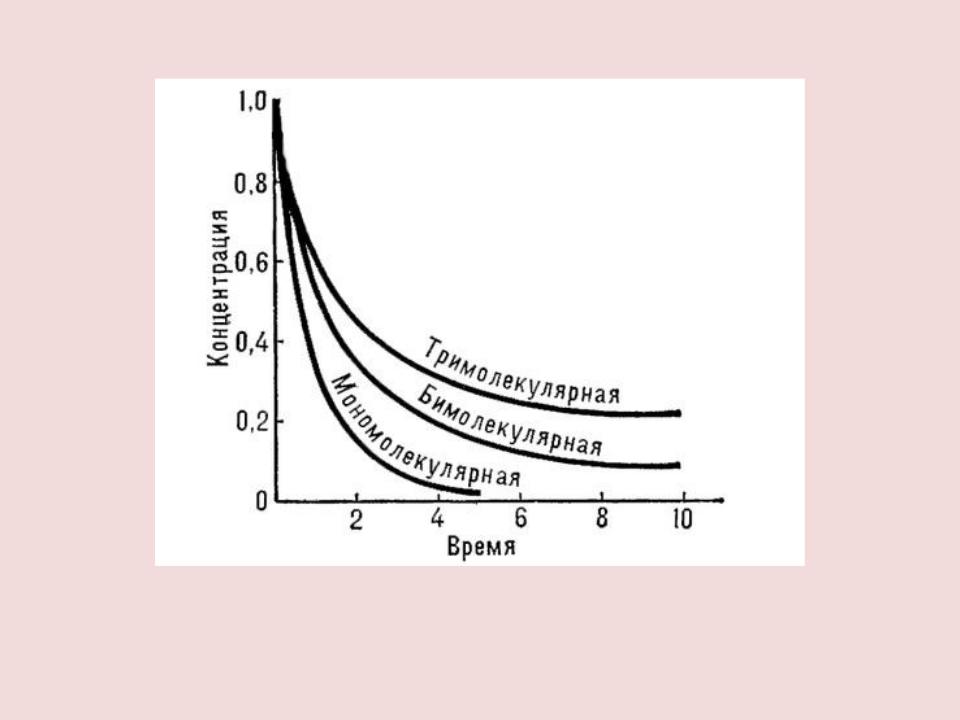
- •ПОРЯДОК РЕАКЦИИ
- •Скоростью химической
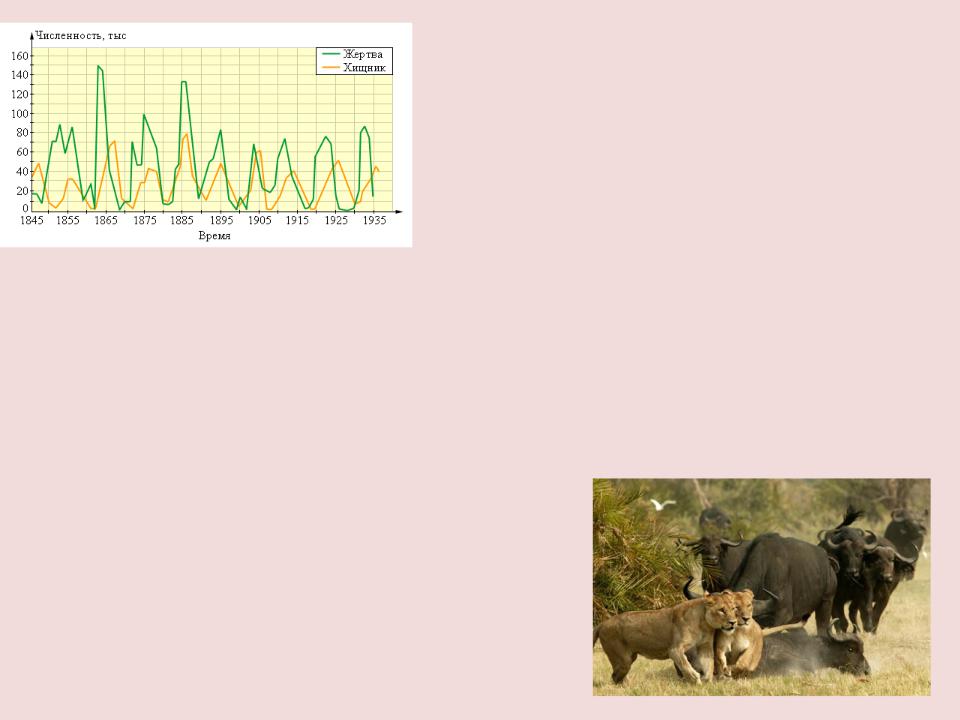
- •К.М.ГУЛЬД П.ВАА БЕРГ, ГЕ
- •Вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству
- •Опыты Г.Дейла
- •ПРОДУКТЫ РАДИОЛИЗА ВОДЫ
- •«Эффект разведения». Зависимость степени инактивации фермента или вируса от концентрации его в растворе
- •Определение константы
- •Выражение для b найдем из условия закрытости системы
- •Т.Мальтус
- •СКОРОСТЬ РЕАКЦИИ ВТОРОГО ПОРЯДКА
- •1 вариант
- •2 вариант
- •ИСПОЛЬЗУЕМ ТОЖДЕСТВО:
- •ОПРЕДЕЛИМ С ПРИ УСЛОВИИ, ЧТО
- •ПРЕОБРАЗОВАНИЕ ДАЕТ:
- •ПРИМЕР БИОЛОГИЧЕСКОЙ РЕАКЦИИ ВТОРОГО ПОРЯДКА
КИНЕТИКА
БИОЛОГИЧЕСКИХ
ПРОЦЕССОВ

Основные понятия
химической кинетики
Элементарные
кинетические уравнения и их решение

МОЛЕКУЛЯРНОСТЬ
Химические реакции
|
мономолекулярн |
|
бимолекулярн |
|
тримолекуляр |
|
|
ые |
|
ые |
|
ные |
|
|
A P |
|
2A P |
|
A + B + C P |
|
|
A P + Q |
|
A + B P |
|
A + B + C P + |
|
|
|
|
|
|
Q + ... |
|
|
|
|
A + B P + Q |
|
А + 2В P + Q |
|
|
|
|
|
|
+ ... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

МОНОМОЛЕКУЛЯР
НЫЕH2S → H2 + S
БИМОЛЕКУЛЯРНЫ
ЕСН3Вr + КОН → СН3ОН
ТРИМОЛЕКУЛЯРН
ЫЕ
О2 + NО + NО → 2NО2

ПОРЯДОК РЕАКЦИИ
Порядок реакции определяется
величиной показателя степени в
кинетическом уравнении
aA+bB=cC+d
v kDA a B b
порядок прямой реакции η=a+b

Скоростью химической
реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени
aA+bB=cC+ dD
v C A
t t

К.М.ГУЛЬД П.ВАА БЕРГ, ГЕ
ЗАКОН
ДЕЙСТВУЮЩИХ
СкоростьМАССхимической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов
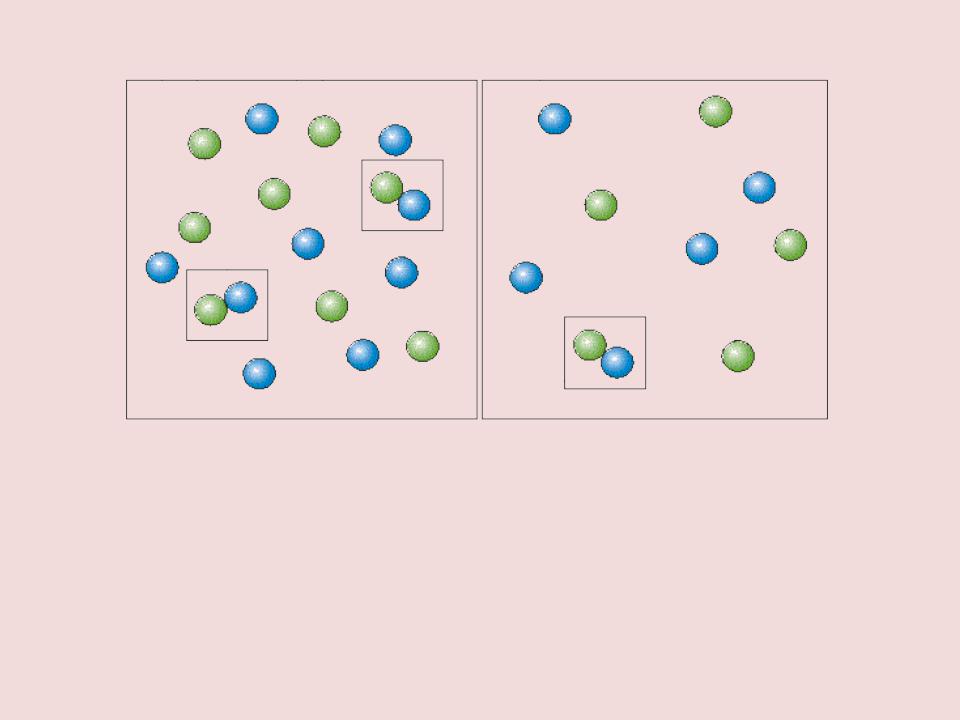
Вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов.

aA+bB=cC+
dD
v k A a B b
k- константа скорости
реакции является мерой реакционной способности реагентов
при данной температуре

|
РЕАКЦИЯ НУЛЕВОГО |
|
ПОРЯДКА ko |
v |
А В |
da k0 a dt
da k0dt
da k0dt
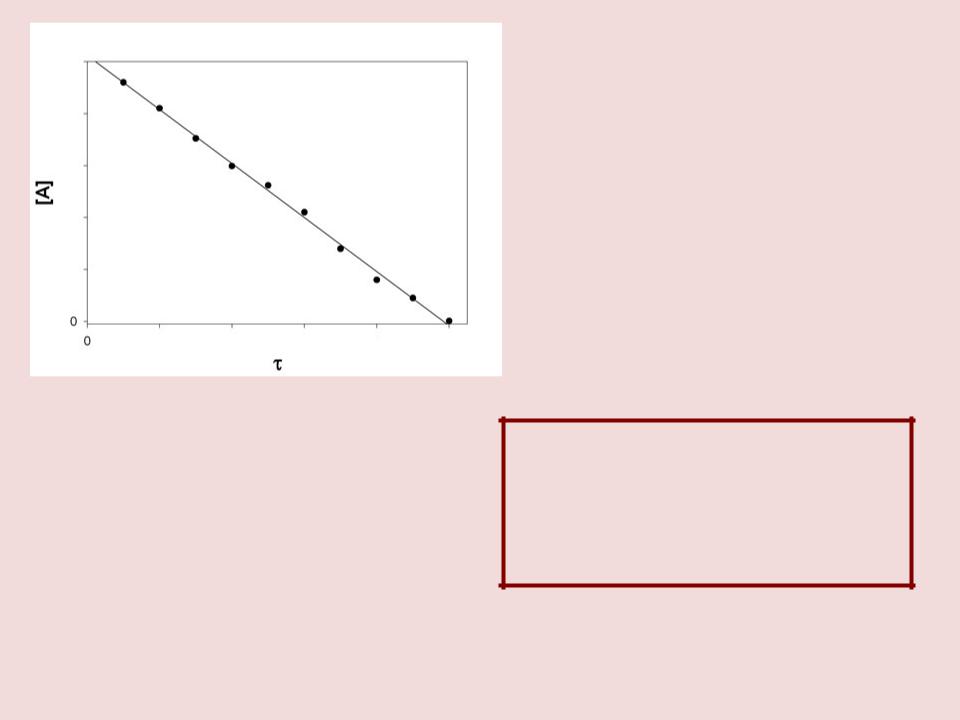
a k0t C
При t=0, a=a0
a a0 k0t
