
- •Министерство здравоохранения республики беларусь
- •Удк 577.27(07)
- •Isbn 985-466-155-5 оглавление
- •Список основных сокращений
- •Введение
- •Глава 1. Структура и функции системы иммунитета
- •Виды иммунитета
- •Цитокины и интерлейкины
- •Поверхностные лейкоцитарные антигены и рецепторы
- •Гуморальные факторы врожденного иммунитета
- •Клетки естественного врожденного иммунитета
- •Лимфоидная система
- •Иммуноглобулины и антитела
- •Т-клетки памяти
- •Тяжелая цепь
- •Т-лимфоциты
- •Глава 2. Антигены. Динамика иммунного ответа Антигены
- •Динамика иммунного ответа
- •Глава 3. Иммунитет и инфекции
- •Противобактериальный иммунитет
- •Противовирусный иммунитет
- •Врожденная резистентность и иммунитет к вирусам
- •Противопаразитарный и противогрибковый иммунитет
- •Глава 4. Виды иммунопатологии
- •Неблагоприятные факторы
- •Иммунодефицитные болезни
- •Аллергия и аутоиммунные заболевания
- •I тип реакций. Анафилактические реакции (реагиновые, IgE- зависимые).
- •Анафилактический шок, приступ бронхиальной астмы, ринит, отек Квинке, крапивница Эозинофилы
- •II тип. Цитотоксические реакции.
- •III тип. Иммунокомплексные реакции.
- •Трансплантационный иммунитет
- •Противоопухолевый иммунитет
- •Глава 5. Иммунодиагностика. Оценка иммунного статуса
- •Специфические показатели иммунного статуса
- •Оценка реакции
- •Глава 6. Иммунотерапия и иммунопрофилактика
- •Противоинфекционные вакцины
- •Серотерапия. Иммунные антисыворотки и иммуноглобулины
- •IV. Природные, синтетические, генно-инженерные препараты:
- •Литература
- •Основы ИммуноЛогии Учебное пособие
- •210602, Витебск, пр. Фрунзе, 27
Глава 5. Иммунодиагностика. Оценка иммунного статуса
Неспецифические показатели иммунного статуса
Иммунодиагностика – это применение иммунологических реакций и методов с целью оценки иммунного статуса, лабораторной диагностики заболеваний, а также для идентификации антигенов.
Все методы иммунодиагностики делятся на 2 группы:
Общие неспецифические методы, характеризующие состояние различных звеньев системы иммунитета: лимфоцитов, гранулоцитов, макрофагов, комплемента. Обычно их применяют для выявления дефекта в СИ, т.е. при иммунодефицитах.
Специфические методы, позволяющие выявить антитела, иммунные Т-лимфоциты, антигены в организме человека или антигены возбудителя во внешней среде. Эти методы используют для диагностики инфекций, аллергии, аутоиммунных заболеваний.
Иммунный статус – это состояние СИ здорового или больного в определенный момент онтогенеза при конкретных условиях окружающей среды.
В частности, иммунный статус ребенка отличается от такового у взрослого человека. Также он изменяется под влиянием неблагоприятных воздействий.
Для оценки иммунного статуса применяют определение неспецифических и специфических показателей. Оценка иммунного статуса – это процесс получения комплекса количественных и функциональных показателей, отражающих состояние СИ. Она проводится с целью выявления природы иммунопатологии – иммунодефицитных и аллергических заболеваний.
Для этого сначала у больного собирают анамнез и проводят общеклиническое обследование. В нем важным является формула крови – количество лейкоцитов разных типов: нейтрофилов, эозинофилов, базофилов, моноцитов, лимфоцитов. Лейкоцитоз – увеличение общего количества лейкоцитов (более 9х109/л) часто наблюдается при инфекциях; лейкопении – снижение их количества (менее 4 х109/л) – при аутоаллергии; эозинофилия – увеличение количества (более 3%) эозинофилов при экзогенной аллергии и т.д. Однако этих данных обычно недостаточно и необходимо более детальное определение популяций, субпопуляций лейкоцитов и гуморальных факторов иммунитета.
Характеристика Т-лимфоцитов
1. Определяют общее количество лейкоцитов, формулу крови и количество лимфоцитов. В норме лимфоцитов 20-36% среди других лейкоцитов (около 2000 клеток в 1 мм3 крови).
2. Подсчитывают процент и количество Т-лимфоцитов. В норме среди лимфоцитов крови их 50-70% (1000-1400 клеток в 1 мм3 крови).
Простой метод определения Т-клеток: подсчет количества (процента) лимфоцитов, образующих при помощи CD2-АГ розетки с эритроцитами барана:
к взвеси лейкоцитов добавляют равный объем 1% взвеси отмытых эритроцитов барана и инкубируют при 370С 15 мин и ночь при 40С;
осадок ресуспензируют, добавляют раствор глютарового альдегида до конечной концентрации 0,06% для фиксации розеток и сразу делают мазки;
мазки высушивают, фиксируют спиртом и окрашивают по Романовскому-Гимзе;
подсчитывают процент Т-лимфоцитов, связавших три и более эритроцитов;
В настоящее время общую популяцию Т-лимфоцитов выявляют с помощью меченых моноклональных антител к СD-антигенам (СD2, СD3) в реакции иммунной флюоресценции (с учетом результатов на люминесцентном микроскопе, на проточном цитофлюориметре) или в реакции с частицами, покрытыми такими антителами. В норме у человека в крови среди всех лимфоцитов 55-80% являются Т-клетками.
3. Определяют содержание Т-хелперов и Т-супрессоров с помощью моноклональных антител к СD4 (Тx) и СD8 (Тc) антигенам.
У человека в норме в крови обнаруживается 33-46% Тx, 17-25% Тc, соотношение Тx/Тc=1,4-2.0 – иммунорегуляторный индекс. При заболеваниях этот индекс изменяется. Например, при СПИДе он уменьшается (0,04), т.к. угнетаются Тx (рецептором для вируса СПИДа является антиген Тx СD4). При аутоиммунных и аллергических заболеваниях индекс больше 2.0.
4. Для выявления активированных Т-клеток определяют рецепторы к ИЛ-2 (CD25), HLA-DR антигены и CD71 (рецептор для трансферрина).
5. Определяют уровень различных цитокинов в крови (обычно с помощью иммуноферментного анализа).
Исследуют также функциональные показатели Т-лимфоцитов: пролиферативную активность (см. РБТЛ, РПМЛ), цитотоксическую и цитокиновую активность. Показатели Т-лимфоцитов снижаются при Т-клеточных иммунодефицитах.
Характеристика В-лимфоцитов
1. Общее количество В-лимфоцитов можно определить с помощью моноклональных антител к антигенам СD19-СD22, СD72. Применяют также антитела к иммуноглобулинам, которые находятся на поверхности В-лимфоцитов. В-лимфоциты составляют 17-25% всех лимфоцитов (600-800 клеток в 1 мм3 крови). Иногда определяют В-лимфоциты, имеющие рецепторы к эритроцитам мыши (10-15%), составляющие лишь часть В-субпопуляции.
2. Продукты В-лимфоцитов – иммуноглобулины G, М, A классов в сыворотке крови и различных биологических жидкостях определяют с помощью радиальной иммунодиффузии в агаре – реакции преципитации по Манчини.
Для этого на одну стеклянную пластинку (или чашку Петри) наливают 2% агар, смешанный с антителами против IgG; на вторую пластинку – с антителами против IgМ, на 3-ю – против IgА. После застывания в агаре делают лунки диаметром 2 мм. В один ряд лунок каждой пластины вносят стандартную сыворотку с известной концентрацией IgG, IgМ, IgА. В другие лунки добавляют исследуемые сыворотки крови больных.
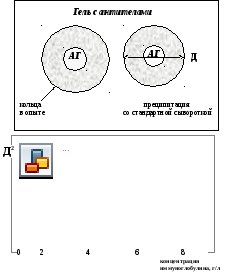
Рис. 5.1. Простая радиальная иммунодиффузия в агаре для определения антигенов (иммуноглобулинов)
Иммуноглобулины диффундируют в агар и на месте встречи с антителами, которые находятся в агаре, образуется зона кольца преципитации. Диаметр этого кольца зависит от концентрации Ig (чем больше Ig, тем больше диаметр). Измеряют диаметр зоны преципитации для трех разведений стандартной сыворотки и по ней на полулогарифмической бумаге строят график зависимости квадрата диаметра кольца преципитации (Д) от количества Ig в сыворотке крови (рис. 5.1). Затем измеряют диаметр кольца преципитации исследуемой сыворотки, наносят на построенный график и определяют концентрацию иммуноглобулина. Для определения секреторного IgA (в слюне и др.) используют аналогичный метод в двух вариантах: определяют IgA (a-цепь) и его секреторный компонент с помощью соответствующих антител.
Нормы у взрослых: 0,8-2 г/л IgM; 8,0-13,0 г/л IgG; 1,4-3,0 г/л IgA. У новорожденных уровень IgG близок к материнскому, IgM и IgA имеются в следовых концентрациях; к 4-6 мес. уровень IgG падает до 5-6 г/л, а затем увеличивается. При нормальном развитии детей уровень иммуноглобулинов к 2-м годам близок величинам их у взрослых.
Уровень секреторного IgA в слюне составляет 0,03-0,4 г/л.
При иммунодефицитах уровень иммуноглобулинов снижается (гипогаммаглобулинемия), а при стимуляции СИ и воспалении – повышается (гипергаммаглобулинемия).
Определяют уровень естественных (против антигенов групп крови, эритроцитов животных и др.) и иммунных (к распространенным бактериальным и вирусным антигенам, вакцинам) антител. Он снижен (или антитела отсутствуют) при иммунодефицитах
Характеристика системы гранулоцитов и моноцитов
1. Определяют количество лейкоцитов в крови и соотношение их видов (нейтрофилы, базофилы, эозинофилы, моноциты).
2. Оценивают поглотительную и переваривающую активность фагоцитов: к взвеси лейкоцитов или капле крови добавляют взвесь отмытой суточной культуры стафилококков. Готовят 3 пробы, инкубируют при 370С 1-ю пробу 45 мин, 2-ю - 60 мин, 3-ю - 90 мин. Делают мазки, высушивают их, фиксируют этанолом и окрашивают по Романовскому.
Определяют фагоцитарный индекс и фагоцитарное число.
Фагоцитарное число – это среднее количество частиц или микроорганизмов в одном фагоците (норма для стафилококков 6-12, кандид – 2-4).
Фагоцитарный индекс – это количество фагоцитов, участвующих в фагоцитозе, имеющих поглощенные частицы (норма – 60-80%).
Оценка показателей через разные промежутки времени позволяет оценить динамику фагоцитоза. В норме через 90 мин фагоцитарный индекс должен быть ниже, чем через 45 мин и 60 мин, в связи с перевариванием микробов. При нарушении переваривания он не меняется.
Переваривание микробов можно оценивать путем посева лизатов лейкоцитов (после инкубации с микробами) на питательные среды и подсчета выросших колоний. Метод предполагает использование в качестве объекта фагоцитоза живых микроорганизмов. После инкубирования с микробами (см. выше) фагоциты осаждают центрифугированием, отмывают и лизируют. Их лизаты высевают на твердую питательную среду. Переваривающую активность фагоцитов оценивают по числу выросших колоний.
Метаболическую активность фагоцитов определяют в тесте восстановления нитросинего тетразолия (НСТ-тест) после окраски их 0.25% раствором данного красителя. В норме нитросиний тетразолий окрашивает (диффузно и в виде глыбок голубого цвета) 15-18% нейтрофилов, при инфекциях их число увеличивается до 40% и более.
Показатели фагоцитов снижаются при соответствующих иммунодефицитах, а повышаются при благоприятном течении инфекции.
3. На фагоцитах с помощью моноклональных антител определяют антигены дифференцировки, активации и адгезии (СD14, СD11, СD18, HLA-DR и др.)
4. Выявляют рецепторы к С3 компоненту комплемента, к иммуноглобулинам и др.
5. Оценивают спонтанную и направленную миграцию (хемотаксис).
6. Определяют способность секретировать цитокины (ИЛ-1, ФНО и др.) и их уровень в крови.
Характеристика системы комплемента
1. Определяют гемолитическую активность комплемента в реакции гемолиза с использованием гемолитической системы. Эта система состоит из эритроцитов барана, обработанных гемолитической сывороткой.
Определение комплемента основано на способности продуктов его активации вызывать лизис эритроцитов, покрытых антителами. По степени гемолиза судят о гемолитической активности комплемента.
В качестве единицы измерения комплемента используется гемолитическая единица (СН50) – количество комплемента, вызывающее 50%-ный лизис 3% суспензии сенсибилизированных антителами эритроцитов при температуре 370С в течение 45 мин. Титрование комплемента сводится к определению количества СН50 гемолитических единиц в конкретном объеме сыворотки. Для этого к различным дозам сыворотки прибавляют стандартное количество сенсибилизированных эритроцитов. Затем, используя шкалу лизиса эритроцитов дистиллированной водой, находят количество СН50 единиц.
Степень гемолиза при титровании комплемента можно определять фотометрическими методами (с помощью спектрофотометра, фотоколориметра, нефелометра) или же визуально путем сравнения интенсивности гемолиза в опытных пробирках со стандартной шкалой лизированных эритроцитов.
2. Выявляют продукты активации С4а, С3а, С5а и др.
