
29+
.pdf
Жерносек А.К. Лекции по фармацевтической химии
ЛЕКЦИЯ 29
ПРОТИВОТУБЕРКУЛЁЗНЫЕ И ПРОТИВОМАЛЯРИЙНЫЕ СРЕДСТВА
ПРОТИВОТУБЕРКУЛЁЗНЫЕ СРЕДСТВА
Туберкулёз – инфекционное заболевание человека и животных, вызываемое различными видами микобактерий, чаще всего Mycobacterium tuberculosis.
Противотуберкулёзные средства – группа ЛС, используемых для этиотропного
лечения и профилактики туберкулёза.
Применение |
ПРОТИВОТУБЕРКУЛЁЗНЫЕ ЛС |
|||
|
ОСНОВНЫЕ |
РЕЗЕРВНЫЕ |
||
|
Изониазид |
Протионамид |
||
|
Рифампицин |
(Этионамид) |
||
|
Пиразинамид |
Канамицин |
||
|
Этамбутол |
Амикацин |
||
МЛУ |
Стрептомицин |
Капреомицин |
||
|
|
Циклосерин |
||
ЛС с потенциальной |
||||
Рифабутин |
||||
активностью: |
|
ПАСК |
||
Клофазимин |
|
Фторхинолоны |
||
Кларитромицин |
Лечение устойчивых |
|||
Амоксициллин с КК |
||||
форм |
||||
Линезолид |
|
|||
|
|
|||
ПРОТИВОТУБЕРКУЛЁЗНЫЕ СРЕДСТВА В АТХ
J04 Средства, активные в отношении микобактерий
J04A Средства для лечения туберкулёза
J04AA Аминосалициловая кислота и её производные
J04AA02 Натрия аминосалицилат
J04AB Антибиотики
J04AB02 Рифампицин
J04AС Гидразиды
J04AС01 Изониазид
J04AD Производные тиокарбамида
J04AD01 Протионамид
J04AK Другие средства для лечения туберкулёза
J04AK01 Пиразинамид
J04AK02 Этамбутол
J04AM Комбинации средств для лечения туберкулёза
ИЗОНИАЗИД и РОДСТВЕННЫЕ ЛС
O |
1948 - обнаружение ПТ активности |
||||
|
|||||
NH2 |
никотинамида |
|
|
||
N |
|
|
O |
|
|
|
|
N |
|
||
|
|
|
NH2 |
||
H |
S |
NH2 |
|
||
N |
|
||||
O N NH |
|
|
|
||
2 |
|
|
Пиразинамид |
||
|
|
|
|||
N |
N |
R |
|
|
|
Производные тиоамида |
|
||||
Изониазид |
изоникотиновой кислоты |
||||
1912/1926/ |
|||||
|
|
|
|
||
1952 |
|
|
|
|
|
Механизм действия
Изониазид – это пролекарство. Его активация происходит в результате окисления, катализируемого каталазой-пероксидазой G, присутствующая только у микобактерий.
|
H |
|
|
|
|
|
O |
N NH2 |
KatG |
CHO |
COOH |
CONH2 |
|
|
|
|
+ |
+ |
|
|
|
|
|
|
|
||
N |
|
|
|
N |
N |
N |
Промежуточные продукты: |
|
|
||||
O |
N |
NH |
O |
O O O |
O O OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Потенциальные |
|
|
|
|
|
|
ацилирующие |
N |
|
|
N |
N |
N |
агенты |
2011/2012 |
1 |
Жерносек А.К. Лекции по фармацевтической химии
O |
N R |
НАД+ |
O |
N |
CONH2 |
ацил-радикал |
N |
изоникотиновой |
|
кислоты |
Ингибирование НАД- |
|
|
|
зависимой еноил- |
|
ацилредуктазы |
НАРУШЕНИЕ СИНТЕЗА МИКОЛЕВЫХ КИСЛОТ |
|
Связь структуры и действия
Должна при окислении образовывать ацильный радикал:
|
|
|
|
H |
|
|
X = O или S |
|
X N |
R |
R1 = H; NH2; CR2R3; NHCR2R3 |
||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
R В ядре может присутствовать |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
N |
|
|
небольшой заместитель |
||||
|
|
|
|
|||||
Обязательно наличие остатка изоникотиновой кислоты (остатки других кислот менее активны).
|
N2-алкилпроизводные |
|
H |
CH3 |
|
|
O N N |
CH3 |
|||
|
|
|
|||
|
|
|
|
H |
|
H |
|
|
|
|
|
O N |
NH2 |
|
|
N |
|
|
Ипрониазид |
||||
|
|
(не применяется) |
|||
N |
Гидразоны |
|
H |
|
|
|
O N |
N |
|
||
Ни одно из полученных |
|
|
|
||
|
|
|
|
||
производных не оказалось |
|
|
|
OH |
|
лучше изониазида! |
N |
|
|
OCH3 |
|
Фтивазид
Производные тиоамида изоникотинововой кислоты
S OH S NH2 |
S NH2 |
 N
N

 N
N

 CH3
CH3  N
N
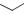

 CH3
CH3
Этионамид Протионамид
1952/1955
Имеют такой же механизм действия, что и изониазид. Относятся к резервным ПТС.
ПИРАЗИНАМИД
|
|
O |
|
|
1936/1952/1970(?) |
||
N |
|
|
NH |
2 |
Биоизостер |
||
|
|
|
|||||
|
|
|
|
|
никотинамида |
|
|
|
|
|
|
|
|
|
|
 N
N
Максимальная активность проявляется при рН 5,5. При увеличении рН активность снижается. При физиологических pH практически неактивен. Действует в большей степени на «старые» МБ.
Является пролекарством. Проникает внутрь микробной клетки и под действием фермента пиразинамидазы превращается в активный метаболит – пиразиновую кислоту, которая является ингибитором синтазы жирных кислот (и обладает другим «нехорошим» для МК действием).
|
O |
|
|
O |
N |
NH |
пиразинамидаза |
N |
OH |
|
|
2 |
|
|
N |
|
|
N |
|
Почему пиразинамид активен только в кислой среде?
2011/2012 |
2 |
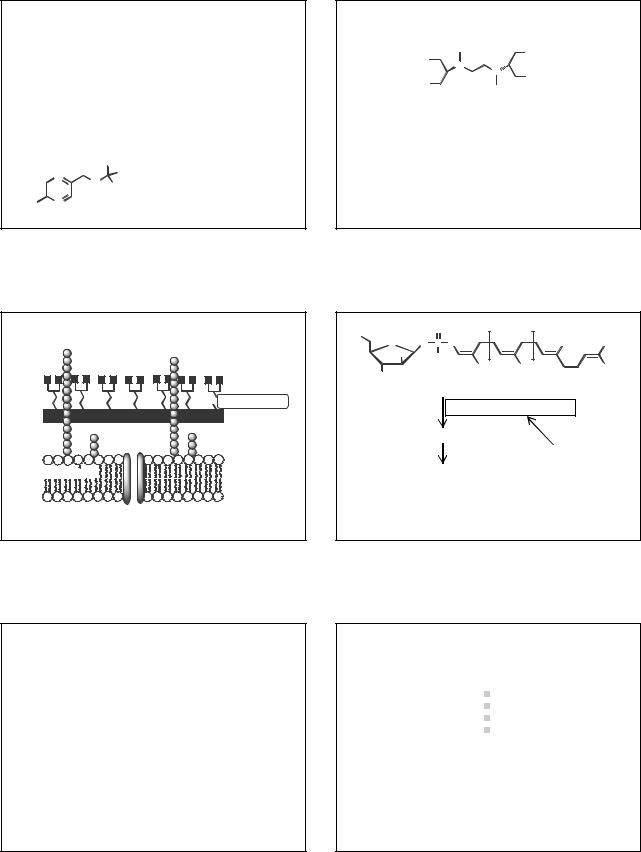
Жерносек А.К. Лекции по фармацевтической химии
Связь структуры и действия
Простое введение заместителя в ППР ядро или его замена на другой ГЦ уменьшает активность.
Требования к аналогам пиразинамида (QSAR):
 Определённая гидрофильность для создания необходимой концентрации в плазме крови.
Определённая гидрофильность для создания необходимой концентрации в плазме крови.
 Достаточная липофильность для проникновения внутрь МБ.
Достаточная липофильность для проникновения внутрь МБ.
 Способность к гидролизу под действием внутриклеточных ферментов.
Способность к гидролизу под действием внутриклеточных ферментов.
|
|
|
O |
CH3 |
|
|||
|
N |
|
|
N |
|
CH3 |
Потенциально |
|
|
|
|
||||||
|
|
|
|
|
CH3 |
|||
|
|
|
|
|
|
|
активный аналог |
|
Cl |
N |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
||
ЭТАМБУТОЛ |
|
ЭДА |
|
|
|
|
|
1968 |
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
H3C |
|
|
|
H |
|
|
|
|
OH |
бутанол |
|
|
|
|
|
|
|
|
|
|||||
бутанол |
|
|
|
N |
N |
|
|
|
CH3 |
|||
|
|
|
|
|
|
|||||||
HO |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
H |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Относится к «двойным лекарствам». В качестве ЛС используется только (+)-изомер, который в 250-500 раз более активен, чем (-)-изомер.
Этамбутол обладает бактериостатическим действием и влияет на синтез компонентов клеточной стенки МБ. Данное ЛС ингибирует фермент арабинозилтрансферазу, которая катализирует полимеризацию D-арабинофуранозы, приводящую к образованию арабиногалактана.
 липоарабиноманнан
липоарабиноманнан
миколевая |
кислота |
 арабиногалактан
арабиногалактан
пептидогликан
ЦПМ 
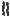
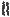

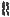
HO |
O |
|
|
|
O P O |
|
CH3 |
CH3 |
|
O |
|
|||
HO |
OH |
|
CH37 |
|
OH |
CH3 |
CH3 |
||
|
|
|
|
|
-D-арабинофуранозил-1-монофосфорилдекапренол |
|
|||
|
арабинозилтрансфераза |
|
||
АРАБИНОГАЛАКТАН |
|
|
||
|
|
|
Этамбутол |
|
ЛИПОАРАБИНОМАННАН |
|
|||
Исследовано большое число производных этамбутола: |
|
|||
увеличение углеродной цепочки между атомами N, удаление |
||||
азота, изменение заместителя, перемещение OH-групп |
|
|||
приводят к значительному уменьшению ПТ активности или к |
||||
полному её исчезновению. |
|
|
|
|
РИФАМПИЦИН
Анзамицины – антибиотики, содержащие в молекулах ароматическое ядро (нафталиновое, реже -бензольное), к которому в двух положениях присоединена алифатическая цепь из 15-20 атомов углерода. .
Рифамицины – анзамициновые антибиотики, продуцируемые микроорганизмом
Amycolatopsis mediterranei.
Природные |
|
Полусинтетические |
рифамицины |
|
производные |
Рифамицины |
Рифампицин (Рифампин) |
|
А, B, C, D, S, SV |
Рифабутин |
|
|
|
Рифапентин |
|
|
Рифаксимин |
Полусинтетические рифамициновые антибиотики получают из рифамицина SV. При синтезе рифампицина вначале получают 3-пирролидино- метилрифамицин, затем 3-формилрифамицин, на который действуют 4-метилпиразином-1-амином.
2011/2012 |
3 |
Жерносек А.К. Лекции по фармацевтической химии
|
|
|
OH O |
H3C |
|
|
|
|
|
|
|
|
||||
|
|
|
|
12 |
O |
|
|
|
|
|
|
|
|
|||
|
3 |
|
4 |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
8 |
|
|
OCH3 |
Рифамицин SV |
|
||||||
|
HN |
|
1 |
|
OH |
CH3 |
|
|||||||||
H3C |
15 |
|
OH |
|
|
O |
|
|
|
|
|
|
||||
|
O |
|
|
H C 25 |
|
|
|
|
|
|
|
|||||
|
|
|
|
OH |
3 |
O |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
21 |
|
OH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
CH3 |
|
CH3 |
H3C N |
|
OH O |
H3C |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||
|
|
|
|
|
|
|
|
|
|
N N |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
|
||
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
|
CH33 |
OCH3 |
|
|
|
|
|
Рифампицин |
H3C |
|
OH |
OH |
|||||||
|
|
|
|
|
O |
|
H C |
O |
||||||||
|
|
|
|
|
|
|
|
1965 |
|
|
|
OH |
3 |
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|
|
Механизм действия
Рифампицин и другие рифамицины ингибируют бактериальную ДНК-зависимую РНК-полимеразу. Ингибирование данного фермента блокирует инициирование образования цепи в синтезе РНК.
Рифамицины связываются с -субъединицей
фермента. Связывание происходит за счёт p-p- взаимодействия нафталинового цикла в молекуле антибиотика и остатков ароматических АК в ППЦ фермента. Кроме того, OH-группы при С1 и С8 образуют хелат с Zn2+, входящим в состав фермента, а OH-группы при С21 и C23 образуют прочные водородные связи.
Рифампицин обладает бактериостатическим, а в высоких концентрациях — бактерицидным
действием. Является противотуберкулезным препаратом первого ряда. Активен в отношении Гр+ (Staphylococcus spp., в том
числе и множественно устойчивых; Streptococcus spp., Bacillus anthracis), а
также в отношении некоторых Гр-. Действует на возбудителей Brucella spp., Legionella pneumophila, Salmonella typhi, Mycobacterium leprae, Chlamydia trachomatis. К
рифампицину у МО быстро возникает устойчивость.
Связь структуры и действия
 При атомах углерода 1, 8, 21 и 23 должны быть свободные OH-группы. Эти группы участвуют в связывании с молекулой ингибируемого фермента.
При атомах углерода 1, 8, 21 и 23 должны быть свободные OH-группы. Эти группы участвуют в связывании с молекулой ингибируемого фермента.  Ацетилирование OH-групп в положениях 21 и/или 23 приводит к образованию неактивных соединений.
Ацетилирование OH-групп в положениях 21 и/или 23 приводит к образованию неактивных соединений.
 Гидрирование двойных связей в макроцикле приводит к значительному уменьшению активности. Раскрытие макроцикла приводит к исчезновению активности.
Гидрирование двойных связей в макроцикле приводит к значительному уменьшению активности. Раскрытие макроцикла приводит к исчезновению активности.
 Введение заместителей в положения 3 и 4 приводит к образованию п/с антибиотиков с разной степенью активности. Заместители в данных положениях влияют на транспорт антибиотика через клеточную стенку бактерий.
Введение заместителей в положения 3 и 4 приводит к образованию п/с антибиотиков с разной степенью активности. Заместители в данных положениях влияют на транспорт антибиотика через клеточную стенку бактерий.
Аминосалициловая кислота
COOH |
COONa |
H2N

 OH H2N
OH H2N
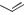
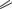
 OH
OH
ПАСК ПАСК-натрий
4-амино-2-гидроксибензойная кислота
Является конкурентным антагонистом ПАБК при синтезе дигидрофолиевой кислоты у микобактерий. Обладает бактериостатическим действием. Действует только на активно делящиеся M.tuberculosis. Не действует на другие виды МБ; МБ в стадии покоя и МБ, находящиеся внутриклеточно. Относится к резервным ПТЛС.
ИЗОНИАЗИД
(ISONIAZID)
ТУБАЗИД H ГИНК
O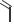
 N NH2
N NH2
 N
N
пиридин-4-карбогидразид
Таблетки по 300 мг; раствор для инъекций
100 мг/мл.
2011/2012 |
4 |
Жерносек А.К. Лекции по фармацевтической химии
ФТИВАЗИД
(FTIVAZIDE)
H
O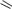

 N N
N N
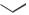


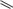

 H2O
H2O


 OH
OH
 N
N OCH3
OCH3
[(4-гидрокси-3-метоксифенил)метилен]гидразид
Таблетки по 500 мг.
ПИРАЗИНАМИД
(PYRAZINAMIDE)
O
 N
N

 NH2
NH2
 N
N
пиразин-2-карбоксамид
Таблетки по 500 мг.
ПРОТИОНАМИД
(PROTIONAMIDE) Prothionamide
S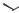 NH2
NH2
 N
N
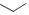

 CH3
CH3
2-пропилпиридин-4-карботиоамид
Таблетки ПО по 250 мг.
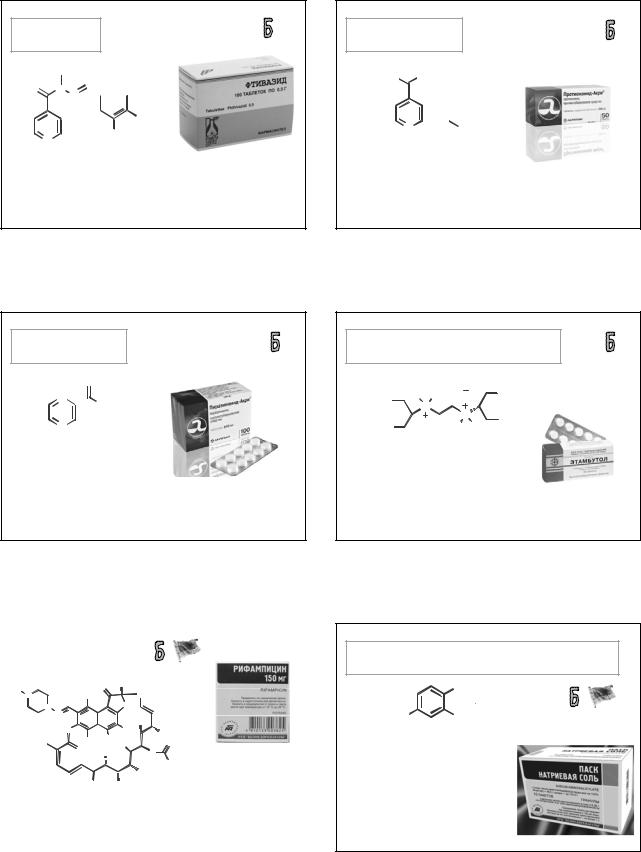
ЭТАМБУТОЛА ГИДРОХЛОРИД
(ETHAMBUTOL HYDROCHLORIDE)
|
H |
H |
2Cl |
OH |
КОМБУТОЛ |
|
H3C |
ТУБЕРТАМ |
|||||
|
N |
N |
CH3 |
|||
HO |
|
|
H H |
|
2,2’-(этилендиимино)бис[(2S)-бутанол-1] дигидрохлорид
Таблетки и таблетки ПО по 400 мг; раствор для инъекций 500 мг/3 мл.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РИФАМПИЦИН |
|
|
|
|
|
|
|
|
|
|
|
ГЛЮРИФОР* |
|||||||
|
(RIFAMPICIN) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H3C N |
|
|
OH O |
H3C |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
N N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
HN |
|
|
|
|
OH |
CH3 |
|
|
OCH3 |
|
|||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
H3C |
|
OH |
C |
|
|
|
||||||||||||
|
|
O |
|
H |
|
|
|
O |
|
|||||||||||
|
|
|
|
|
|
|
OH |
3 |
|
|
|
|
O |
|
|
(2S,12Z,14E,16S,17S,18R,19R,20R, |
||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
CH3 |
21S,22R,23S,24E)-5,6,9,17,19- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пентагидрокси- |
||||
|
|
|
|
|
|
CH3 |
|
CH3 |
|
|
|
|
23-метокси-2,4,12,16,18,20,22- |
|||||||
|
|
|
|
|
|
|
|
|
|
|
гептаметил-8-[[(4- |
|||||||||
|
Капсулы по 100 мг; гранулы для |
|
|
|
|
метилпиперазин-1- |
||||||||||||||
|
|
|
|
|
ил)имино]метил]-1,11-диоксо-1,2- |
|||||||||||||||
|
приготовления суспензии для приёма |
дигидро-2,7- |
||||||||||||||||||
|
внутрь по 100 мг; лиофилизированный |
(эпоксипентадека[1,11,13]- |
||||||||||||||||||
|
порошок для приготовления раствора для |
триенимино)нафто[2,1-b]фуран-21- |
||||||||||||||||||
|
внутривенного введения по 150 мг. |
|
|
|
|
илацетат |
||||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НАТРИЯ АМИНОСАЛИЦИЛАТ ДИГИДРАТ |
|||
(SODIUM AMINOSALICYLATE DIHYDRATE) |
|||
|
COONa |
|
|
|
2H2O |
|
|
H2N |
OH |
ПАСК-НАТРИЙ |
|
натрия 4-амино-2-гидроксибензоат |
|||
|
|||
Порошок лиофилизированный |
|
||
для приготовления раствора для |
|
||
инфузий по 3 г; гранулы для |
|
||
приготовления раствора для |
|
||
приёма внутрь по 4 г; порошок |
|
||
для приготовления раствора для |
|
||
приёма внутрь по 3, 4, 6 и 9 г. |
|
||
2011/2012 |
5 |

Жерносек А.К. Лекции по фармацевтической химии
ПРИМЕРЫ СИНТЕЗА ПРОТИВОТУБЕРКУЛЁЗНЫХ
СРЕДСТВ
|
|
|
|
H |
|
|
|
|
|
O |
OC2H5 |
|
O |
N NH |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
N2H4 |
|
|
|
Изониазид |
|
|
||
|
N |
|
N |
|
|
|
|
|
|
этилизоникотинат |
|
|
|
|
|
|
|
|
|
Этамбутол |
|
|
|
|
|
|
|
|
|
H3C |
|
HCHO |
H3C |
NO |
H2/Ni |
H3C |
|
NH |
|
|
NO |
|
|
|
|
||||
|
|
2 |
HO |
|
2 |
HO |
|
2 |
|
|
1-нитропропан |
|
Cl H3C |
H |
|
OH |
|||
|
H3C |
|
NH2 |
Cl |
N |
|
N |
CH3 |
|
|
HO |
|
NaOH |
HO |
|
|
|||
|
|
|
|
|
H |
||||
|
|
|
|
|
|
|
|||
(+)-2-аминобутанол-1 |
|
|
|
|
|
|
|||
Разделение рацемата при |
|
|
|
|
|
||||
помощи (+)-винной кислоты |
|
|
|
|
|
||||
МЕТОДЫ КОНТРОЛЯ КАЧЕСТВА ПРОТИВОТУБЕРКУЛЁЗНЫХ
СРЕДСТВ
ИЗОНИАЗИД
Характеристика вещества
Белый или почти белый кристаллический порошок либо бесцветные кристаллы. Легко растворим в воде (1:8), умеренно растворим в 96% этаноле (1:45).
Растворимость в хлороформе – 1:1000, практически нерастворим в бензоле и диэтиловом эфире.
Химические свойства
Кислотно-основные |
|
H pKa = 10,8 |
|
свойства – амфолит, имеет |
O N |
NH2 |
|
2 основных центра и 1 |
|
|
|
|
|
||
кислотный. |
|
|
pKBH+ = 1,8 |
|
|
||
рН = 6,0–8,0 (5% раствор) |
|
|
|
|
N pK + = 3,5 |
||||
|
||||
|
|
|
BH |
|
Окислительно- |
|
H |
|
|
|
O |
N |
-2 |
|
|
|
восстановительные |
|
|
|||
свойства – |
|
-2 |
NH2 |
|
|
|
|
|
- 4e |
|
|
восстановитель. |
|
|
|
N2 + ... |
|
|
|
|
|
|
|
|
|
N |
|
|
|
Другие свойства: |
|
|
|
|
|
гидролиз |
|
|
|
|
образование |
|
|
|
H |
|
гидразонов |
реакции на |
|
O |
N NH2 |
|
|
пиридиновый |
|
|
|
|
|
цикл |
|
N |
|
|
|
|
|
|
|
|
ИК-спектр
УФ-спектр
Зависит от рН. В кислой среде (0,1 М HCl) максимум при 266 нм (минимум при 234 нм), в щелочной – при
298.
2011/2012 |
6 |
Жерносек А.К. Лекции по фармацевтической химии
Идентификация |
|
|
|
|
Фармакопеи |
|
Методы идентификации |
||
|
СП |
ХР |
ФК |
Хим. реакции |
ГФ РБ |
ИК |
– |
Tпл |
ванилин |
Ph. Eur 6 |
ИК |
– |
Tпл |
ванилин |
BP 2009 |
ИК |
– |
Tпл |
ванилин |
Украинская |
ИК |
– |
Tпл |
ванилин |
ГФ XII |
ИК, УФ |
– |
– |
1) 2,4-ДНХБ; 2) AgNO3 |
USP 30 |
ИК, УФ |
– |
– |
– |
Ph. Int. 3 |
ИК |
– |
– |
1) пиридин ; 2) ванилин |
JP 15 |
ИК, УФ |
– |
– |
– |
Реакция с ванилином
0,1 г ИО растворяют в 2 мл воды, прибавляют 10 мл тёплого 10 г/л раствора ванилина. Образуется жёлтый осадок, который после перекристаллизации из 70% спирта и высушивания имеет температуру плавления 226–231 С.
|
H |
O H |
|
H |
|
O |
N |
O |
N N |
||
NH2 |
|||||
|
|
+ |
|
OH |
|
|
|
|
OCH3 |
||
N |
|
H3CO |
N |
||
|
|
OH |
|
+ H2O |
Реакция с 2,4-динитрохлорбензолом
К нескольким кристаллам субстанции прибавляют 0,05 г 2,4-ДНХБ, 3 мл спирта 96 % и кипятят 1,5 мин. После охлаждения прибавляют 2 капли раствора
NaOH; появляется буро-красное окрашивание, быстро переходящее в красновато-коричневое.
|
H |
|
O |
N NH2 |
Cl |
|
|
NO2 |
|
+ |
-H2O |
N |
|
|
|
|
NO2 |
Не реакция на пиридиновый цикл!
|
H |
NO2 |
|
O N N |
|
||
|
H |
NO2 |
|
N |
OH- |
H |
|
|
|||
O |
N N |
||
|
|||
|
|
NO2 |
|
|
|
+H2O |
|
|
|
N |
|
O N O
O
Реакция с нитратом серебра
0,01 г субстанции растворяют в 5 мл воды и прибавляют 1 мл 5 % аммиачного раствора серебра нитрата; появляется темный () осадок. При
нагревании на водяной бане на стенках пробирки образуется серебряное зеркало.
|
|
|
|
H |
|
|
|
|
|
|
|
|
O |
|
N NH2 |
|
|
|
|
COONH4 |
|||||
|
||||||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
+ 4[Ag(NH3)2]NO3 + H2O |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||||
|
N |
|
|
N |
||||||||
+ 4Ag + N2 + 3NH3 + 4NH4NO3
+ N2 + 3NH3 + 4NH4NO3
Чистота
Прозрачность, цветность, рН (раствор 2,5 г/50 мл)
Гидразин и сопутствующие примеси
ТСХ: Силикагель GF254; вода – ацетон – метанол – этилацетат (10:20:20:50). Проявляют – 254 нм, а гидразин – с помощью ДМАБА (оранжевое пятно).
(H3C)2N |
|
|
N N |
Тяжёлые металлы |
N(CH3)2 |
(не более 10 ppm) |
|
Потеря в массе при высушивании (не более 0,5%)
Сульфатная зола |
ОКОР, МЧ |
(не более 0,1%) |
|
Количественное определение
ГФ РБ, Ph.Eur 6, BP 2009, Укр.Ф., Ph.Int 3
Броматометрия. Прямое титрование.Титрант – 0,0167 М KBrO3. К титруемому раствору прибавляют хлороводородную кислоту и KBr. Индикатор – МО.
|
|
|
|
|
T = |
0,1667 137,1 3 |
= 3,428 |
мг/мл |
||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
2 |
3,429 (ГФ РБ и др.) |
||||||||||
|
|
|
|
H |
|
|
||||||||||||
O |
|
N NH2 |
|
|
|
|
|
|
|
|
|
COOH |
||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
3 |
|
|
|
|
+ 2KBrO3 + 10KBr + 12HCl |
|
3 |
|
|
|
|
|
+ |
|||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
N |
|
|
|
|
|
|
|
N |
||||||||
|
|
|
|
|
+ 3N2 |
|
+ 12HBr + 12KCl + 3H2O |
|||||||||||
|
|
|
|
|
|
|||||||||||||
2011/2012 |
7 |
Жерносек А.К. Лекции по фармацевтической химии
ГФ РФ XII, JP 15
Ацидиметрия. Растворитель – смесь ледяной уксусной кислоты и уксусного ангидрида. Индикатор – кристаллический фиолетовый (нафтолбензеин – JP).
H |
H |
|
O N NH |
O N NH |
2 |
2 |
|
|
+ HClO4 |
ClO4 |
|
N |
N |
|
H
Уксусный ангидрид добавляют для того, чтобы реакция шла только по одному основному центру.
Нефармакопейные способы
Иодометрия. Обратное титрование. Избыток иода оттитровывают 0,1 М раствором натрия тиосульфата (индикатор – крахмал).
H
O
 N NH2
N NH2
 + 2I2 + 5NaHCO3
+ 2I2 + 5NaHCO3 
N COONa
+ N2  + 4NaI + 5CO2
+ 4NaI + 5CO2  + 4H2O
+ 4H2O
 N
N
Спектрофотометрия: 266 нм (УПП = 378).
Идентификация
Пиразинамид |
Этамбутол |
Рифампицин |
Натрия АС |
|
|
|
|
|
ИК-спектрометрия |
|
|
УФ |
|
УФ |
|
|
ТСХ |
|
|
Tпл = 188-191 ºС |
|
|
Сублимат - Tпл |
|
|
|
= 120-124 ºС |
+ W + FeSO4 – |
+ W + CuSO4 |
+ р-р |
+ W + FeCl3 – |
оранжевое окр., |
и разв. |
персульфата |
красновато- |
затем + NaOH – |
NaOH – |
аммония в ФБР |
коричневое окр. |
р-р тёмно-синий |
синее окр. |
(рН 7,4) – окр. |
|
|
|
измен. от оранж.- |
|
|
|
ж. до фиолет.- |
|
|
|
красн., нет осадка |
|
|
|
|
ПАА |
|
Хлориды |
|
Натрий (а) |
USP 30 – субстанция, таблетки, раствор для инъекций
ВЭЖХ. C18; метанол – водный раствор H2SO4 рН 2,5 (600:400). Детектор – 254 нм.
USP 30 – раствор для внутреннего применения Нитритометрия
|
|
H |
|
|
|
|
|
|
|
O N |
NH2 |
|
O N3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaNO2 + HCl |
|
|
|
|
+ NaCl + 2H2O |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
N |
|
|
|
N |
||||
Характеристика веществ
Пиразинамид |
Этамбутол |
Рифампицин |
Натрия АС |
|
|
|
|
БКП |
БКП Тпл |
Красновато-кор. |
Б(ПБ) КП либо |
|
около 202º |
или коричневато- |
кристаллы. |
|
|
красн. КП |
Слегка гигр. |
|
Пиразинамид |
Этамбутол |
Рифампицин |
Натрия АС |
Вода |
У |
Л |
М |
Л |
EtOH |
М |
Р |
М |
У |
MeOH |
|
|
Р |
|
CH2Cl2 |
М |
|
|
ПрН |
Ацетон |
|
|
М |
|
Спектры поглощения в УФ-области
ЛС |
Среда |
Интервал, нм |
Максимумы, нм |
Пиразинамид |
Вода |
230-350 |
268 и 310 (УПП = |
|
|
|
640-680) |
Рифампицин |
(рН 7,4) |
220-500 |
A334/A475 = 1,75 |
|
ФБР |
237, 257, 334, 475 |
Пиразинамид
2011/2012 |
8 |

Жерносек А.К. Лекции по фармацевтической химии
Чистота
|
Пиразин- |
Этамбутол |
Рифампицин |
Натрия АС |
|
амид |
|
|
|
П и Ц. |
+ |
|
|
+ |
К или Щ |
+ |
pH 3,7-4,0 |
pH 4,5-6,5 |
pH 6,5-8,5 |
|
|
(W 2%) |
(W сусп. |
(W 10%) |
|
|
|
10г/л) |
|
СПр |
ТСХ |
|
ВЭЖХ |
ВЭЖХ |
ТМ |
+ |
+ |
|
+ |
m |
W+ |
+ |
н.б. 1% |
16,0-17,5% |
CЗ |
+ |
+ |
+ |
|
ОКОР, МЧ |
|
|
+ |
+ |
+ more |
|
2-аминоBuOH |
|
Пироген- |
|
|
- ТСХ |
|
ность |
Количественное определение
ЛС |
Метод |
Пиразинамид Ацидиметрия (Ac2O; 0,1 M HClO4; потенц.) 1:1 Таблетки – СФМ (W, 268 нм).
Этамбутол Поляриметрия (+ NH3, CuSO4, NaOH) – измеряют угол оптического вращения при 436 нм; проводят сравнение со стандартным раствором.
Рифампицин Спектрофотометрия (ФБР рН 7,4; 475 нм; УПП = 187).
Капсулы – так же, извлекают из ЛФ метанолом.
Натрия АС Нитритометрия (AcOH, KBr, 0,1 M NaNO2; потенц.)
|
|
|
|
|
|
ЛС |
Фтивазид (ГФ СССР X) |
Протионамид (JP 15) |
|
|
Вн.вид |
Светло-желтый или жёлтый |
Жёлтые кристаллы или |
|
|
|
мелкокрис. П. со слабым |
кристаллический порошок. |
|
|
|
запахом ванилина |
Имеет слабый специф. запах |
|
|
Раствор. |
W – ОМ, EtOH – М, AcOH – Л; |
W – ПрН, EtOH – Р, MeOH и |
|
|
|
неорг.к-ты и Щ – Л. |
AcOH – Л; Et2O – М; р-ряется |
|
|
|
|
в разв. HCl и H2SO4. |
|
|
Идентиф. |
2,4-ДНХБ и NaOH – |
2,4-ДНХБ, KOH (спирт.) – |
|
|
|
желтовато-бурое; |
красное или ор.-красное; |
|
|
|
+NaOH – ор.-ж, затем + HCl |
+NaOH, , выделяется NH3 |
|
|
|
– переходит в желт., затем |
– посинение КЛБ. Затем + |
|
|
|
ор-жёлт. |
AcOH, выделяется H2S – |
|
|
|
+ HCl (развв.), , запах |
почернение бумаги с АС, |
|
|
|
ванилина. |
остаток – Tпл 198-293º. |
|
|
|
|
Tпл = 142-145 ºС. |
|
|
Чистота |
ГИНК (с NaNO2); ванилин; |
П и Ц, кислотность, ТМ, |
|
|
|
хлориды; сульфаты; m (н.б. |
мышьяк, m, остаток при |
|
|
|
7%), СЗ, ТМ. |
прокал. |
|
|
КО |
Ацидиметрия (лед. AсOH и |
Ацидиметрия (AсOH; 0,1M |
|
|
|
CHCl3; 0,1M HClO4; крист. |
HClO4; нафтолбензеин) 1:1 |
|
|
|
фиолет.) 1:1. |
|
|
|
|
|
|
|
ПРОТИВОМАЛЯРИЙНЫЕ СРЕДСТВА
Противомалярийные средства – группа ЛС,
используемых для этиотропного лечения и профилактики малярии.
Малярия – группа трансмиссивных инфекционных заболеваний, вызываемых
паразитическими простейшими рода Plasmodium и передаваемых человеку при укусах комаров рода Anopheles. Малярия сопровождается лихорадкой, ознобами, сплено- и гепатомегалией, анемией. Характеризуется хроническим рецидивирующимся течением.
Заболевание |
Возбудитель |
Приступы |
Трёхдневная |
P. vivax |
Через сутки |
малярия |
|
|
Четырёхдневная |
P. malariae |
Через двое суток |
малярия |
|
|
Тропическая |
P. falciparum |
Через сутки, могут |
малярия |
|
длиться 24-36 часов |
Малярия овале |
P. ovale |
Через сутки |
2011/2012 |
9 |

Жерносек А.К. Лекции по фармацевтической химии
ПРОТИВОМАЛЯРИЙНЫЕ СРЕДСТВА В АТХ
|
|
|
Противопаразитарные средства, инсектициды и |
|
|
P |
|
||
|
|
|
репелленты |
|
|
|
|
||
|
P01 |
|
Противопротозойные средства |
|
|
|
|
|
|
|
P01B |
|
Противомалярийные средства |
|
|
|
|
|
P01BA Аминохинолины |
|
|
|
|
P01BA01 Хлорохин P01BA02 Гидроксихлорохин |
|
|
|
|
P01BB Бигуаниды P01BB01 Прогуанил |
|
|
|
|
P01BС Метанолхинолины |
|
|
|
|
P01BС01 Хинин |
|
|
|
|
P01BD Диаминопиримидины P01BD01 Пириметамин |
|
|
|
|
P01BD Артемизин и его производные (индивид.) |
|
|
|
|
P01BE Артемизин и его производные (комбинации) |
|
|
|
|
P01BX Другие противомалярийные средства |
|
|
|
|
|
ХИННЫЕ АЛКАЛОИДЫ
Хинные алкалоиды – группа природных соединений, свойственных определённым
видам хинного дерева (Cinchona) и ремиджии (Remijia) семейства мареновых (Rubiaceae).
1630 г. – Дон Хуан Лопес де Канницарес излечился от лихорадки путём употребления настоя коры хинного
дерева.
1638 г. - Жена вице-короля Перу Кондеса де Цинхон (Чинчон) была вылечена от малярии с помощью порошка коры хинного дерева (??? В 1639 г. она
привезла порошок коры хинного дерева в Европу). 1632 г. – Бернабе Кобо (иезуитский миссионер) дал первое описание «иезуитской коры» и привёз её в Европу.
1639 г. – начало распространения «иезуитского порошка» в Европе (кардинал Хуан де Луго – «кардинальский порошок», «порошок де Луго»). 1742 г. – К.Линней дал хинному дереву название cinchona.
1820 г. – французские химики и фармацевты Жозеф Бьенеме
Каванту (1795-1877) и Пьер Жозеф Пеллетье (1788-1842) выделили из коры хинного дерева хинин и
цинхонин.
1907 г. – установлено химическое строение хинина (П.К.Л. Рабе).
1945 г. – синтез хинина (Р. Вудворд и В. Дёринг). 1950 г. – установлено пространственное строение
молекулы хинина (В. Прелог).
В основе хинных алкалоидов лежит |
|||||||
структура цинхонана: |
|
||||||
|
|
|
4 |
3 |
CH2 Хинин – 9-гидрокси- |
||
хинуклидин |
7 |
5 |
|||||
|
|||||||
8 |
6 |
2 |
|
6’-метоксипроизводное |
|||
|
|
9 |
N |
|
|||
5' |
|
4' |
1 |
|
|
цинхонана. |
|
6' |
|
|
3'хинолин |
|
|||
7' |
|
N |
2' |
|
|
|
|
8' |
|
|
|
|
|||
|
1' |
|
|
(8S, 9R)-6’- |
|||
|
R |
|
|
||||
OCH3 |
|
|
|
||||
|
|
|
|
метоксицинхонан-9-ол |
|||
|
|
|
|
|
|||
HO |
H |
|
H |
H |
CH2 |
||
|
|
|
N |
|
|||
|
|
|
|
|
|||
N |
|
H |
S |
|
H |
|
|
|
|
|
|
|
|
||
Хинные алкалоиды можно рассматривать как производные метанола.
Хинин - ((R)-(6-метокси-4-хинолинил)[(2S, 4S, 5R)- 5-этенил-1-азабицикло[2.2.2]-2-октил]метанол
|
|
H2C |
|
H |
|||||
|
|
|
|
Хинин обладает |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
гематошизонтоцидным |
||
|
|
|
|
|
|||||
|
HO |
|
|
N |
|
действием. Его применяют |
|||
|
|
|
|||||||
H3CO |
|
|
|
|
|
при тропической малярии |
|||
|
|
|
|
|
|
||||
|
|
|
|
|
|
в случае устойчивости МП |
|||
|
|
||||||||
|
|
N |
|
|
к хлорохину и другим ЛС. |
||||
|
|
|
|
|
|||||
2011/2012 |
10 |
