
физкал
.pdf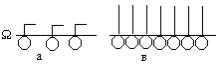
с газом). Молекулы адсорбтива могут свободно передвигаться по поверхности под действием теплового движения, поскольку поверхность жидкости однородна и равноценна для адсорбции.
Адсорбция вещества «Х» - обратимый по направлению процесс, который заканчивается установлением адсорбционного равновесия:
десорбция
Сх (Ω) Сх (v),
адсорбция
где Сх (Ω) и Сх (v) – концентрация вещества “Х” в поверхностном слое и в объеме жидкости.
Количественно величину адсорбцию (Г) здесь выражают на единицу поверхности:
Г |
(С Сv ) Vs |
(моль / м2 ) , |
(Х-3) |
|
|||
|
S |
|
|
где Vs – объем поверхностного слоя, м3;
S – площадь межфазной поверхности, м2.
На границе раздела жидкость - газ снижение свободной поверхностной энергии происходит за счет уменьшения поверхностного натяжения. При адсорбции на поверхности ПАВ это осуществляется путем их ориентации в поверхностном слое. Если концентрация ПАВ мала, то они занимают в поверхностном слое раствора горизонтальное положение (рис. Х.6,а). При достаточной концентрации – перпендикулярно поверхности (рис. Х.6,в). Образуется мономолекулярный (однослойный) слой Ленгмюра (молекулярный частокол Ленгмюра).
Рис. Х.6. Положение молекул поверхностно-активного вещества на поверхности водного раствора: а - горизонтальная ориентация; в – вертикальная ориентация.
Адсорбция зависит:
1.От природы растворенного вещества:
Система может понизить свободную поверхностную энергию Гиббса
перераспределением растворенного вещества между поверхностным слоем и объемом жидкости (рис. Х.7.).
При растворении ПАВ, у которых σ < σo снижение свободной поверхностной энергии происходит потому, что они накапливаются в поверхностном слое (СΩ > Cv). Если вычислить адсорбцию по уравнению (Х- 3) то видно, что она будет положительной (Г > 0). В случае растворения ПИВ, у которых σ > σo, будет наблюдаться отрицательная адсорбция (Г < 0), поскольку СΩ < Cv. Таким образом, и в том и другом случае распределение растворенного вещества между поверхностным слоем и объемом жидкости подчиняется принципу минимума энергии Гиббса: на поверхности

накапливается то вещество, которое обеспечивает наименьшее при данных условиях поверхностное натяжение. При растворении ПНВ СΩ = Cv, а Г = 0, т.к перераспределение растворенного вещества не изменяет поверхностное натяжение растворителя.
Рис. Х.7. Возможные случаи распределения растворенного вещества между поверхностным слоем и объемом фазы.
2. От концентрации растворенного вещества.
Адсорбцию на границе раздела жидкость–газ можно вычислить с помощью уравнения изотермы адсорбции Гиббса:
|
|
|
Г |
С |
|
d |
, |
|
|
(Х-4) |
|
|
|
RT |
dC |
||||||
|
|
|
|
|
|
|
|
|
||
где Г – количество адсорбированного вещества, моль/м2, |
||||||||||
С – |
равновесная молярная |
концентрация |
растворенного вещества, |
|||||||
моль/м3, |
|
|
|
|
|
|
|
|
||
|
d |
|
– поверхностная активность |
Дж м |
, |
|
||||
|
dC |
|
|
|
|
|
моль |
|
||
R – газовая постоянная (8,31 Дж/моль К).
Т– температура, К.
Втаком виде уравнение Гиббса применяется для разбавленных растворов. Для концентрированных растворов концентрацию надо заменить активностью.
Из уравнения видно, что если ( ddС ) < 0 (для ПАВ), то Г > 0
(положительная адсорбция); если ( ddС ) > 0 (для ПИВ), то Г < 0 (отрицательная
адсорбция).
Для определения величины адсорбции на данной границе раздела используется и уравнение изотермы адсорбции Ленгмюра*:
К С |
(Х-5) |
Г Г 1 К С |
где Г∞ - значение предельной адсорбции; С – равновесная концентрация адсорбата в системе;
К – константа адсорбционного равновесия.
Анализ уравнения изотермы адсорбции Ленгмюра:
При очень малых концентрациях, когда С → 0 и (1 + КС) ≈ 1, уравнение принимает вид Г = Г∞КС, т.е. величина адсорбции прямо пропорциональна концентрации адсорбата. При больших концентрациях, когда КС >> 1 и (1 + КС) ≈ КС. Тогда Г = Г∞. Это отвечает насыщению
поверхности адсорбента молекулами адсорбата, так как сформировался
мономолекулярный слой.
Иногда уравнение Ленгмюра пишут в несколько ином виде:
С |
|
(Х-5а) |
Г Г А С |
, |
где А – постоянная, численно равная равновесной концентрации адсорбата, при которой Г = ½Г∞.
Для нахождения числовых значений констант в уравнении изотермы адсорбции Ленгмюра (Х-5) его приводят к линейной форме:
1 |
|
1 |
|
1 |
. |
|
|
|
|||
Г |
|
Г |
Г К С |
||
______________________________________________________________
* Уравнение изотермы адсорбции выведено Ленгмюром для адсорбции газа на твердой поверхности. Однако оно справедливо для подвижных и неподвижных границ раздела и для широкого интервала концентраций. Но использовать уравнение Ленгмюра можно только при условии образования мономолекулярного слоя.
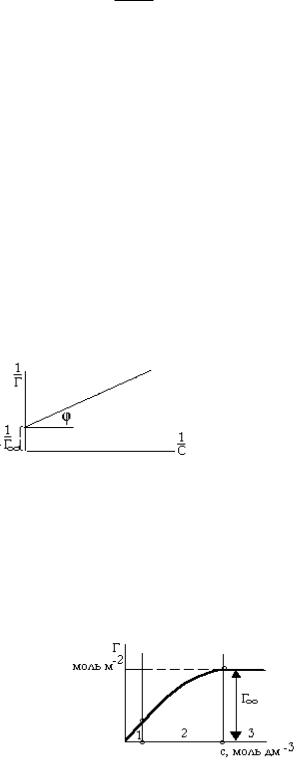
Константы К и Г∞ находят графически (рис. Х.8):
tg |
1 |
|
|
Г К |
Рис. Х.8. График для определения констант Г и К.
Графическая зависимость величины адсорбции от равновесной концентрации растворенного вещества при постоянной температуре
Г = f(C) называется изотермой адсорбции.
Общий вид изотермы адсорбции для жидких поверхностей раздела представлен на рисунке:
Рис. Х.9. Изотерма адсорбции поверхностно-активного вещества на границе раздела раствор – газ.
На кривой четко видны 3 участка. При очень малых концентрациях растворенного вещества адсорбция пропорциональна его концентрации
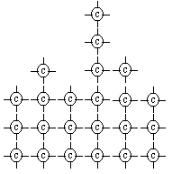
(участок 1 на изотерме адсорбции). С увеличением концентрации рост адсорбции замедляется, и этот участок изотермы изображается параболической кривой (участок 2). При больших концентрациях адсорбция достигает максимального значения (Г∞), которое не изменяется с ростом концентрации (участок 3). Это предел адсорбции, при котором наступает полное насыщение поверхности адсорбента молекулами адсорбата, так как образуется мономолекулярный слой. Графически этот участок изображается горизонтальной прямой.
3. От температуры (с ростом температуры адсорбция уменьшается). Используя представления Ленгмюра об ориентации молекул ПАВ в
мономолекулярном поверхностном слое (см. рис. Х.6), можно рассчитать площадь (S), которую занимает молекула ПАВ в адсорбционном слое и еѐ длину (толщину слоя) ℓ:
S |
|
I |
|
(Х-6) |
||
|
|
|
|
|||
Г |
|
NA |
||||
|
|
|
|
|
|
|
|
|
M Г |
|
(Х-7) |
||
|
|
ρ |
|
|||
|
|
|
|
|
||
где NА – число Авогадро;
Г∞ - предельная (максимальная) адсорбция, моль/м2; ρ – плотность ПАВ, кг/м3; М – молярная масса ПАВ, кг/моль.
В гомологическом ряду ПАВ величина адсорбции изменяется по правилу Дюкло-Траубе.
Х.5. АДСОРБЦИЯ НА НЕПОДВИЖНОЙ ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ (ГРАНИЦА РАЗДЕЛА ТВЕРДОЕ ТЕЛО – ГАЗ,
ТВЕРДОЕ ТЕЛО – ЖИДКОСТЬ)
Адсорбция на твердой поверхности происходит потому, что она содержит «активные» центры. Это неровности (выступы), где силовые поля (с) скомпенсированы частично (рис. Х.10.).
Рис. Х.10. Схема, иллюстрирующая неоднородную поверхность адсорбента.

На поверхности есть участки с большим запасом свободной поверхностной энергии Гиббса, способные притягивать молекулы веществ, которые находятся в поверхностном слое.
Х.5.1. АДСОРБЦИЯ ГАЗОВ НА ТВЕРДЫХ АДСОРБЕНТАХ
Величина адсорбции газа или пара твердым адсорбентом зависит от следующих факторов:
1)природы и площади поверхности адсорбента;
2)природы поглощаемого газа или пара;
3)температуры;
4)концентрации (или давления) газа или пара.
1. Адсорбент тем эффективней, чем мельче он измельчен и чем выше его пористость. Важной характеристикой твердых адсорбентов является их удельная поверхность Sуд. (м2/кг). В зависимости от природы адсорбенты подразделяются на неполярные (гидрофобные) – активированный уголь, тальк, фторопласт и полярные (гидрофильные) – силикагель (SiO2)n, алюмогель (Al2O3)n , глины и др.
2. Адсорбируемость газа (пара) определяется его сродством к поверхности адсорбента (полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные – на неполярных). При физической адсорбции из смеси газов или паров лучше адсорбируются газы, которые легче конденсируются в жидкость (температура кипения которых больше). Например, на активированном угле величина адсорбции газов (Г) при 298К связана с Ткип. газов так:
|
Н2 |
N2 |
CO |
CO2 |
NH3 |
Ткип, К |
14 |
77 |
83 |
195 |
240 |
Г·10-4 моль/г |
1,1 |
3,6 |
4,2 |
21 |
81 |
3.С повышением температуры физическая адсорбция уменьшается, т.к. это экзотермический процесс (ΔН < 0).
4.Зависимость величины адсорбции от концентрации (давления) газа можно представить графически в виде изотермы адсорбции (рис. Х.11):
Рис. Х.11. Изотерма мономолекулярной адсорбции.
Как видно из данного рисунка, изотерма адсорбции газа, как и для адсорбции растворенных веществ на границе жидкость-газ (cм. рис.Х-9), состоит из трех участков.
Анализ изотермы адсорбции на данной границе раздела аналогичен проведенному для подвижной поверхности раздела (Х.4).
При адсорбции газов часто наблюдается хемосорбция (см. Х.4) и
капиллярная конденсация.
Капиллярная конденсация представляет собой процесс сжижения пара в порах твердого сорбента. Пары адсорбтива конденсируются в таких порах при давлениях, меньших давления насыщенного пара над плоской поверхностью, вследствие образования в капиллярах вогнутых менисков. Так как давление пара над вогнутым мениском тем ниже, чем меньше радиус капилляра, поэтому заполнение жидкостью начинается с наиболее мелких пор. С увеличением давления пара над адсорбентом этот процесс распространяется на более крупные поры.
Теория мономолекулярной адсорбции Ленгмюра
Закономерности, которые выявляет экспериментально наблюдаемая изотерма адсорбции газов на твердых адсорбентах (рис. Х.11), как и в случае границы раздела жидкость – газ (рис. Х.9) объясняются на основе мономолекулярной теории Ленгмюра.
Теория Ленгмюра имеет следующие основные положения:
- адсорбция молекул адсорбтива происходит не на всей поверхности адсорбента, а только на активных адсорбционных центрах, всегда существующих на поверхности адсорбента. Такими центрами могут быть пики и возвышения, имеющиеся на любой, даже самой гладкой поверхности. Эти участки в результате большой ненасыщенности силового поля обладают способностью удерживать поглощаемые молекулы газа. Адсорбционный центр тем более активен, чем ненасыщеннее молекулы адсорбента на его поверхности, т.е. Gs → min;
каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что и приводит к образованию мономолекулярного слоя поглощаемого вещества;
процесс адсорбции обратим и носит динамический характер, так как адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
Время пребывания молекулы в адсорбированном состоянии на активном центре в значительной степени зависит от температуры. При низких температурах это время может быть очень большим. При высоких температурах порядка 1000 – 2000оС время пребывания молекулы в адсорбированном состоянии может равняться всего миллионным долям секунды.
Ленгмюр не учитывал силы взаимодействия между адсорбированными молекулами. Согласно Ленгмюру, время пребывания молекул газа на активных центрах не зависит от того, заняты молекулами газа соседние активные центры или нет.
Представления, развитые Ленгмюром, позволяют объяснить так называемую ступенчатую адсорбцию.
Еѐ можно объяснить, если допустить, что на поверхности адсорбента существуют активные центры, резко отличающиеся по активности. Первая ступень изотермы соответствуют, очевидно,
заполнению наиболее активных центров, происходящему уже при малых давлениях, вторая – заполнению группы активных центров с меньшей активностью, что требует более высоких давлений и т.д.
Полимолекулярная адсорбция.
Теории полимолекулярной адсорбции Поляни и БЭТ
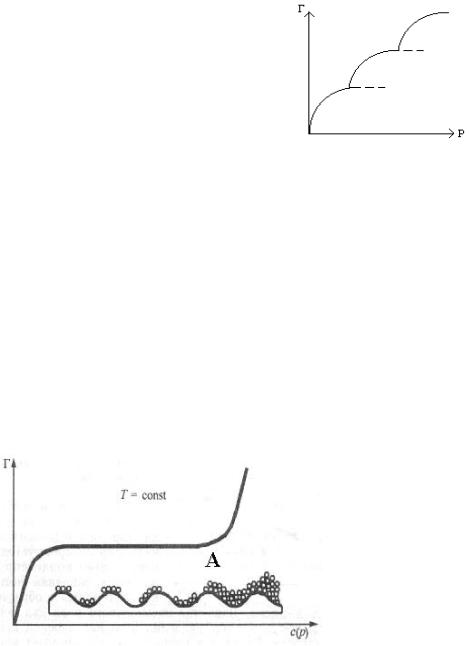
На практике часто встречаются изотермы, у которых после участка 3 (см. рис. Х.11), соответствующего насыщению поверхности адсорбента, наблюдается резкое увеличение величины адсорбции (рис. Х.12, точка А). Это можно объяснить переходом от мономолекулярной адсорбции к полимолекулярной (многослойной), вследствие наслаивания адсорбированных молекул друг на друга.
Рис. Х.12. Изотерма полимолекулярной адсорбции.
Для объяснения этого явления Поляни предложил теорию полимолекулярной адсорбции. Кратко исходные положения этой теории можно представить так:
1.Адсорбция обусловливается чисто физическими силами.
2.На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи от поверхности адсорбента и образуют около этой поверхности со стороны газовой фазы непрерывное силовое поле.
3.Адсорбционные силы действуют на расстояния, большие, чем размеры отдельных молекул адсорбтива. Поэтому можно предположить
существование у поверхности адсорбента адсорбционного объема, который заполняется при адсорбции молекулами адсорбтива.
4.Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии практически становится равным нулю.
5.Притяжение данной молекулы поверхностью адсорбента не зависит от наличия в адсорбционном пространстве других молекул, вследствие чего и возможна полимолекулярная адсорбция.
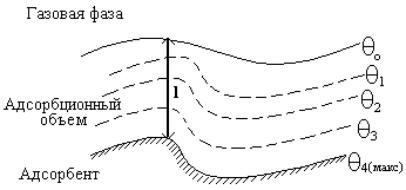
Теория Поляни не позволяет вывести уравнения изотермы адсорбции. На рисунке (Х.13) схематически показан разрез адсорбционного
объема, отвечающий представлениям теории полимолекулярной адсорбции. В адсорбционном объеме имеются поверхности с одинаковым адсорбционным потенциалом (θ). На рисунке поверхности с одним и тем же адсорбционным потенциалом обозначены пунктирными линиями. Максимальный адсорбционный потенциал должен иметь место на границе адсорбент - адсорбционный объем. На границе адсорбционного объема с газовой фазой, где кончается действие адсорбционных сил, потенциал (θ) должен быть равным нулю.
Рис. Х.13. Схема адсорбционного объема по представлениям полимолекулярной теории адсорбции.
Таким образом, кратко рассмотрены две теории адсорбции – теория мономолекулярной адсорбции Ленгмюра и теория полимолекулярной адсорбции Поляни. Нельзя однозначно ответить на вопрос, какая из этих теорий более правильная. В зависимости от природы адсорбента и адсорбтива, условий адсорбции в одних случаях применима одна, а в других
– другая теория адсорбции. Теория Поляни применима только к явлениям чисто физической адсорбции. Теория Ленгмюра объясняет с известными ограничениями явления как физической, так и химической адсорбции.
Представления Ленгмюра и Поляни обобщены Брунауэром, Эмметом и Теллером применительно к адсорбции паров. Их теория получила название теории БЭТ по первым буквам имен авторов. Основные положения теории БЭТ следующие:
1. На поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров, способных удерживать молекулы адсорбтива.

2.Адсорбционные молекулы не взаимодействуют между собой.
3.Каждая молекула предшествующего слоя представляет собой возможный центр для адсорбции и образования последующего слоя.
Теория БЭТ, как и теория Ленгмюра 
 дает аналитическое уравнение для изотермы адсорбции, которая в этом случае имеет S-образную форму:
дает аналитическое уравнение для изотермы адсорбции, которая в этом случае имеет S-образную форму:
А


Х.5.2. АДСОРБЦИЯ ИЗ РАСТВОРОВ НА ТВЕРДЫХ АДСОРБЕНТАХ
Величина адсорбции (Г) из растворов как и для газов, определяется на единицу массы адсорбента (m):
Г (Со С) V , (моль / кг) , m
где Со и С – исходная и равновесная молярные концентрации вещества в растворе, моль/м3,
V – объем раствора, м3.
Для определения величины адсорбции определенные навески твердого адсорбента вносят в одинаковые объѐмы растворов адсорбируемого вещества разной концентрации и выдерживают до установления адсорбционного равновесия.
Х.5.3. Смачивание
Процесс смачивания является начальной стадией взаимодействия жидкостей с твердыми телами.
Смачивание – это физико-химический процесс самопроизвольного увеличения площади контакта жидкостей с поверхностью твердого тела под действием поверхностных сил.
Взаимодействие жидкости с поверхностью твердого тела может быть различным. Например: при контакте капли воды и капли ртути с чистым стеклом наблюдается следующее: вода частично растекается по стеклу - наблюдается смачивание (рис. Х.14, а), а в случае ртути – несмачивание (рис.
Х.14, б).
Рис. Х.14. Краевые углы смачивания.
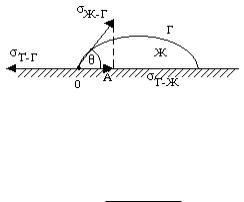
Количественной мерой смачивания является краевой угол смачивания (θ). Это угол, который образует капля с поверхностью твердого тела со стороны жидкости, т.е. угол между твердой поверхностью и касательной в точке соприкосновения фаз.
Если θ < 90о (cos θ > 0), то жидкость смачивает данную поверхность (рис. Х.14, а), а если θ > 90о (cos θ < 0), то жидкость не смачивает данную поверхность (рис. Х.14, б).
Угол смачивания θ, который устанавливается при контакте капли жидкости с твердой поверхностью (рис. Х.14′), зависит только от поверхностного натяжения на границах раздела фаз твердое тело- жидкость-газ (σТ-Ж, σЖ-Г, σТ-Г).
Рис. Х.14′. Краевой угол при равновесном контактном смачивании. Связь между углом смачивания и поверхностными натяжениями в
трехфазной системе выражает уравнение Юнга:
cos θ σТ-Г σТ Ж , σЖ Г
где σТ-Г = σТ-Ж + σЖ-Г ∙ cos θ.
Из уравнения следует, что на процесс смачивания можно влиять, изменяя поверхностное натяжение в данной системе. Это используется в фармацевтической технологии.
При контакте твердой фазы с двумя несмешивающимися жидкостями: полярной и неполярной лучше смачивать твердую поверхность будет та жидкость, у которой разность полярностей с твердым телом меньше.
Энтальпия смачивания (∆Нсмачив) – это теплота, которая выделяется при смачивании 1 кг порошка или 1 м2 поверхности твердого тела жидкостью.
Твердые поверхности, которые смачиваются водой, называются
гидрофильными, а которые смачиваются неполярными жидкостями – гидрофобными. Например, активированный уголь – гидрофобный, а крахмал, оксид кремния, агар-агар – гидрофильные поверхности.
Для порошков и пористых веществ трудно измерить краевой угол смачивания. В этом случае используют другую количественную характеристику процесса смачивания – коэффициент гидрофильности.
Коэффициент гидрофильности (Б):
|
Б = |
Н в смач |
, |
|
Нсмачм |
||
|
|
|
|
где Н смачв |
- энтальпия смачивания твердой поверхности водой, |
||
Н смачм |
- энтальпия смачивания |
твердой поверхности жидким |
|
углеводородом (маслом).
Энтальпию смачивания определяют калориметрическим методом.
