
физкал
.pdf2. В золь вводится неиндифферентный электролит, имеющий ионы, противоположные по знаку ПОИ данного золя.
Например, к золю AgJ, стабилизированному KJ, добавлен AgNO3. Это приведет к тому, что ионы Ag+, способные достроить кристаллическую решетку AgJ, образуют с ПОИ золя (J-) малорастворимое соединение, что приведет к постепенному снижению величины ζ – потенциала до нуля. Дальнейшее увеличение концентрации AgNO3 может привести к тому, что ионы Ag+ сообщат положительный знак заряда электронейтральной поверхности AgJ (произойдет перезарядка твердой поверхности).
Итак, введение в золь растворов электролитов приводит к изменению строения ДЭС и изменению абсолютной величины дзета-потенциала.
Величину ζ – потенциала определяют по:
- Скорости электрофореза (V):
V |
o E |
(уравнение Гельмгольца-Смолуховского) |
(XI-10), |
K |
где ε – относительная диэлектрическая проницаемость среды; εо – электрическая постоянная, равна 8,9∙10-12 Ф/м; Е – ЭДС, В;
К – коэффициент, значение которого зависит от формы частиц; η – вязкость среды, Н∙с/м2; ℓ - расстояние между электродами, м.
Скорость электрофореза при Е = 1 В/см называется электрофоретической подвижностью. Эта величина строго постоянная для каждого вещества, поэтому используется в качественном анализе (антибиотиков, витаминов и др.).
- Скорости перемещения дисперсионной среды в электрическом поле (скоро-
сти электроосмоса):
ζ = |
К π η χ υ |
(XI-11) |
|
ε εо J |
|||
|
|
где χ – удельная электрическая проводимость золя; J – сила тока;
υ – объемная скорость, т.е. объем жидкости, перенесенной через пористую мембрану за единицу времени.
XI.1.7. Устойчивость и коагуляция коллоидных систем
Устойчивость дисперсных систем – это способность дисперсной фа-
зы сохранять во времени постоянство дисперсности частиц и состояние равномерного распределения их во всем объеме дисперсионной среды.
Коллоидные растворы являются термодинамически неустойчивыми системами. Причина – наличие избытка свободной поверхностной энергии в
результате их гетерогенности: |
Gs = σ∙S. |
Вних самопроизвольно происходят процессы, сопровождающиеся
уменьшением свободной поверхностной энергии (∆GS<0). Одним из таких самопроизвольно протекающих процессов является объединение коллоидных частиц в более крупные агрегаты, приводящее к уменьшению суммарной поверхности раздела фаз (∆S < 0).
Вдисперсных системах различают седиментационную (кинетическую)
иагрегативную устойчивость.
Седиментационная устойчивость – это устойчивость к оседанию дисперсной фазы под действием силы тяжести.
Факторами этой устойчивости являются: размер частиц, их способность участвовать в броуновском движении и вязкость дисперсионной среды, которые обуславливают энтропийный фактор устойчивости.
Агрегативная устойчивость – это устойчивость частиц дисперсной фазы к агрегации – объединению частиц в более крупные агрегаты, т.е. способность сохранять неизменными свои размеры.
Агрегативную устойчивость обеспечивают два основных фактора:
электростатический и адсорбционно-сольватный.
Электростатический фактор защиты обусловлен наличием ДЭС на поверхности частиц дисперсной фазы и определяется величиной дзета– потенциала. ζ – потенциал создает электростатические силы отталкивания.
Адсорбционно-сольватный барьер защиты определяется наличием на поверхности противоинов диффузного слоя гидратных оболочек из ориентированных диполей воды с большой плотностью (ρ), вязкостью (η) и упругостью. Это приводит к возникновению в тонких жидких пленках, разделяющих 2 твердые поверхности одноименно заряженных коллоидных частиц (поверхности ядер), расклинивающего давления. Величина расклинивающего давления зависит от заряда твердой фазы (величины υ потенциала) и, глав-
ным образом, от толщины диффузного слоя коллоидной частицы (величины
ζ – потенциала). Чем выше заряд твердой фазы, чем больше толщина диффузного слоя и больше значение ζ – потенциала, тем больше расклинивающее давление между частицами и выше агрегативная устойчивость коллоидного раствора.
Агрегативную устойчивость коллоидных растворов с ионным стабилизатором можно рассматривать как результат взаимодействия 2-ух противоположно направленных сил, которые одновременно действуют на сближающиеся коллоидные частицы:
-вандерваальсовых сил межмолекулярного притяжения, приводящих к агрегации частиц;
-электростатических сил отталкивания.
Силы молекулярного притяжения действуют на расстояниях, соизмеримых с размерами коллоидных частиц. Расстояние, на котором проявляется электростатическое отталкивание, зависит от толщины диффузного слоя.
При большой толщине диффузных слоев, когда ζ – потенциал больше 30 мВ (рис. XI.8, а) их перекрытие и электростатическое отталкивание прояв-
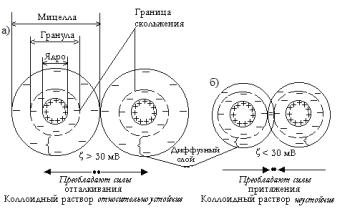
ляются на расстояниях, при которых молекулярное притяжение слабое и коллоидные частицы не агрегируют.
Когда диффузный слой тонкий и ζ – потенциал меньше 30 мВ (рис. XI.8, б), упругие свойства диффузного слоя невелики, поэтому при столкновении мицелл происходит перекрывание этих слоев, что приводит к преобладанию сил притяжения и потере агрегативной устойчивости. Таким образом, коллоидные растворы с ионным стабилизатором агрегативно неустойчивы, если их частицы имеют ζ < 30 мВ, относительно устойчивы, если 30 < ζ < 50 мВ, и устойчивы при ζ > 50мВ.
Рис. XI.8. Схема агрегативной устойчивости мицелл коллоидных растворов.
Коагуляция – это процесс слипания коллоидных частиц из-за потери агрегативной устойчивости с образованием более крупных агрегатов.
Вызывать коагуляцию могут различные факторы: концентрирование раствора, уменьшение и увеличение температуры, различные виды излучения, добавление электролитов. При коагуляции изменяются размеры и число частиц дисперсной фазы.
Коагуляция под действием электролитов
В биологических системах наибольшее практическое значение имеет коагуляция при добавлении электролитов, поскольку коллоидные растворы клеток и биологических жидкостей находятся в контакте с электролитами. Коагуляцию коллоидного раствора может вызвать любой электролит. В то же время для каждого электролита необходима своя минимальная концентрация
– порог коагуляции (Спор).
Порог коагуляции – это минимальная концентрация электролита, которая вызывает явную коагуляцию коллоидного раствора (помутнение раствора или изменение его окраски).
Порог коагуляции можно рассчитать по формуле:
Спор |
|
Cэл та |
Vэл та |
(XI.12) |
||
Vзоля |
Vэл та |
|||||
|
|
|
||||
Коагулирующая способность (γ) = 1/Спор |
(XI.13) |
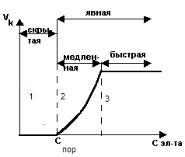
Зависимость скорости коагуляции (Vk) от концентрации (С) коагулирующего электролита изображена на рисунке:
Различают скрытую коагуляцию и явную, которая в свою очередь разделяется на медленную и быструю.
Скрытая коагуляция – это стадия агрегации, при которой не наблюдается никаких внешних изменений золя, но в ультрамикроскопе можно наблюдать образование частиц 2-го, 3-го порядка. Точка С выражает одновременно порог коагуляции и критический потенциал, с которых начинается явная коагуляция.
Явная коагуляция – это такой процесс агрегации, при котором обнаруживаются видимые изменения: изменяется цвет раствора, появляется мутность и постепенно - осадок.
При медленной коагуляции скорость коагуляции резко возрастает с изменением концентрации электролита. В области быстрой коагуляции увеличение концентрации электролита не изменяет скорость коагуляции
(Vk=const).
Коагуляция золей электролитами подчиняется правилу Шульце-Гарди:
Коагуляцию коллоидных растворов вызывают любые ионы, которые заряжены противоположно грануле. Коагулирующая способность иона-коагулятора тем больше, чем выше его заряд.
f (z 6 ) ,
где z – заряд иона-коагулятора.
Например, коагуляцию золя AgJ с отрицательным зарядом гранул при
добавлении к нему растворов NaCl, CaCl2 и AlCl3 будут вызывать ионы Na+, Ca2+, Al3+.
γ(Na+) : γ(Са2+) : γ(Al3+) = 1 : 64 : 729.
Сильное влияние электролита на коагуляцию коллоидных растворов надо учитывать при введении растворов солей в живые организмы. Имеет значение не только концентрация вводимых ионов, но и их заряд. Например, изотонический раствор NaCl нельзя заменить раствором MgSO4, поскольку в этой соли имеются ионы Mg2+ и SO42-, обладающие более высокой коагулирующей способностью, чем ионы Na+ и Cl-.
При инъекциях электролита надо вводить его медленно, чтобы не вызвать коагуляцию биологических коллоидных систем.
При коагуляции смесями электролитов может наблюдаться: - аддитивное действие;

-антагонизм;
-синергизм.
Аддитивность – это суммирование коагулирующего действия ионов, вызывающих коагуляцию.
Например, смесь солей KCl и NaNO3 проявляет аддитивное действие по отношению к коллоидным растворам, как с положительным, так и с отрицательным зарядом гранул.
Антагонизм – это уменьшение коагулирующего действия одного электролита в присутствии другого.
Антагонизм действия наблюдается, например, при добавлении к золю с отрицательным зарядом гранул смеси электролитов NaCl и CaCl2.
Синергизм – это усиление коагулирующего действия каждого из ионов-коагуляторов в присутствии другого иона-коагулятора в смеси.
Примером такого действия может быть смесь CaCl2 и LiCl в их действии на золь HgS.
На рисунке представлена схема совместного действия 2-х электролитов на золь. На осях координат графика отложены концентрации коагуляции одного из электролитов, т.е. их количество, принятое за 100%, которое вызывает быструю коагуляцию золя в отсутствие второго электролита. В случае аддитивности для коагуляции золя одним из электролитов при концентрации меньшей, чем 100% потребуется добавление соответствующего количества второго. Так, если одного взято
70% от концентрации коагуляции, то второго потребуется добавить 30% (в сумме 100%) и т.д. Такое аддитивное действие электролитов изображается прямой 1. При антагонизме в действии электролитов (кривая 2) видно, что на 70% концентрации 1-го электролита нужно уже не 30% концентрации коагуляции 2-го, а больше, например 55%. Таким образом, сумма их концентраций станет больше100%. При синергизме для 70% от концентрации коагуляции первого электролита достаточно добавить, например, только 15% от концентрации коагуляции второго электролита (в сумме меньше 100%), чтобы получить быструю коагуляцию золя. Этой зависимости соответствует кривая 3.
При введении в организм различных лекарственных веществ в виде инъекций следует учитывать, что они могут быть антагонистами, синергистами или проявлять аддитивность (будет изучаться в курсе клинической фармакологии).
Взаимная коагуляция – это коагуляция, которая наблюдается при смешивании двух коллоидных растворов с противоположным зарядом гранул.
Взаимную коагуляцию можно рассматривать как частный случай электролитной коагуляции, если один из золей принять в качестве электролита с
огромным ионом-коагулятором. Так, например, положительно заряженную коллоидную частицу золя Fe(OH)3 можно рассматривать по отношению к отрицательному золю As2S3 как ион-коагулятор, прибавление которого снижает величину ζ-потенциала частиц этого золя. Как и при обычной электролитной коагуляции, золь-коагулятор должен быть добавлен к коагулируемому золю в каком-то определенном количестве, чтобы коагуляция стала заметной.
Однако между обычной электролитной коагуляцией и взаимной коагуляцией имеется существенное различие. Оно заключается в том, что при определенном соотношении количеств смешиваемых золей при взаимной коагуляции всегда наступает перезарядка, тогда как при обычной коагуляции перезарядка происходит редко, только при действии многозарядных ионовкоагуляторов.
Чтобы вызвать полную коагуляцию, т.е. полное выпадение дисперсной фазы обоих золей, последние должны быть взяты в количествах, обеспечивающих эквивалентность положительных и отрицательных зарядов, т.е. чтобы ζ-потенциал смеси стал равным нулю.
Например, при взаимной коагуляции золей Fe(OH)3 и As2S3, если соответственно взять их в объемном соотношении, равном 9:1, коагуляция не наблюдается, а при соотношениях 7:3; 5:5 идет усиливающееся частичное осаждение, но с сохранением во всех случаях положительного заряда частиц. При соотношении 3:7 наступает почти полное осаждение, а ζ- потенциал равен 0. При дальнейшем увеличении объема в пользу As2S3 происходит перезарядка смеси с(+) на (-) и неполное выпадение осадка и только при соотношении примерно 1:100 коагуляция опять не обнаруживается.
Взаимная коагуляция используется при очистке природных и промышленных вод.
Явление привыкания – это повышение устойчивости золя к коагулирующему действию электролита при уменьшении скорости его поступления.
Это наблюдается, если электролит добавлять к золю малыми порциями через большие интервалы времени. В этом случае Спор. будет больше, чем при добавлении сразу большого количества электролита. В организме это явление проявляется в привыкании к некоторым лекарствам, курению, наркотикам.
Чередование зон коагуляции
При добавлении одно- и двухзарядных ионов-коагуляторов, например, К+ и Са2+ к коллоидному раствору с отрицательным зарядом частиц происходит постепенное понижение его ζ потенциала и при его критическом значении (ζ1 кр.) золь переходит в неустойчивое состояние – коагулирует. На рисунке (XI.9, кривые 1 и 2) это показано 2-мя зонами: устойчивого золя и коагуляции.
В случае добавления многозарядных противоионов Al3+ и Th4+ (рис. XI.9, кривые 3 и 4) наблюдаются 2 зоны стабильности и 2 зоны коагуляции. В этом случае отрицательный ζ потенциал постепенно понижается, доходит до

критического значения (ζ1 кр.). Это I зона коагуляции. Затем ζ потенциал переходит через изоэлектрическую точку (ζ = 0). При увеличении концентрации многозарядных ионов наблюдается перезарядка (образуется золь с положительным зарядом гранул) и повышение положительного ζ – потенциала. Положительный ζ-потенциал достигает максимальной величины и постепенно понижается до второго критического значения (ζ2 кр.). Золь при этом коагулирует уже под действием ионов NO3- (2-я зона коагуляции). Такое чередование состояний электронейтральности и заряженности частиц золя называют чередованием зон коагуляции.
Рис. XI.9 Зависимость ζ-потенциала золя от концентрации введенных электролитов.
1 – KCl, 2 – Ca(NO3)2, 3 – Al(NO3)3, 4 – Th(NO3)4; заштрихованная об-
ласть соответствует неустойчивому состоянию золя.
Теории коагуляции
Адсорбционная теория. Согласно этой теории коагулирующее действие электролитов объясняется адсорбцией ионов-коагуляторов на поверхности коллоидных частиц. В результате этого заряд коллоидных частиц нейтрализуется.
Теория коагуляции Дерягина и Ландау, Фервея и Овербека (ДЛФО) объясняет коагуляцию уменьшением толщины диффузного слоя под влиянием ионов – коагуляторов. При достижении пороговой концентрации электролита толщина диффузного слоя уменьшается, снижается расклинивающее давление и сильнее начинают действовать силы межмолекулярного притяжения. Вследствие этого происходит потеря агрегативной, а затем и кинетической устойчивости. (Механизм влияния электролитов на величину дзета-потенциала рассмотрен ранее).
При добавлении, например, нитратов к коллоидному раствору AgJ, мицеллы которого содержат противоионы NO3-, происходит постепенное перемещение противоионов диффузного слоя в адсорбционный. Толщина диффузного слоя при этом уменьшается и может наступить такое состояние, при котором диффузный слой исчезнет совсем и гранула станет электронейтральной. В таком состоянии расклинивающее давление между сближающимися частицами минимально, что приведет к их объединению в более крупные агрегаты – коагуляции.

Схематически процесс уменьшения толщины диффузного слоя данной коллоидной частицы AgJ при добавлении нитратов можно представить так:
схема строения мицеллы золя AgJ (стабилизатор – AgNO3)
+ - x+ - z NO (иио коагулятор)
{[mAgJ]∙nAg ∙(n – x)NO3 } ∙xNO3 3
→ {[mAgJ]∙nAg+∙nNO3-}o
схема строения мицеллы AgJ в изоэлектрическом состоянии
Поскольку заряд гранул в этих условиях равен 0, то в электрическом поле они не проявляют направленного движения к электродам (коллоидная частица находится в изоэлектрическом состоянии).
Изоэлектрическое состояние – это состояние коллоидных частиц, при котором их ζ-потенциал = 0 и гранулы не передвигаются в электрическом поле.
Коллоидная защита
Коллоидная защита – это повышение агрегативной устойчивости лиофобных золей при добавлении некоторых веществ.
Такими веществами являются ВМС (белки, полисахариды) и некоторые коллоидные ПАВ. Например, если к золю Fe(OH)3 добавить небольшое количество раствора желатина, то для коагуляции такого золя потребуется намного больше электролита, чем для коагуляции незащищенного золя. Объясняется коллоидная защита адсорбцией защитных веществ на поверхности коллоидных частиц. Коллоидные ПАВ и ВМС ориентируются на поверхности коллоидных частиц: гидрофобными участками к частицам дисперсной фазы, а гидрофильными наружу, к воде. Cистема при этом лиофилизируется, мицеллы приобретают дополнительный фактор агрегативной устойчивости за счет гидратных оболочек защищающих веществ (рис. XI.10).
Рис. XI.10. Схема защитного действия макромолекул ВМС на частицы коллоидного раствора.
Основными условиями защитного действия являются:
хорошая растворимость ВМС в дисперсионной среде коллоидного раствора;
хорошая адсорбируемость молекул ВМС на коллоидных частицах;
достаточно большая концентрация ВМС, которая обеспечивает образование мономолекулярного адсорбционного слоя из макромолекул ВМС, полностью покрывающего всю поверхность мицелл золя.
Наибольшее защитное действие отмечается при одноименных зарядах
ВМС и коллоидной частицы.
Способность защищать золи от коагуляции количественно выражают защитным числом. Это число мг сухого ВМС, которое защищает 10 мл данного золя от коагуляции его одним мл 10% раствора NaCl.
Коллоидная защита используется при получении ряда лекарственных препаратов. Например, протаргол и колларгол содержат соответственно 8 и 70% серебра, к которому добавлен белок.
Пептизация
Пептизация – это процесс превращения осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор.
Пептизация представляет собой процесс, обратный коагуляции. Пептизировать можно только рыхлые и «свежие» осадки. Различают 3
способа пептизации:
-адсорбционная пептизация;
-химическая (диссолюционная) пептизация;
-промывание осадка (коагулята) чистым растворителем (дисперсионной
средой).
Например, если к раствору FeCl3 прибавить водный раствор аммиака, то образуется осадок Fe(OH)3:
FeCl3 + 3NH3∙Н2О → Fe(OH)3↓ + 3NH4Cl.
Перевести этот осадок в раствор (пептизировать) можно двумя путями:
1) Добавить к нему избыток раствора FeCl3 (пептизатор). Это пример адсорбционной пептизации. «Родственные» ионы Fe3+ будут адсорбироваться на частицах осадка, и сообщать им положительный заряд. Частицы осадка в результате электростатического отталкивания одноименных зарядов будут переходить во взвешенное состояние – золь.
Строение мицеллы этого золя можно представить так:
m[Fe(OH)3 ]nFe3 3(n x)Cl 3x 3xCl .
2)Добавлять HCl. Это диссолюционная химическая пептизация. В этом случае пептизатор образуется в результате реакции:
Fe(OH)3 + HCl FeOCl + 2H2O FeOCl → FeO+ + Cl-
пептизатор
Ионы FeO+ в соответствии с правилом Панета-Фаянса будут избирательно адсорбироваться на частицах осадка Fe(OH)3. Мицелла образовавшегося золя в этом случае имеет такое строение:
m[Fe(OH)3 ] nFeO (n x)Cl x xCl .
При промывании коагулята чистым растворителем удаляются из системы ионы, вызвавшие коагуляцию.
Процесс пептизации лежит в основе лечения атеросклероза, «камней» в желче- и мочевыводящих путях и тромбов в кровеносных сосудах под дей-
ствием антикоагулянтов.
Изучение процессов коагуляции и пептизации представляет большой интерес для медиков в связи с тем, что коллоиды клеток и биологических жидкостей организма подвержены коагуляции. Образование тромбов в кровеносных сосудах, слипание эритроцитов представляют собой процессы, аналогичные коагуляции. Одной из причин вышеназванных патологических изменений могут быть электролиты, поскольку коллоиды всех клеток организма находятся в постоянном контакте с электролитами и малейшее изменение постоянства концентрации ионов или качественного состава их может привести к нарушению агрегативной устойчивости коллоидов - коагуляции. В организме имеют место: явление привыкания (к алкоголю, наркотикам и некоторым лекарственным препаратам); действие смеси электролитов или многокомпонентных лекарственных препаратов.
XI.2. Аэрозоли
Аэрозоли широко распространены в природе. Облака и тучи, цветочная пыльца, семена и споры растений, а также обитающие в воздухе микроорганизмы и вирусы – все это аэрозоли, наполняющие воздушную среду, окружающую человека.
Аэрозолями называются дисперсные системы, в которых дисперсионной средой является газ (воздух), а дисперсной фазой - твердые или жидкие частицы с размерами 10-7-10-4 м.
По агрегатному состоянию дисперсной фазы аэрозоли классифицируют
на:
1)дымы, пыли (дисперсная фаза – твердые частицы). Это системы т/г;
2)туманы (дисперсная фаза – жидкость). Это системы ж/г.
Основные источники образования аэрозолей:
природные аэрозоли – туманы, дымы, пыли;
промышленные предприятия (аэрозоли, содержащие частицы С, SiO2, углеводороды, радиоактивные вещества и др.); авто- и авиатранспорт и др.;
микробиологические и бактериальные аэрозоли;
аэрозоли, получаемые искусственным путем.
Как и лиофобные коллоиды, аэрозоли получают:
1) Методом конденсации:
-пар высокой концентрации охлаждают при быстром расширении;
-в результате химических реакций:
HCl (г) + NH3 (г) NH4Cl (т) – образуется дым;
Н2О (г) + SO3 (г) H2SO4 (ж) – образуется туман;
