
физкал
.pdfгорения: «курительные сборы», используемые в медицине и топочный дым, который образуется при сгорании топлива;
окисления металлов на воздухе. В металлургических и химических процессах образуются дымы, состоящие из частиц оксидов металлов.
2)Диспергированием (измельчением твердых частиц или распылением жидкостей).
Вбытовых условиях средством получения аэрозолей является устройство «аэрозольный баллон». Вещество в нем упаковывается под давлением и распыляется при помощи сжиженных или сжатых газов.
Молекулярно-кинетические свойства аэрозолей подчиняются тем же закономерностям, что и лиозоли. Но броуновское движение, диффузия и седиментация частиц аэрозоля происходит быстрее, чем у лиозолей. Особенности молекулярно-кинетических свойств аэрозолей обусловлены:
малой концентрацией частиц дисперсной фазы – так, если в 1 см3 гидрозоля золота содержится 1016 частиц, то в таком же объеме аэрозоля золота - менее 107 частиц;
малой вязкостью дисперсионной среды – воздуха, следовательно, малым коэффициентом трения, возникающего при движении частиц;
малой плотностью дисперсионной среды, следовательно,
ρчастиц д.ф. >> ρгаза.
По оптическим свойствам аэрозоли похожи на коллоидные растворы. Но из-за большой разницы в показателях преломления света дисперсной фазы и дисперсионной среды светорассеяние в аэрозолях проявляется сильнее, и они дают более четкий конус Тиндаля, чем лиозоли.
Для аэрозолей характерны термофорез, термопреципетация и фотофорез.
Термофорез – это движение частиц аэрозоля в область более низких температур.
Термопреципетация – это осаждение частиц аэрозоля на холодных поверхностях.
Фотофорез – это направленное движение аэрозольных частиц под действием светового излучения.
Электрические свойства частиц аэрозолей значительно отличаются от электрических свойств частиц в лиозолях:
1. У частиц дисперсной фазы аэрозолей отсутствует двойной электрический слой, т.к. в газовой среде практически не происходит электролитическая диссоциация. Однако частицы дисперсной фазы аэрозолей часто имеют электрический заряд. Например, частицы аэрозолей металлов и их оксидов (Zn, ZnO, MgO, Fe2O3) обычно несут отрицательный заряд, а частицы аэрозолей неметаллов и их оксидов (SiO2, P2O5) заряжены положительно. Положи-
тельно заряжены частицы NaCl, крахмала, а частицы муки несут отрицательные заряды.
2.Заряд частиц аэрозолей возникает в результате трения или адсорбции ионов газов, которые образуются под действием различного рода излучений.
3.Для частиц аэрозолей одной природы и одинакового размера заряд может быть различным по величине и по знаку. Заряд частицы может изменяться во времени (по величине и по знаку).
Седиментационная устойчивость аэрозолей обеспечивается высокой интенсивностью броуновского движения частиц дисперсной фазы в газовой среде.
Агрегативная устойчивость аэрозолей гораздо меньше, чем коллоидных растворов, что связано с отсутствием на поверхности аэрозольных частиц сольватных оболочек, которые могли бы создавать расклинивающее давление между частицами при их сближении. Поэтому аэрозоли коагулируют с большей скоростью, чем лиозоли.
Итак, аэрозоли – седиментационно и агрегативно неустойчивые системы. Их длительное существование связано с их высокой дисперсностью и малой концентрацией.
Аэрозоли можно разрушить путем взаимной коагуляции, ультразвуком, токами высокого напряжения, фильтрацией.
Аэрозоли нашли широкое применение в медицине. Стерильные аэрозоли применяют для стерилизации операционного поля, обработки ран и ожогов. Ингаляционные аэрозоли, содержащие антибиотики и другие лекарственные вещества, применяют для лечения дыхательных путей. Аэрозоли в виде клея применяют в хирургической практике для склеивания ран, кожи, бронхов, сосудов и т.д.
Взвеси бактерий и вирусов - микробиологические и бактериальные аэрозоли являются одним из путей передачи инфекционных болезней: туберкулеза легких, гриппа, острых респираторных заболеваний и т.д. Вредные пыли промышленных предприятий вызывают болезни легких (пневмокониозы). Так, аэрозоли, содержащие частицы угля, вызывают заболевания легких
-антракоз, оксида кремния(IV)- силикоз, асбеста - асбестоз.
В аэрозольных упаковках используются: средства бытовой химии, пищевые продукты, смазочные мыла, антикоррозионные покрытия, парфюмер- но-косметические средства и др.
Порошки
Порошки - это свободно – дисперсные системы, у которых дисперси-
онная среда – газ, а дисперсная фаза – твердое тело с размерами частиц 10-
8 – 10-4 м.
Получают порошки диспергированием и в результате процессов окисления, восстановления, электролиза и др.
Порошки характеризуются такими свойствами, как:
1)распыляемость – способность частиц дисперсной фазы перемещаться под действием внешней силы;
2)гигроскопичность – способность поглощать влагу. Еѐ можно увеличить или уменьшить путем добавления ПАВ;
3)гранулирование – способность образовывать гранулы (частицы большего размера). Гранулирование может происходить самопроизвольно или путем добавления к порошку определенного количества жидкости. Гранулы служат промежуточным продуктом, из которого получают таблетки. Гра-
нулированные продукты меньше распыляются и слеживаются. Их удобнее дозировать и хранить.
Лекарства в виде порошков, гранул и таблеток составляют до 80% лекарственных средств.
Фармацевтические порошки могут быть однокомпонентными (глюкоза, анальгин и др.) и многокомпонентными (кофеин – бензоат и др.).
XI.3. Суспензии
Суспензии – это микрогетерогенные системы, в которых дисперсионной средой является жидкость, а дисперсная фаза твердая с размерами частиц 10-4-10-6 м.
Способы получения суспензий такие же, как и золей (диспергирование и конденсация).
По молекулярно-кинетическим свойствам суспензии резко отличаются от золей. У суспензий из-за больших размеров частиц практически отсутствуют броуновское движение, диффузия и осмотическое давление. Суспензии мутные, т.к. световые лучи преломляются и отражаются частицами суспензий, а не рассеиваются. У суспензий большая скорость седиментации (се- диментационно-неустойчивые системы).
Агрегативная устойчивость разбавленных суспензий сходна с таковой у лиофобных золей. Но суспензии являются более агрегативно устойчивыми системами, так как содержат более крупные частицы и, следовательно, имеют меньшую свободную энергию.
Для достижения агрегативной устойчивости суспензий необходимо выполнение двух условий:
поверхность частиц дисперсной фазы должна смачиваться дисперсионной средой;
наличие стабилизатора.
В качестве стабилизаторов используются ПАВ и ВМС. В результате этого появляются факторы устойчивости суспензий: заряд и структурномеханический фактор защиты.
Седиментометрический анализ суспензий используется для определения размера их частиц. Для этого через определенные интервалы времени (τ) определяют массу (m) частиц суспензии, которые оседают на чашку весов, опущенную в суспензию.
Потом вычисляют скорость седиментации (u):

u m ,
и рассчитывают размер частиц (r) по уравнению:
u 2r 2 ( o ) g (cм. молекулярно – кинетические свойства золей).
9
Вмедицине используются суспензии серы, цинк-инсулина, некоторых антибиотиков, камфоры, ментола и др.
Пасты – это концентрированные суспензии.
Впастах не менее 25% твердых частиц, но может быть 75 – 80%. Пасты используются при лечении кожных заболеваний (грамицидиновая паста, ихтиол и др.), в стоматологии и косметике.
Пены – это высококонцентрированные гетерогенные системы, у которых дисперсная фаза – газ, а дисперсионная среда – жидкая или твердая в виде тонкой пленки между пузырьками газа.
Устойчивость пен небольшая. Для стабилизации пен используют пенообразователи. Это различные ПАВ (мыла, жирные кислоты, спирты и др.). В медицине используются пенные препараты в качестве кровеостанавливающих средств, при воспалениях кожи, при ожогах, для очистки фармпрепаратов.
XI.4. Эмульсии
Эмульсиями называются микрогетерогенные системы из несмешивающихся жидкостей с размером частиц дисперсной фазы 10-4-10-6м.
Жидкость, являющаяся дисперсной фазой, находится в диспергированном состоянии в виде капель. Одна из жидкостей в эмульсиях – любая поляр-
ная жидкость. Обозначают еѐ –В (вода), а вторая – неполярная жидкость,
называемая маслом, обозначается -М.
Типы эмульсий
В зависимости от полярности фаз различают:
1.прямые эмульсии или эмульсии первого рода. Дисперсионной средой у этих эмульсий является вода. Обозначают их М/В;
2.обратные эмульсии или эмульсии второго рода, у которых дисперсионной средой является масло. Они обозначаются как В/М.
В зависимости от концентрации дисперсной фазы эмульсии классифицируют следующим образом:
- разбавленные (концентрация дисперсной фазы не более 0,1% об.); - концентрированные (концентрация дисперсной фазы 0,1 ÷ 74% об.);
- высококонцентрированные (концентрация дисперсной фазы больше 74% объема эмульсии).
В разбавленных и концентрированных эмульсиях капли дисперсной фазы имеют шарообразную форму. В высококонцентрированных эмульсиях
капли имеют форму многогранников, а дисперсионная среда располагается в виде прослоек между деформированными каплями.
От концентрации дисперсной фазы эмульсий зависят их основные свойства.
Разбавленные эмульсии по свойствам близки к лиофобным золям. В таких эмульсиях из-за малых размеров капель наблюдаются броуновское движение, диффузия, рассеяние света, они являются седиментационноустойчивыми. Их агрегативная устойчивость так же, как в лиофобных золях, определяется наличием диффузных электрических слоев. Коагуляция под действием электролитов подчиняется правилу Шульце-Гарди.
Вконцентрированных эмульсиях капли хорошо видны в оптический микроскоп. Концентрированные эмульсии седиментационно неустойчивы, т.к. вследствие высокой концентрации капли находятся между собой в постоянном контакте и легко наступает коалесценция – расслоение жидкостей. Устойчивость таких эмульсий полностью зависит от эмульгатора.
Ввысококонцентрированных эмульсиях отсутствуют молекулярнокинетические свойства. Такие эмульсии по своим свойствам сходны со структурированными системами – гелями.
Эмульсии получают методами диспергирования (эмульгирования) и конденсации. Так как эмульсии являются гетерогенными системами, поэтому они термодинамически неустойчивы. Седиментационная устойчивость эмульсий определяется их дисперсностью, различием плотностей дисперсной фазы и дисперсионной среды, вязкостью среды.
Агрегативную устойчивость концентрированных эмульсий обеспечивают стабилизаторы – эмульгаторы. Эмульгаторы – это растворимые ПАВ и ВМС, или нерастворимые порошки.
Устойчивые эмульсии получаются тогда, когда эмульгатор растворяется в дисперсионной среде или смачивается ею (правило Банкрофта).
Таким образом, для получения эмульсий типа М/В необходимы гидро-
фильные эмульгаторы (мыла щелочных металлов, белки, порошки CaCO3, Al2O3, глина и др.), т.е. эмульгатор должен быть родственен дисперсионной среде. Для эмульсий типа В/М нужны гидрофобные эмульгаторы (мыла многовалентных металлов, каучук, холестерин, порошки сажи (С), канифоли и др.).
Так, в случае гидрофильного ПАВ получается устойчивая эмульсия типа М/В, т.к. ПАВ адсорбируется на границе раздела фаз и снижает межфазное поверхностное натяжение (рис. XI.11, а). Ионогенные ПАВ сообщают частицам дисперсной фазы еще и заряд. Например, если эмульгатор –
С17Н33СООNa, то вся капля масла приобретает отрицательный заряд, что будет способствовать еще большей стабильности эмульсии. На капельках воды
вэмульсии В/М (рис. XI.11, б) молекулы гидрофильного эмульгатора не могут образовать защитную пленку. В результате капельки воды подвергаются коалесценции – произойдет расслоение системы на составляющие еѐ жидкости (на схеме такая эмульсия перечѐркнута).

Рис. XI.11. Схема действия гидрофильного ПАВ.
Эмульгирующее действие твердых веществ связано со смачиваемостью порошка той или иной жидкостью, входящей в состав эмульсии.
В случае гидрофильного твердого порошка тоже стабилизируется эмульсия М/В, поскольку эмульгатор большей своей частью располагается на наружной поверхности дисперсной фазы - «М», создавая структурномеханический фактор защиты – механически прочную оболочку («корочку»). Это препятствует слиянию капель дисперсной фазы «М» – коалесценции (рис. XI.12, а). Эмульсия В/М в присутствии такого эмульгатора разрушается, потому что твердые частицы эмульгатора почти полностью втягиваются внутрь водной капельки и не образуют вокруг капли «В» сплошного слоя, способного защитить эту капельку от слияния с другими каплями при их столкновении (рис. XI.12, б).
Рис. XI.12. Схема эмульгирующего действия твердого гидрофильного эмульгатора.
а– эмульсия М/В, б – эмульсия В/М.
Итак, для получения устойчивой эмульсии любого типа требуется:
-определенное соотношение двух несмешивающихся жидкостей;
-соответствующий эмульгатор;
-энергичное перемешивание.
Кэмульгатору предъявляются следующие требования:
1. Геометрическое (стерическое) требование.
Суть его в том, что молекулы ПАВ должны создать на поверхности капель дисперсной фазы эмульсии защитный слой толщиной 6∙10-10 м и более (радиус действия поверхностных сил жидкости). Это требование могут обеспечить ПАВ, содержащие в углеводородной цепи 12 и более углеродных атомов.
2.Энергетическое требование – молекулы ПАВ должны прочно удерживаться на поверхности капель эмульсии.
3.Концентрационное требование сводится к наличию определенной концентрации ПАВ, обеспечивающей насыщение им адсорбционного слоя на межфазной границе.
В основу выбора эмульгатора положен его гидрофильно-липофильный баланс (ГЛБ). Это баланс (соотношение) между гидрофильными и гидрофобными группами ПАВ. Чем больше гидрофильная часть преобладает над гидрофобной, тем выше число ГЛБ. Все известные в настоящее время эмульгаторы имеют ГЛБ от 1 до 40. В фармации для стабилизации эмульсий В/М используются эмульгаторы с ГЛБ < 10 (3 8), а для эмульсий М/В - больше 10. Часто используются смеси эмульгаторов, поскольку ГЛБ смеси является величиной аддитивной.
Обращение фаз эмульсий – это переход эмульсии одного типа в дру-
гой.
Например, если к эмульсии М/В (эмульгатор олеат натрия) прибавить достаточное количество CaCl2, то можно получить эмульсию В/М, так как в результате реакции
2C17H33COONa + CaCl2 → (C17H33COO)2Ca + 2NaCl
образуется олеат кальция, который стабилизирует эмульсию В/М. Разрушение эмульсий (деэмульгирование) можно произвести путем: 1) изменения природы эмульгатора; 2)центрифугирования; 3) высокой температуры и др.
Тип эмульсий можно определить:
1)измерением электрической проводимости;
2)смешением эмульсии с избытком полярной и неполярной жидкости;
3)окрашиванием водорастворимыми или маслорастворимыми красителями;
4)по смачиванию.
Эмульсии широко используются в медицине. Эмульсии второго рода используются, как «наружное» средство (стрептоцидовая, нафталановая эмульсии). Эмульсии первого рода используются для внутреннего применения. Например: эмульсия тетрахлорэтилена – против гельминтов. При ожогах используют эмульсии, содержащие 97% масла с добавлением бактерицидных
иобезболивающих средств. При отравлениях используется эмульсия этилааминбензоата.
Примерами эмульсий, встречающихся в природе, являются молоко, яичный желток, млечный сок растений, лимфа, кровь, жировая клетчатка и др. В крови и лимфе жиры находятся в виде эмульсий. В процессе усвоения жиров происходит их эмульгирование в кишечнике солями желчных кислот. В форме эмульсии происходит всасывание жиров в кровь через стенку кишечника
иих ферментативный гидролиз.
XI.5. Коллоидные (мицеллярные) ПАВ
Коллоидные ПАВ – это вещества, способные в одном и том же
растворителе в зависимости от условий образовывать истинный и коллоидный растворы.
К коллоидным ПАВ относятся: мыла, соли желчных кислот, детергенты (синтетические моющие средства), алкалоиды, некоторые красители и др..
Для таких систем характерно равновесие:
истинный раствор |
|
лиофильный коллоидный раствор |
(молекулы ПАВ) |
|
(мицеллы из молекул ПАВ) |
Мицеллярные растворы ПАВ – это системы термодинамически устойчивые, равновесные и обратимые.
В разбавленных растворах эти вещества находятся в виде отдельных молекул и ионов (истинный раствор). С увеличением концентрации ПАВ их дифильные молекулы за счет гидрофобных взаимодействий углеводородных радикалов и сильного взаимодействия полярных групп с водой начинают ассоциировать и образуются мицеллы, т.е. образуется новая фаза. Мицеллообразование возникает у ПАВ, содержащих не менее 8-10 атомов углерода в цепи.
Мицелла лиофильного золя – это ассоциат дифильных молекул, лиофильные группы которых обращены к растворителю, а лиофобные группы соединяются друг с другом с образованием ядра.
Число молекул ПАВ, составляющих мицеллу, называется числом ассоциации n. Это число быстро увеличивается в узком интервале концентраций ПАВ обычно от 20 до 100 и более. Для ионогенных ПАВ n увеличивается при понижении температуры и добавлении электролитов. Для неионогенных ПАВ повышение температуры способствует увеличению n, а введение электролитов не влияет на число ассоциации.
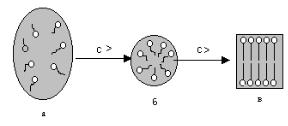
Форма образующихся мицелл зависит от концентрации (с) раствора. Например, мыло С17Н35СООNa при концентрации меньше 1% образует истинный раствор (рис. XI.13, а). При концентрации выше 1% в растворе мыла начинается мицеллообразование. Образуются сферические мицеллы (рис. XI.13, б). При более высоких концентрациях образуются пластинчатые мицеллы (рис. XI.13, в).
Рис. XI.13. Образование мицелл коллоидного ПАВ.
Когда весь объем раствора займут мицеллы, раствор теряет текучесть и превращается в гель.
Таким образом, изменяя концентрацию ПАВ, можно вызывать обратимые переходы в этой сложной равновесной системе:
истинный раствор коллоидный раствор гель (связнодисперсная система).
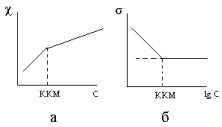
Минимальная концентрация коллоидного ПАВ, при которой происходит образование мицелл, называется критической концентрацией мицеллообразования (ККМ).
Величина ККМ является важной количественной характеристикой мицеллярных растворов ПАВ. Определение ККМ основано на изучении различных свойств этих растворов: электрической проводимости, поверхностного натяжения (рис. XI.14, а, б.), осмотического давления и др., которые изменяются при образовании мицелл.
Рис. XI.14. Концентрационная зависимость удельной электрической проводимости (а) и поверхностного натяжения (б) растворов коллоидных ПАВ.
ККМ зависит от строения и длины углеводородного радикала, природы полярной группы, наличия в растворе электролитов и температуры.
Одним из важнейших свойств растворов мицеллярных ПАВ является
солюбилизация.
Самопроизвольный переход нерастворимых или малорастворимых низкомолекулярных соединений в водную фазу в присутствии коллоидных ПАВ называется солюбилизацией.
Процесс солюбизации включает две стадии: 1) диффузию молекул солюбилизируемого вещества (солюбилизата) к поверхности мицеллы ПАВ и 2) проникновение этого вещества в структуру мицеллы коллоидного ПАВ.
Солюбилизироваться могут либо дифильные молекулы, либо молекулы, полярность которых близка к полярности ядра мицеллы коллоидного ПАВ. Так, мицеллы ПАВ в водных средах могут солюбилизировать неполярные углеводороды, а также вещества дифильной природы: спирты, амины, жиры, белки. Способ включения солюбилизата в структуру мицеллы зависит от свойств его молекул:
Неполярные молекулы углеводородов, внедряясь в мицеллы, распола-
гаются внутри их гидрофобных ядер.
Растворение неполярного вещества бензола в концентрированном растворе коллоидного ПАВ показано схематично на рисунке XI.15.
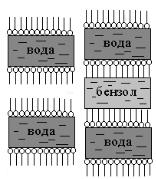
Рис. XI.15. Схема солюбилизации.
Дифильные молекулы спиртов или аминов внедряются между молекулами ПАВ в мицеллах таким образом, что полярные группы молекул солюбилизата обращены к воде, а неполярные фрагменты ориентированы параллельно углеводородным радикалам в ядрах мицелл. При солюбилизации углеводородные цепи в мицеллах раздвигаются, в результате чего размер мицелл увеличивается.
Для неионогенных ПАВ характерен 3-й способ включения солюбилизата в мицеллы: молекулы солюбилизата, например, фенола, не прони-
кают внутрь мицелл, а закрепляются на их поверхности.
Способность коллоидных ПАВ солюбилизировать углеводороды возрастает с ростом концентрации ПАВ. Солюбилизация в водных растворах ПАВ обычно увеличивается с повышением гидрофобности ПАВ и гидрофильности солюбилизата. Процесс солюбилизации носит самопроизвольный
иобратимый характер и не нарушает устойчивость дисперсной системы.
Вфармации в качестве солюбилизатора используются Твины (ГЛБ=1516) для получения водорастворимых препаратов из нерастворимых в воде веществ: камфоры, гормонов, витаминов А, Е и др.
Мицеллярные ПАВ увеличивают адсорбцию лекарственных веществ. Присутствие мицеллярных ПАВ изменяет скорость всасывания лекарственных препаратов. Огромна и гигиеническая (моющая) роль коллоидных ПАВ. Многие катионные и анионные ПАВ обладают сильным антимикробным действием и используются в хирургии в качестве антисептиков. Коллоидные ПАВ используются в качестве стабилизаторов при получении суспензий и эмульсий. Мицеллы коллоидных ПАВ рассматриваются как модели биологических мембран. Мицеллы солей желчных кислот играют важную роль в транспорте липидов. Они солюбилизируют в организме холестерин.
