

Техника безопасности при работе в лаборатории
При проведении практических занятий по химии приходится иметь дело с горючими и легко воспламеняющимися жидкостями, щелочами и ядовитыми веществами. Поэтому необходимо соблюдать следующие правила.
Содержите рабочее место в чистоте.
Всегда работайте только с небольшими количествами веществ.
Реактивы не следует брать руками. После окончания экспериментов руки необходимо тщательно вымыть.
В лаборатории нельзя принимать пищу.
Нельзя пробовать реактивы на вкус, за исключением тех случаев, когда это делается по указанию преподавателя.
При определении запаха следует пары вещества направлять к носу взмахом ладони.
Все работы с вредными, взрывоопасными, пожароопасными веществами, с концентрированными кислотами и щелочами проводите в вытяжном шкафу.
При нагревании жидкости пробирку держите отверстием от себя и от других, находящихся рядом.
Работа с концентрированными кислотами требует максимального внимания и осторожности, особенно при нагревании. Ожоги концентрированными кислотами очень
болезненны, сопровождаются трудно заживающими и оставляющими рубцы язвами. Особенно нужно опасаться поражения глаз. Платье и обувь разрушаются от действия концентрированных кислот. При работе необходимо соблюдать следующие правила:
а) серную кислоту смешивайте с водой, приливая кислоту к воде небольшими порциями; азотную кислоту смешивайте с серной, приливая азотную к серной небольшими порциями; пробирки со смесями кислот следует охлаждать водой;
б) нельзя перемешивать кислоты с какими-либо веществами в пробирке, встряхивать, закрывая ее пальцем, так как при этом неизбежны ожоги от выброшенных из пробирок брызг кислот; перемешивать кислоты в пробирке можно только слегка ударяя пальцем по нижней части пробирки;
в) концентрированные кислоты нельзя выливать в раковину во избежание порчи канализационных труб и выброса кислоты из раковины, их следует сливать в специальную посуду.
Работу с ядовитыми веществами (ацетиленом, бромом) производите только в вытяжном шкафу.
Запрещается бросать в раковину кусочки карбида кальция, сливать эфиры, жиры, вязкие растворы — сливайте их в специальную посуду, указанную преподавателем.
При работе с металлическим натрием необходимо соблюдать следующие правила:
а) натрий вынимайте из банки пинцетом; отрежьте ножом необходимое количество, остальное тотчас же поместите в банку с керосином;
б) отрезанный кусочек металлического натрия очистите ножом от корки, высушите фильтровальной бумагой, чтобы удалить керосин, и сейчас же вводите в реакционную смесь, фильтровальную бумагу необходимо сжечь;
в) нельзя остатки натрия выбрасывать в раковину (возможен взрыв!) или в ведро для мусора (возможен пожар!); остатки натрия или поместите опять в банку с керосином, или уничтожьте, растворив его в спирте;
г) во время работы берите минимальное количество металлического натрия (0,1—0,4 г).
13. Все отработанные реактивы сливайте в специальную посуду.
Горячие предметы ставьте только на подставки.
Сосуды с реактивами после употребления закрывайте пробками и ставьте на соответствующие места.
При работе с огнеопасными веществами следите, чтобы поблизости не было открытого огня или сильно нагретых предметов.
Посуду с огнеопасными веществами сразу после их использования следует плотно закрыть и убрать в безопасное место.
При работах с газами, дающими взрывчатые смеси с воздухом, например с метаном, этиленом, ацетиленом, необходимо соблюдать особую осторожность. В лаборатории газовые баллоны должны быть установлены в вертикальном положении в стойке или прочно прикреплены к рабочему столу. При этом необходимо проследить, чтобы штуцер и редуктор были направлены в ту сторону, где нет людей.
В случае вспышки горючих жидкостей в пробирке не бросайте ее, а закройте чем-либо отверстие пробирке. Если горящая жидкость разлилась по поверхности стола или пола, то очаг огня необходимо тотчас же засыпать песком, накрыть влажным одеялом или воспользоваться огнетушителем. В случае вспышки одежды на работающем следует плотно обернуть горящего полотенцем или одеялом.
Первая помощь при ожогах и отравлениях
При термических ожогах необходимо быстро сделать примочку раствором марганцевокислого калия и покрыть обожженное место мазью от ожогов, например сульфидиновой эмульсией.
При ожогах кислотами сначала хорошо промойте обожженное место водой, а затем раствором гидрокарбоната натрия.
При ожогах сухими щелочами промойте обожженное место водой, а затем 1 %-ным раствором уксусной кислоты.
При попадании на кожу разъедающих органических веществ необходимо быстро смыть их большим количеством подходящего растворителя, например спиртом или бензолом, взяв их в большом количестве.
При ожогах кожи бромом быстро промойте обожженное место спиртом и смажьте мазью от ожога
В случае вдыхания хлора или паров брома следует вдыхать спирт, а затем выйти на свежий воздух.
При попадании в глаз кислоты или щелочи необходимо промыть глаз водой, затем щелочь смывают 2%-ным раствором борной кислоты, а кислоту— 1%-ным раствором гидрокарбоната натрия.
При всех случаях ранений, ожогов и отравлений после оказания первой помощи пострадавшего следует немедленно отправить в поликлинику
ЛАБОРАТОРНЫЕ РАБОТЫ ПО ОРГАНИЧЕСКОЙ ХИМИИ
ЛАБОРАТОРНАЯ РАБОТА №1. КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ
ТЕМА: Обнаружение углерода, водорода, хлора в органических веществах. Получение метана и изучение его свойств.
Органические вещества кроме углерода содержат водород, кислород, азот, реже серу, фосфор, галогены и другие элементы. Для определения элементного состава органических веществ производят качественный анализ. В процессе анализа определяемые элементы вначале переводят в неорганические соединения, а затем открывают их обычными характерными реакциями.
Реактивы. Глицерин, сахар или мука; хлороформ СН3Сl; этиловый спирт С2Н5ОН ;; мочевина; яичный белок; сахар; известковая (или баритовая Ва(ОН)2) вода Са(ОН)2; соляная кислота раствор НСl; гидроксид натрия NаОН; хлорид железа (III) FеСl3, 0,5%-ный раствор; хлорид натрия NаСl; сульфат железа (II) FеSО4; сульфат меди (II) СuSО4 (безводный); оксид меди (II)СuО; медная проволока; фенолфталеин, Nа металлический, раствор серной кислоты Н2SО4, свежеприготовленного раствора нитропруссида натрия Nа2[Fе(СN)5(NО)]
Оборудование. Пробирка с газоотводной трубкой; стакан; воронка; предметные стекла; фарфоровая чашка (или крышка тигля); фарфоровый треугольник; фильтровальная бумага; вата.
Опыт 1. Открытие углерода и водорода
В сухую пробирку с газоотводной трубкой внесите 0,2—0,3 г сахара или около 1 мл глицерина и 1—2 г оксида меди и тщательно перемешайте. В верхнюю часть пробирки поместите комочек ваты, на которую насыпьте немного безводного сульфата меди. Закройте пробирку пробкой с газоотводной трубкой и закрепите ее в штативе (рис. 1). Приготовьте пробирку с известковой водой. Конец газоотводной трубки введите в пробирку с известковой водой почти до поверхности воды Сначала прогрейте всю пробирку, а затем сильно нагрейте ту часть, где находится смесь оксида меди с органическим веществом.
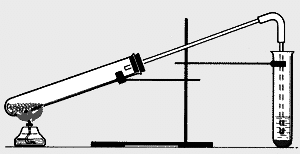
Рис.1
Что произошло с известковой водой? Как изменился цвет сульфата меди в пробирке на вате? Почему? На основании чего можно сделать вывод о наличии углерода и водорода в органическом веществе?
С6Н12О6 + 12СuО = 6СО2↑ +6Н2О + 12Сu
СО2 + Ва(ОН)2 = ВаСО3 +Н2О СuSО4 + 5Н2О = СuSО4 · 5Н2О
Опыт 2. Открытие галогенов
При прокаливании в присутствии оксида меди органического вещества, содержащего галоген, галогены образуют с медью соли, пары которых окрашивают пламя в ярко-зеленый цвет.
Медную проволоку с загнутым в виде петельки концом прокалите до образования на поверхности слоя оксида меди ( покроется чёрным налётом) и исчезновения посторонней окраски пламени. После охлаждения смочите кончик проволоки испытуемым веществом (хлороформом, четыреххлористым углеродом) и внесите в пламя горелки. немедленно появится характерная ярко-зелёная окраска.
Сделайте вывод о наличии галогенов. 2СНСl3+ 5СuО = СuСl2+4СuСl + 2СО2↑ +Н2О
Опыт 3. Определение азота сплавлением вещества с металлическим натрием
В сухую пробирку помещают 5—10 мг мочевины (несколько кристаллов) и вносят небольшой кусочек металлического натрия. Смесь осторожно нагревают в пламени микрогорелки до сплавления мочевины с натрием. При этом иногда наблюдается небольшая вспышка.
После охлаждения пробирки со сплавом в нее добавляют 3 капли этилового спирта для устранения остатков металлического натрия, который реагирует со спиртом не так бурно, как с водой. При этом образуется алкоголят натрия и выделяется водород: (напишите уравнение реакции)
Затем в пробирку добавляют 5 капель дистиллированной воды и нагревают на пламени горелки для растворения образовавшегося цианистого натрия. С помощью пипетки переносят раствор цианистого натрия на предметное стекло, добавляют 1 каплю железного купороса и 1 каплю хлорида железа (III), которые в присутствии щелочи, образовавшейся при реакции алкоголята натрия с водой (напишите уравнение)
дают грязно-зеленый осадок гидроксида железа (П) Fе(ОН) 2 и желтый осадок гидроксида железа (III) Fе(ОН)3.
Наносят пипеткой на фильтровальную бумагу (ЗО*ЗО мм) 1 каплю мутной жидкости. После того как капля впитается, на это же место наносят 1 каплю соляной кислоты.
Nа + (С)+ (N) = NаСN
FеSО4 + 2NаОН = Fе(ОН)2 + Nа2SО4
FеСl3 + 3NаОН = Fе(ОН)3 + 3NаСl
NаСN + FеSО4 = Fе(СN)2 + Nа2SО4
Fе(СN)2 + 4NаСN = Nа4[Fе(СN)6]
Образовавшийся комплекс с солями железа (III) может дать синий осадок — берлинскую лазурь. Однако присутствующая в растворе щелочь связывает ионы Fе3+ в гидроксид железа (III). Поэтому берлинская лазурь может образоваться только после растворения гидрокисда в кислоте:
Fе(ОН)3 + ЗНС1 →FеС13 + ЗН20
3Nа4[Fе(СN)6] + 4FеС13 → Fе4[Fе(СN)6]3 + 12NаС1
берлинская лазурь
При проведении опыта необходимо обратить внимание на то, чтобы натрий плавился вместе с органическим веществом. Если натрий плавится отдельно от вещества, то даже при наличии в веществе азота цианистый натрий не образуется и опыт будет неудачным.
Опыт 4. Определение серы сплавлением вещества металлическим натрием
В сухую пробирку помещают испытуемое вещество, например белый стрептоцид или сульфаниловую кислоту (несколько крупинок — 5—6 мг), и вносят небольшой кусочек металлического натрия. Держа пробирку вертикально, нагревают смесь докрасна, чтобы натрий плавился в смеси с веществом. Затем пробирку со сплавом охлаждают и добавляют в нее 3 капли этилового спирта для удаления остатка металлического натрия. После окончания выделения пузырьков газа (водорода) сплав растворяют при нагревании в 5 каплях дистиллированной воды. Складывают вместе два кусочка фильтровальной бумаги 30X30 мм и наносят с помощью пипетки по 2 капли темной жидкости на противоположные углы бумажки . Верхняя фильтровальная бумажка служит фильтром, через который фильтруется раствор сернистого натрия от частичек угля, образовавшегося при обугливании вещества. На нижней фильтровальной бумажке остаются два бесцветных пятна. На одно из них наносят каплю раствора уксуснокислого свинца: мгновенно появляется коричневое окрашивание от образовавшегося сульфида свинца. На другое пятно наносят каплю свежеприготовленного раствора нитропруссида натрия Nа2[Fе(СN)5(NО)]тотчас появляется красно-фиолетовое окрашивание, постепенно изменяющее свой цвет. Эта цветная реакция на ион S2- обусловлена образованием комплексной соли состава Nа4[Fе(СN)5(NО)S].
2Nа+[S]=Nа2S; Nа2S+(СН3СОО)2Рb=РbS+СН3СООNа
Nа2S+Nа2[Fе(СN)5(NО)]=Nа4[Fе(СN)5(NО)S].
ЛАБОРАТОРНАЯ РАБОТА № 2 ПОЛУЧЕНИЕ И СВОЙСТВА ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ. АЛКАНЫ
В предельных, или насыщенных, углеводородах (парафинах) связи С — С и С — Н являются δ-связями. Такие связи очень прочны и мало поляризованы, поэтому реакционная способность таких углеводородов невелика. Для них характерны реакции замещения, протекающие по свободнорадикальному цепному механизму.
Реактивы. Ацетат натрия (обезвоженный) СН3СООNа; смесь этилового спирта с концентрированной серной кислотой (1 :3); этиловый спирт С2Н5ОН; натронная известь (смесь твердого едкого натра и гашеной извести) (NаОН+ Са(ОН)2); бромная вода; раствор перманганата калия КМnО4; серная кислота (разбавленная и концентрированная) Н2SО4; карбид кальция СаС2;
Оборудование. Пробирка с газоотводной трубкой; стеклянная банка вместимостью 100 мл, кристаллизатор; битый фарфор или песок; вата; крышка картонная.
Опыт 1. Получение и свойства метана
В сухую пробирку насыпьте смесь измельченного уксуснокислого натрия с катализатором и натронной известью (0,5 г катализатора, 0,5 г СН3СООNа и 1 г натронной извести). Закройте пробирку пробкой с газоотводной трубкой. Пробирку закрепите в штативе, как показано на рис. 3, чтобы образующаяся вода не стекала на горячую часть пробирки. Возьмите две пробирки и налейте в одну из них раствор КМпО4, а в другую — бромную воду. Нагревайте пробирку с газоотводной трубкой вначале около дна, постепенно передвигая горелку дальше, чтобы в реакцию вступали новые порции смеси. Получающийся метан пропустите в заранее приготовленные пробирки, в одной из
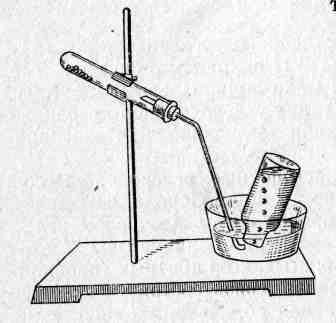
После этого подведите конец газоотводной трубки под отверстие банки с водой (рис. 2). Когда вся вода из банки будет вытеснена, уберите трубку из ванны и прекратите нагревание. Закройте под водой банку с газом бумагой или картоном, выньте ее из ванны и быстро подожгите газ. Метан горит голубоватым несветящимся пламенем. Можно поджечь рис.2 метан и у конца газоотводной трубки.
Дайте прибору остыть, а затем разберите его.
СН3СООNа + NаОН = СН4 + Nа2СО3
СН4 +2О2 = СО2 + 2Н2О
Сделайте вывод о физических и химических свойствах метана.
Вывод:
Контрольные задания по теме «Предельные углеводороды»
1.Какие соединения называют углеводородами и какова их общаяформула?
2.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а)бутан →Изобутан →(С02+Н20);б) бромметан → этан → водород →метан → (С02+Н20);
в) А14С3 →СН4 →СС14.
3.Какая масса сажи будет получена при термическом разложении 180 г этана, если массовая доля ее выхода составляет 80%?
Ответ: 115,2 г
4. Охарактеризуйте значение гомологов метана в народном хозяйстве.
5.Как осуществить превращения: С → СН4 →СН3Сl → С2Н6 → С2Н5Сl
ЛАБОРАТОРНАЯ РАБОТА № 3. Алкены
Непредельные, или ненасыщенные, углеводороды содержат меньшее количество атомов водорода, чем молекулы предельных углеводородов с тем же числом углеродных атомов. Для них характерно наличие между атомами углерода не только простых, но и кратных (двойной или тройной) связей. Двойная связь состоит из одной δ - и одной π-связи, а тройная образована одной δ- и двумя π-связями. Однако δ- и π-связи не идентичны по прочности: π-связь менее прочна. Для непредельных углеводородов характерна реакция присоединения за счет разрыва π-связи.Реактивы. смесь этилового спирта с концентрированной серной кислотой (1 :3); этиловый спирт С2Н5ОН; бромная вода; раствор перманганата калия КМnО4; серная кислота (разбавленная и концентрированная) Н2SО4; карбид кальция СаС2;
Оборудование. Пробирка с газоотводной трубкой; стеклянная банка вместимостью 100 мл, кристаллизатор; битый фарфор или песок; вата; крышка картонная.
Опыт 1. Получение и свойства этилена и его горение Смесь этилового спирта с серной кислотой, попадая на кожу, вызывает долго не заживающие ожоги, а попадая на одежду, разрушает ее. Поэтому нагревать смесь нужно очень осторожно, а чтобы кипение смеси было равномерным, обязательно добавляйте песок или битый фарфор. Не допускайте выброса смеси из пробирки.
С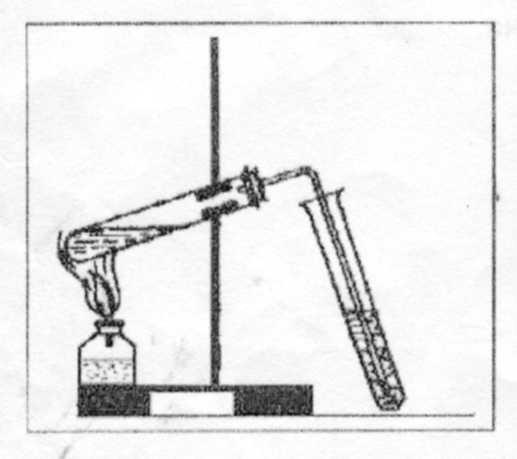 оберите
прибор, как показано на рис. 3, налейте
2— 3 мл смеси этилового спирта с
концентрированной серной кислотой,
для равномерного кипения жидкости
опустите в пробирку со смесью заранее
прокаленный песок (можно кусочки
кирпича). Приготовьте пробирки: однус
подкисленным
раствором КМnО4
(2-3 мл, не
больше), а другую с бромной водой.
Осторожно нагрейте пробирку со смесью
спирта и кислоты и пропустите выделяющийся
газ через раствор КМп04
и бромную
воду. Что наблюдаете? Объясните это
явление.
оберите
прибор, как показано на рис. 3, налейте
2— 3 мл смеси этилового спирта с
концентрированной серной кислотой,
для равномерного кипения жидкости
опустите в пробирку со смесью заранее
прокаленный песок (можно кусочки
кирпича). Приготовьте пробирки: однус
подкисленным
раствором КМnО4
(2-3 мл, не
больше), а другую с бромной водой.
Осторожно нагрейте пробирку со смесью
спирта и кислоты и пропустите выделяющийся
газ через раствор КМп04
и бромную
воду. Что наблюдаете? Объясните это
явление.
(Рис.3) Не прекращая нагревания пробирки со смесью спирта и кислоты, газоотводную трубку поверните отверстием вверх и зажгите выделяющийся газ. Обратите внимание на светимость пламени. После окончания опыта дайте пробирке остыть, вылейте смесь в специальный сосуд.
Задание: напишите уравнения следующих реакций:
1)дегидратация этилового спирта в присутствии серной кислоты
2)горение этилена
3)окисление этилена перманганатом калия
4)взаимодействие этилена с бромом. Сделайте вывод о физических и химических свойствах этилена.
Вывод:
ЛАБОРАТОРНАЯ РАБОТА № 4. Алкины
Реактивы. бромная вода; раствор перманганата калия КМnО4; серная кислота (разбавленная и концентрированная) Н2SО4; карбид кальция СаС2;
Оборудование. Пробирка с газоотводной трубкой; пробирки, штатив.
Опыт 1. Получение и свойства ацетилена
Опыты с ацетиленом проводите быстро и в вытяжном шкафу! Не выбрасывайте в раковину остатки непрореагировавшего карбида кальция.
Приготовьте две пробирки: одну с подкисленным раствором КМп04, другую с бромной водой. В пробирку с газоотводной трубкой налейте 1—2 мл воды, опустите небольшой кусочек карбида кальция, вставьте неплотный комочек ваты и быстро закройте пробирку пробкой с газоотводной трубкой. Выделяющийся ацетилен пропустите через раствор КМп04 и бромную воду. Что наблюдается? Объясните происходящее явление.
П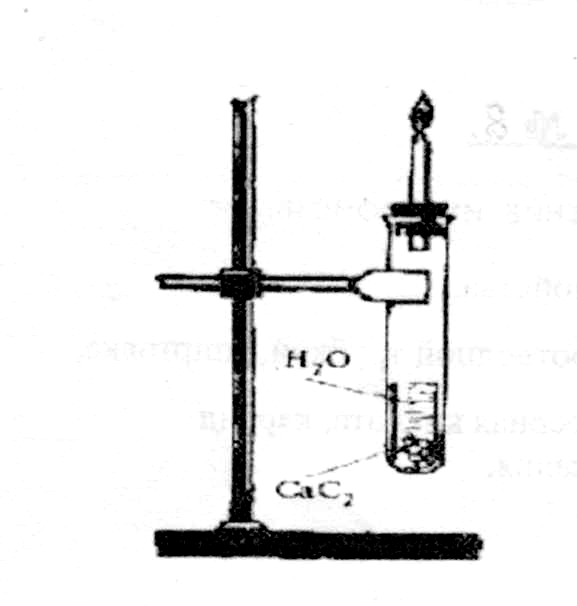 оверните
газоотводную трубку отверстием вверх
и подожгите ацетилен.(рис.4) Каким пламенем
горит ацетилен? На основании наблюдений
сделайте вывод о физических и химических
свойствах ацетилена.Вывод:
оверните
газоотводную трубку отверстием вверх
и подожгите ацетилен.(рис.4) Каким пламенем
горит ацетилен? На основании наблюдений
сделайте вывод о физических и химических
свойствах ацетилена.Вывод:
Рис.4
Напишите уравнения следующих реакций:
1)взаимодействие карбида кальция с водой
2) взаимодействие ацетилена с бромом с образованием 1,1,2,2 тетрабромэтана
3) горение ацетилена
4)НС ≡ НС → НООС – СООН → 2СО2 + Н2О
ацетилен щавелевая кислота
Контрольные задания по теме «Непредельные углеводороды»
1. Какой объем диоксида углерода получится при сжигании 3 молей этилена?
2Сколько граммов карбида кальция, в котором 7% примесей, потребуется для получения 11,2 л ацетилена?
3.Напишите структурные формулы возможных изомеров вещества, имеющего молекулярную формулу С4Нб, назовите их.
4.Напишите уравнение реакции взаимодействия ацетилена с хлороводородом. Где применяется и какими свойствами обладает полученное вещество?
5.Составьте уравнения реакций следующих превращений веществ:
СаС03-→ СаО→СаС2→С2Н2→С02→Н20
6.На основании наблюдений сделайте вывод о физических и химических свойствах этилена.
7.Массовая доля углерода в углеводороде составляет 85,7%. Его относительная плотность по водороду равна 21. Выведите его молекулярную формулу.
Ответ: С3Н6
Лабораторная работа №5 Циклоалканы и арены
реактивы и материалы: бензол х.ч.(С6Н6); этиловый спирт (С2Н5ОН), диэтилоый эфир (С2Н5-О-С2Н5), бромная вода (Вr2 +Н2О), перманганат калия (КМnО4) 0,1Н раствор, серная кислота 2Н раствор (Н2SО4).
Опыт №1 Свойства бензола. Растворимость бензола в различных растворителях.
В три пробирки помещают по одной капле бензола. В одну пробирку добавляют 3 капли воды, в другую — 3 капли спирта, в третью — 3 капли эфира. Содержимое пробирок тщательно взбалтывают. В пробирке с водой образуется 2 слоя, в пробирках со спиртом и эфиром получается однородный раствор.
Следовательно, бензол в воде практически нерастворим и хорошо растворяется в органических растворителях.
Опыт №2 Действие бромной воды на бензол.
В пробирку помещают 3 капли бромной воды и 2 капли бензола. Содержимое пробирки энергично взбалтывают и дают отстояться. Нижний слой (бромная вода) обесцвечивается, а верхний слой (бензол) окрашивается в коричневато-желтый цвет. Бром легче растворяется в бензоле, чем в воде, и поэтому переходит в верхний бензольный слой.
Присоединение брома в этих условиях не происходит.
Задание: Напишите уравнение взаимодействия бензола с бромом
Опыт №3Действие перманганата калия.
В пробирку помещают 3 капли воды, каплю раствора перманганата калия и каплю раствора серной кислоты. К полученному раствору добавляют каплю бензола и встряхивают содержимое пробирки. Розовый раствор при этом не обесцвечивается. Для этого опыта бензол предварительно очищают от примесей, охлаждая его до +5°С. При этом бензол затвердевает, а примеси остаются жидкими и легко отделяется.
Опыт №4 Окисление гомологов бензола
В пробирку помещают 3 капли воды, каплю раствора перманганата калия и 1 каплю раствора серной кислоты. Затем добавляют каплю толуола и энергично встряхивают в течение 1-2мин. Розовая окраска постепенно исчезает и раствор обесцвечивается. гомологи бензола окисляются значительно легче бензола. Боковая цепь при действии сильных окислитилей разрушается (кроме атома углерода, ближайшего к ядру – он окисляется в карбоксильную группу)
С6Н5-СН3 + 3[О]→С6Н5 –СООН + Н2О
бензойная кислота
Контрольные вопросы по теме «Бензол»
1.Какие соединения называют ароматическими?
2. Нитробензол, полученный из 117 г бензола с выходом 74% восстановили в анилин и получили 67,1 г анилина. Рассчитайте массовую долю его выхода.
3.Пользуясь текстом параграфа учебника подготовьте ответы на следующие вопросы: а) Какова молекулярная формула бензола? б) Какова общая формула углеводородов - гомологов бензола? в) На основании какого химического свойства бензола Кекуле предложил для него следующую структурную формулу г) Какие свойства бензола не объясняет формула Кекуле? д) Какова современная структурная формула бензола? Обсудите ваши ответы.
ЛАБОРАТОРНАЯ РАБОТА №6 СПИРТЫ И ФЕНОЛЫ
Спирты и фенолы являются гидроксильными производными, содержащими гидроксильную группу -ОН. Атомы водорода гидроксильных групп в спиртах проявляют определенную подвижность. Подобно воде, спирты реагируют со щелочными металлами, которые замещают водород гидроксильных групп с образованием алкоголятов (фенолятов). В реакции со щелочными металлами спирты в известной мере проявляют кислотные свойства, но в меньшей мере, чем вода. Практически спирты представляют собой нейтральные вещества: они не дают ни кислой, ни щелочной реакции на лакмус, не проводят электрический ток.
Кислотные свойства фенолов выражены в большей степени, чем. у спиртов. Под влиянием бензольного кольца водород гидроксила в фенолах более подвижен, чем в спиртах, и они обладают большими, чем спирты, кислотными свойствами (поэтому простейший фенол и был назван карболовой кислотой).
Реактивы. Глицерин, спирт этиловый С2Н5ОН; изоамиловый спирт СН3-СН-(СН3)-СН2-СН2ОН серная кислота (конц.) Н2SО4 и 20%-ная; гидроксид натрия NаОН. 10%-ный раствор; сульфат меди (II) СuSО4 безводный и 1—2%-ный раствор; фенолфталеин; лакмусовая бумага; хлорид железа (III) FеСl3 01N, 2%-ный раствор; бромная вода; фуксинсернистая кислота; фенол (крист.), раствор фенола.С6Н5ОН, спираль из медной проволоки, фенолфталеин, металлический натрий.
Оборудование. Пробирка с газоотводной трубкой; чашка для выпаривания; тигельные щипцы; фильтровальная бумага; защитные очки.
Опыт №1. Растворимость спиртов в воде
В две пробирки налейте по 2—3 мл воды и в каждую прибавьте по 1 мл: в первую — глицерина, во вторую— этилового спирта. Полученные смеси в пробирках хорошо встряхните и дайте постоять. Сделать вывод о растворимости спиртов
Вывод:

Опыт
№2.
Отношение спиртов к индикаторам
Каждый из спиртовых растворов, приготовленных в предыдущем опыте, разделите на две части. Испытайте полученные растворы спиртов на лакмус и фенолфталеин. Как изменяется окраска индикатора? Сделайте вывод о степени кислотности или щелочности спиртов
вывод:
Опыт №3. Обезвоживание спирта
В пробирку налейте 1—2 мл этилового спирта и прибавьте 1—1,5 г сульфата меди СuSО4 (безводного). Смесь хорошо перемешайте и слабо нагрейте. Что происходит с СuSО4? Почему? Есть ли вода в спирте?
Задание: Напишите уравнение реакции взаимодействия сульфата меди (II) с водой.
Опыт №4 Окисление этилового спирта оксидом меди (ll)
В сухую пробирку помещают 2 капли этилового спирта. держа спираль из медной проволоки пинцетом, нагревают её в пламени горелки до появления чёрного налёта оксида меди. Ещё горячую спираль опускают в пробирку с этиловым спиртом. Чёрная поверхность спирали немедленно становится золотистой вследствие восстановления оксида меди. при этом ощущается характерный запах уксусного альдегида (запах гнилых яблок).
Подтверждением образования уксусного альдегида может служить цветная реакция с фуксинсернистой кислотой. в пробирку помещают 3 капли раствора фуксинсернистой кислоты и пипеткой вносят 1 каплю полученного раствора. Появляется розово-фиолетовая окраска (цветная реакция на альдегид).
Задание: Напишите уравнение происходящей реакции.
Опыт №5. Окисление этилового спирта перманганатом калия
В сухую пробирку помещают 2 капли этилового спирта, 2 капли раствора перманганата калия и 3 капли раствора серной кислоты. Осторожно нагревают содержимое пробирки над пламенем горелки. Розовый раствор обесцвечивается. Ощущается характерный запах ацетальдегида. В чистую пробирку помещают 3 капли раствора фуксинсернистой кислоты и 1 каплю обесцвеченного раствора, постепенно появляется розовая окраска.
2КМnО4 + 5С2Н5ОН + 4Н2SО4 = 5 СН3СОН + 2МnSО4 + 2КНSО4 +8Н2О
Опыт №6 Получение сложных эфиров карбоновых кислот
Получение уксусноизоамилового эфира. В пробирку налейте 2 мл изоамилового спирта, 1 мл уксусной кислоты и 0,5—1 мл серной кислоты.
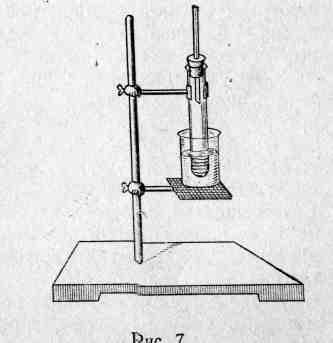
Рис.5
Смесь в пробирке осторожно перемешайте, закройте пробкой с трубкой-холодильником (рис. 5) и, закрепив пробирку на штативе, нагревайте ее на водяной бане 6—10 мин.
При этом жидкость в пробирке не должна кипеть. Через некоторое время жидкость буреет и ощущается характерный запах уксусно-изоамилового эфира - запах грушевой эссенции. Дайте жидкости остыть и вылейте в стаканчик с холодной водой. примеси растворяются в воде, а эфир распределяется на поверхности воды.
СН3-СН– СН2-СН2ОН + Н2SО4 → СН3-СН– СН2 – СН2-ОSО3Н
| |
СН3 (изоамиловый спирт) СН3
3-метил – 1-бутанол
СН3-СН(СН3)-СН2–СН2-ОSО3Н + СН3СООН→

(уксусноизоамиловый эфир)
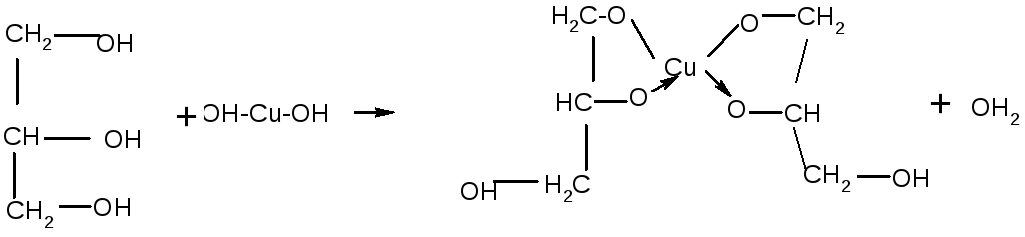
Опыт №7 Получение глицерата меди Налейте в пробирку 1—2 мл раствора сульфата меди и добавьте 10%-ный раствор гидроксида натрия до образования осадка гидроксида меди Сu(ОН)2. К полученному осадку прибавьте немного глицерина и перемешайте содержимое пробирки. Осадок растворяется и появляется тёмно-синее окрашивание вследствие образования глицерата меди. Какие химические свойства проявляет глицерин? СuSО4 + 2NаОН = Сu(ОН)2+ Nа2SО4
глицерин глицерат меди
