
- •Теплотехника теплотехника
- •1.Основные понятия и определения
- •Вопросы тестов
- •2. Первый закон термодинамики
- •Вопросы тестов
- •3.Термодинамические процессы с идеальным газом.
- •Изохорный процесс.
- •Изобарный процесс.
- •Изотермический процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Вопросы тестов
- •4. Второй закон термодинамики
- •Вопросы тестов
- •5.Влажный воздух
- •Вопросы тестов
- •6.Водяной пар
- •Процесс парообразования в hs -диаграмме
- •Вопросы тестов
- •Теплопередача
- •6.Теплопроводность
- •Вопросы тестов
- •7. Конвективный теплообмен
- •7.1. Продольное обтекание тонкой пластины.
- •7.2. Турбулентное течение теплоносителя внутри трубы.
- •Вопросы тестов
- •8. Теплообмен излучением
- •Теплообмен излучением системы тел в прозрачной среде
- •Вопросы тестов
- •9. Теплопередача
- •Вопросы тестов
- •10. Основы теплового расчета теплообменников
- •Вопросы тестов
Вопросы тестов
1.Рабочее тело совершает обратимый термодинамический процесс (цикл) a – b – c – d – a. Термическое уравнение состояния такого рабочего тела имеет вид f(p,v,T) = 0.
2.Работой расширения называется работа увеличения поверхности тела против сил поверхностного натяжения …
3.Термодинамические процессы с идеальным газом.
Метод исследования термодинамические процессов состоит в следующем:
1.Выводится уравнение процесса кривой в pv - и Ts - координатах.
2.Рассчитываются термодинамические параметры состояния p, v и Т рабочего тела в начале и в конце процесса и изменение энтропии Δs.
3. Рассчитываются изменение внутренней энергии, количество подведённой теплоты и работа процесса.
Основными называют термодинамические процессы, в которых один из термодинамических параметров состояния p,v и Т постоянен. Это изохорный (v=const), изобарный (p =const), изотермический (Т =const) и адиабатный (без внешнего теплообмена) процессы.
Изохорный процесс.
Уравнение этого процесса в pv - координатах имеет вид v = const, а график процесса (изохора) изображается в виде вертикальной линии.
Из
уравнения состояния
 следует
следует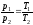

Поскольку в изохорном процессе
v = const, то работа процесса равна 0.
Согласно первому закону термодинамики (2.5), это означает, что dq = du, т.е. всё подведённое тепло идёт на изменение внутренней энергии газа.
Изобарный процесс.
Уравнение этого процесса в pv - координатах имеет вид p = const, а график процесса (изобара) изображается в виде горизонтальной линии.
Из уравнения состояния
 следует
следует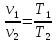
Работа расширения газа при p =const в уравнении (2.2) равна А=р(v2-v1) (3.1)
Воспользовавшись уравнением
состояния, можно получить другую формулу
для вычисления работы
А=
Rµ
(T2-T1)
.
В Ts – координатах изобарный процесс изображается логарифмической кривой, но эта кривая более пологая по сравнению с изохорой (1-2´).
Изотермический процесс.
Уравнение этого процесса в Ts - координатах имеет вид T = const, а график процесса (изотерма) изображается в виде горизонтальной линии.
Из уравнения (2.1) следует
∆u=
0. Тогда согласно
первому закону термодинамики (2.5) q
= A,
т.е. вся подводимая к газу теплота
расходуется на совершение работы
расширения.
Из
уравнения состояния
 следует
следует , т.е. давление и удельный объём обратно
пропорциональны друг другу.
, т.е. давление и удельный объём обратно
пропорциональны друг другу.
Адиабатный процесс.
Адиабатным называется
процесс при отсутствии теплообмена
газа с внешней средой dq
= 0. По определению
энтропии ds
=
 , тогда иds
= 0, т.е. адиабатный
процесс одновременно ещё и изоэнтропийный.
График процесса (адиабата) в Ts
- координатах изображается в виде
вертикальной линии.
, тогда иds
= 0, т.е. адиабатный
процесс одновременно ещё и изоэнтропийный.
График процесса (адиабата) в Ts
- координатах изображается в виде
вертикальной линии.
По первому закону термодинамики (2.5) ∆u = - A, т.е. работа расширения совершается только за счёт уменьшения внутренней энергии.
Уравнение этого процесса в pv - координатах имеет вид pvк = const, (3.2)
где
параметр k
=
 называется показателем адиабаты.
Поскольку cp>cv,
то величина k>1.
На рабочей pv
– диаграмме адиабата падает более круто
по сравнению с изотермой при увеличении
v.
называется показателем адиабаты.
Поскольку cp>cv,
то величина k>1.
На рабочей pv
– диаграмме адиабата падает более круто
по сравнению с изотермой при увеличении
v.

Из совместного решения
уравнения состояния
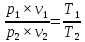 и уравнения процессаp1v1к
=
p2v2к,
можно получить :
и уравнения процессаp1v1к
=
p2v2к,
можно получить :
 =
= и
и
 =
=
